Selenoylfluorid - Selenoyl fluoride
 | |
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Seo2F2 | |
| Molární hmotnost | 148,95 g / mol |
| Vzhled | Plyn. |
| Bod tání | -99,5 ° C (-147,1 ° F; 173,7 K)[1] |
| Bod varu | -8,4 ° C (16,9 ° F; 264,8 K)[2] |
| Související sloučeniny | |
jiný kationty | TAK2F2 |
Související sloučeniny | SeF6, Seo3 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
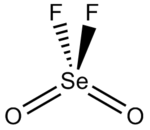
Selenoylfluorid, selenoyl difluorid, seleniumoxyfluoridnebo selenium dioxydifluorid je chemická sloučenina s vzorec Seo2F2.
Struktura
Tvar molekuly je zkreslený čtyřstěn, přičemž úhel O-Se-O je 126,2 °, úhel O-Se-F je 108,0 ° a F-Se-F je 94,1 °.[3] Délka vazby Se-F je 1,685 Á a vazba selenu na kyslík je 1,575 Á.[4]
Formace
Selenoylfluorid může vznikat působením tepla kyselina fluorsulfonová na selenan barnatý[5] nebo kyselina selenová. Seo3 + SeF4 může tento plyn dávat spolu s dalšími oxyfluoridy.
Reakce
Selenoylfluorid je reaktivnější než jeho analog sulfurylfluorid. Je snadnější hydrolyzovat a redukovat. Při kontaktu s může reagovat prudce amoniak.
Selenoylfluorid reaguje s xenon difluorid dává FXeOSeF5.[6]
Reference
- ^ CRC Handbook of Chemistry and Physics
- ^ Seppelt, K.. "Selenoyl difluorid" Anorganické syntézy1980, svazek XX, s. 36-38. ISBN 0-471-07715-1.
- ^ Wai-Kee Li, Gong-du Zhou, Thomas C. W. Mak Pokročilá strukturní anorganická chemie strana 651 2008 ISBN 0-19-921694-0
- ^ Kolbjørn Hagen, Virginia R. Cross a Kenneth Hedberg „Molekulární struktura selenonylfluoridu, SeO2F2a sulfurylfluorid, SO2F2, jak je určeno difrakcí elektronů v plynné fázi " Journal of Molecular Structure 1978, svazek 44, vydání 2, strana 187 doi:10.1016/0022-2860(78)87027-6
- ^ Advanced Anorganic Chemistry Obsáhlý text Bavlna a Wilkinson
- ^ https://www.scribd.com/doc/30122309/Noble-Gas-Compounds
