Trifluorid arsenitý - Arsenic trifluoride
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Fluorid arsenitý | |||
| Ostatní jména Trifluorid arsenitý, trifluorarzan | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.029.145 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| AsF3 | |||
| Molární hmotnost | 131,9168 g / mol | ||
| Vzhled | bezbarvá kapalina | ||
| Hustota | 2,666 g / cm3[1] | ||
| Bod tání | -8,5 ° C (16,7 ° F; 264,6 K) | ||
| Bod varu | 60,4 ° C (140,7 ° F; 333,5 K) | ||
| rozkládá se | |||
| Rozpustnost | rozpustný v alkohol, éter, benzen a amoniak řešení | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Toxický, žíravý | ||
| Piktogramy GHS |  | ||
| Signální slovo GHS | Nebezpečí | ||
| H301, H311, H331 | |||
| P261, P264, P270, P271, P280, P301 + 310, P302 + 352, P304 + 340, P311, P312, P321, P322, P330, P361, P363, P403 + 233, P405, P501 | |||
| NIOSH (Limity expozice USA zdraví): | |||
PEL (Dovolený) | TWA 0,010 mg / m3[2] | ||
REL (Doporučeno) | Ca C 0,002 mg / m3 [15 minut][2] | ||
IDLH (Okamžité nebezpečí) | Ca [5 mg / m3 (jako As)][2] | ||
| Termochemie | |||
Std entalpie of formace (ΔFH⦵298) | -821,3 kJ / mol | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
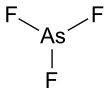
Trifluorid arsenitý je chemická sloučenina z arsen a fluor s chemickým vzorcem AsF3. Je to bezbarvá kapalina, která snadno reaguje s vodou.[3]
Příprava a vlastnosti
Může být připraven reakcí fluorovodík, HF, s oxid arzenitý:[3]
- 6HF + As2Ó3 → 2AsF3 + 3H2Ó
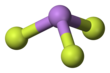
Má pyramidovou molekulární strukturu v plynné fázi, která je také přítomna v pevné látce.[3] V plynné fázi je délka vazby As-F 170,6 pm a úhel vazby F-As-F 96,2 °.[4]
Arfluorid arsenitý se používá jako fluorující nekovové chloridy na fluoridy, v tomto ohledu je méně reaktivní než SbF3.[3]
Soli obsahující AsF4− anion lze připravit například CsAsF4.[5] draselná sůl KAs2F7 připraveno z KF a AsF3 obsahuje AsF4− a AsF3 molekuly s důkazem interakce mezi AsF3 molekula a anion.[6]
AsF3 reaguje s SbF5. Získaný produkt lze popsat jako iontový adukt AsF2+ SbF6−. Autoři však dospěli k závěru, že na vytvořený produkt nelze pohlížet pouze jako na iontovou sloučeninu, ani jako na neutrální adukt AsF3SbF5. Krystalová struktura vytvořené sloučeniny vykazuje vlastnosti jak iontového páru, tak strukturálních motivů neutrálního aduktu, přičemž zaujímá střed mezi oběma modely popisu molekul. [7]
Reference
- ^ Pradyot Patnaik. Handbook of Anorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0038". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b C d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Wells A.F. (1984) Strukturní anorganická chemie 5. vydání Oxford Science Publications ISBN 0-19-855370-6
- ^ Nové alkalické kovy a tetramethylamoniumtetrafluorosenáty (III), jejich vibrační spektra a krystalová struktura tetrafluorosenátu cesného (III) Klampfer P, Benkič P, Lesar A, Volavšek B, Ponikvar M, Jesih A., Collect. Čeština. Chem. Commun. 2004, 69, 339-350 doi:10.1135 / cccc20040339
- ^ Heptafluorodiarsenáty alkalických kovů (III): jejich příprava a krystalová struktura draselné soli, Edwards A.J., Patel S.N., J. Chem. Soc., Dalton Trans., 1980, 1630-1632, doi:10.1039 / DT9800001630
- ^ Fluoridové krystalové struktury. Část XV. Trifluorid arsenitý - pentafluorid antimonitý, Edwards A. J., Sills R. J. C. J. Chem. Soc. A, 1971, 942 - 945, doi:10.1039 / J19710000942