Octan rtuťnatý - Mercury(II) acetate
 | |
| [[Soubor: Merkur (II) - octan-kyselina rtuťnatá-z-xtalu-1973-3D-balls-A.png | 220px]] | |
 | |
| Jména | |
|---|---|
| Ostatní jména octan rtuťnatý merkuriacetát | |
| Identifikátory | |
3D model (JSmol ) |
|
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.014.993 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 1629 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4H6Ó4Hg | |
| Molární hmotnost | 318,678 g / mol |
| Vzhled | bílo-žluté krystaly |
| Zápach | mírný ocet zápach |
| Hustota | 3,28 g / cm3, pevný |
| Bod tání | 179 ° C (354 ° F; 452 K) (rozkládá se) |
| 25 g / 100 ml (10 ° C) 100 g / 100 ml (100 ° C) | |
| Rozpustnost | rozpustný v alkohol, diethylether |
| −100·10−6 cm3/ mol | |
| Nebezpečí | |
| Piktogramy GHS |    |
| Signální slovo GHS | Nebezpečí |
| H300, H310, H330, H373, H400, H410 | |
| P260, P262, P264, P270, P271, P273, P280, P284, P301 + 310, P302 + 350, P304 + 340, P310, P314, P320, P321, P322, P330, P361, P363, P391, P403 + 233, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 40,9 mg / kg (potkan, orálně) 23,9 mg / kg (myš, orální)[1] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
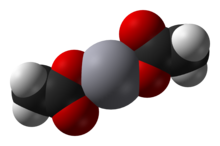
Octan rtuťnatý je chemická sloučenina s vzorec Hg (Ó2C CH3 )2. Běžně zkráceně Hg (OAc)2, tato sloučenina se používá jako činidlo pro generování organortuť sloučeniny z nenasycených organických prekurzorů.
Struktura
Rtuti (II) octan je krystalická pevná látka sestávající z izolované Hg (OAc)2 molekuly se vzdálenostmi Hg-O 2,07 Å. Jsou také přítomny tři dlouhé, slabé mezimolekulární vazby Hg ··· O asi 2,75 Å, což má za následek mírně zkreslenou čtvercovou pyramidovou koordinační geometrii na Hg.[2]
Reakce
Arenes podstoupit "rtuť" po ošetření Hg (OAc)2. Jedna acetátová skupina (OAc), která zůstává na rtuti, může být nahrazena chloridem:[3]
- C6H5OH + Hg (OAc)2 → C.6H4(OH) -2-HgOAc + HOAc
- C6H4(OH) -2-HgOAc + NaCl → C6H4(OH) -2-HgCl + NaOAc
Hg2+ centrum se váže na alkeny, vyvolání přidání hydroxid a alkoxid. Například zpracování methyluakrylát s octanem rtuťnatým v methanolu dává ester α-merkuri:[4]
- Hg (OAc)2 + CH2= CHCO2CH3 + CH3ACH → CH3OCH2CH (HgOAc) CO2CH3 + HOAc
Využití vysoké afinity rtuti (II) k sírovým ligandům, Hg (OAc)2 lze použít jako a činidlo na zbavit ochrany thiolové skupiny v organická syntéza. Podobně Hg (OAc)2 byl použit k převodu thiokarbonát estery na dithiokarbonáty:
- (RS)2C = S + H2O + Hg (OAc)2 → (RS)2C = O + HgS + 2 HOAc
Používá se octan rtuťnatý oxymercuration reakce.
Reference
- ^ „Rtuťové (organo) alkylové sloučeniny (jako Hg)“. Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Allmann, R. (1973). „Die Struktur des Quecksilber (II) -acetats“. Zeitschrift für Kristallographie - Crystalline Materials. 138 (1–6): 366–373. doi:10.1524 / zkri.1973.138.jg.366.
- ^ Whitmore, F. C .; Hanson, E. R. (1925). „o-chloromercurifenol“. Organické syntézy. 4: 13. doi:10.15227 / orgsyn.004.0013.
- ^ „Dl-SERINE“. Organické syntézy. 20: 81. 1940. doi:10.15227 / orgsyn.020.0081.
Acetylhalogenidy a jejich soli acetát ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | On | ||||||||||||||||||
| LiOAc | Být (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | Ahoj | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 ALSOL Al (OAc)2ACH Al2TAK4(OAc)4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Jako (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Pozn | Mo (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | Cd (OAc)2 | v | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Ta | Ž | Re | Os | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Bi (OAc)3 | Po | Na | Rn | |||
| Fr. | Ra | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La (OAc)3 | Ce (OAc)X | Pr | Nd | Odpoledne | Sm (OAc)3 | EU (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Ho (OAc)3 | Er | Tm | Yb (OAc)3 | Lu (OAc)3 | |||||
| Ac | Čt | Pa | UO2(OAc)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||

