Fluorid rtuťnatý - Mercury(IV) fluoride
 | |
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| |
| |
| Vlastnosti | |
| HgF4 | |
| Molární hmotnost | 276,58 g / mol |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Fluorid rtuťnatý, HgF4, je první rtuť sloučenina, která má být uvedena s rtutí v +4 oxidační stav. Merkur, jako ten druhý skupina 12 prvků (kadmium a zinek ), má s2d10 elektronová konfigurace a obecně tvoří pouze vazby zahrnující jeho 6s oběžnou dráhu. To znamená, že nejvyšší oxidační stav, kterého rtuť obvykle dosahuje, je +2, a proto se obvykle považuje za post-přechodový kov místo a přechodový kov. HgF4 byl poprvé hlášen z experimentů v roce 2007, ale jeho existence zůstává sporná; experimenty provedené v roce 2008 nemohly sloučeninu replikovat.[1]
Dějiny
Spekulace o vyšších oxidačních stavech rtuti existovaly od 70. let a teoretické výpočty v 90. letech předpovídaly, že by měla být stabilní v plynné fázi s čtvercový-planární geometrie v souladu s formálním d8 konfigurace. Experimentální důkaz však zůstal nepolapitelný až do roku 2007, kdy HgF4 byl nejprve připraven za použití pevné látky neon a argon pro izolace matice při teplotě 4 ° CK.. Sloučenina byla detekována pomocí infračervená spektroskopie.[2][3] Analýza hustota funkční teorie a spojený klastr výpočty ukázaly, že d orbitaly jsou zapojeny do vazby, což vedlo k návrhu, že rtuť by měla být koneckonců považována za přechodný kov.[4] Tento závěr však zpochybnil W. B. Jensen argumentem, že HgF4 existuje pouze za vysoce atypických nerovnovážné podmínky a mělo by být nejlépe považováno za výjimku.[5]
Vysvětlení
Teoretické studie naznačují, že rtuť je mezi přírodními prvky skupiny 12 jedinečná při tvorbě a tetrafluorid a toto pozorování připisovat relativistické efekty. Podle výpočtů jsou tetrafluoridy „méně relativistických“ prvků kadmium a zinek nestabilní a vylučují molekulu fluoru, F2za vzniku komplexu fluoridu kovu. Na druhou stranu tetrafluorid „relativnějšího“ syntetického prvku 112, copernicium, se předpokládá stabilnější.[6] Novější teoretické studie však zpochybňují možnou existenci rtuti (IV) a dokonce i fluoridu copernicium (IV).[7]
Syntéza a vlastnosti
HgF4 se vyrábí reakcí elementární rtuti s fluor:
- Hg + 2 F2 → HgF4
HgF4 je stabilní pouze v izolaci matrice při 4 K (-269 ° C); při zahřátí, nebo pokud HgF4 molekuly se navzájem dotýkají, rozkládá se rtuťnatý (II) fluorid a fluor:
- HgF4 → HgF2 + F2
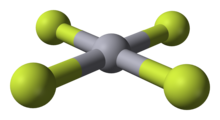
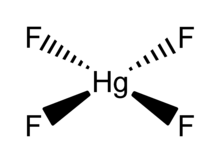
HgF4 je diamagnetický, čtvercová rovinná molekula. Atom rtuti má formální 6s25 d86p6 elektronová konfigurace a jako takový se řídí oktetové pravidlo ale ne 18-elektronové pravidlo. HgF4 je izoelektronický s tetrafluoroaurát anion, AuF−
4, a je valenční izoelektronický s tetrachlorourát (AuCl−
4), tetrabromoaurát (AuBr−
4), a tetrachloroplatinate (PtCl2−
4) anionty.
Reference
- ^ Je rtuť přechodným kovem? Archivováno 2016-10-12 na Wayback Machine
- ^ „Stavy s vysokou oxidací: syntetizovaný tetrafluorid rtuťnatý“.
- ^ „Nepolapitelný druh Hg (IV) byl syntetizován za kryogenních podmínek“. 2007-10-12.
- ^ Wang, Xuefang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin (2007). „Merkur je přechodový kov: první experimentální důkaz pro HgF4". Angew. Chem. Int. Vyd. 46 (44): 8371–8375. doi:10.1002 / anie.200703710. PMID 17899620.
- ^ Jensen, William B. (2008). „Je Merkur nyní přechodovým prvkem?“. J. Chem. Educ. 85 (9): 1182–1183. Bibcode:2008JChEd..85.1182J. doi:10.1021 / ed085p1182.
- ^ Hoffman, Darleane C .; Lee, Diana M .; Pershina, Valeria (2006). "Transactinidy a budoucí prvky". V Morss; Edelstein, Norman M .; Fuger, Jean (eds.). Chemie aktinidových a transaktinidových prvků (3. vyd.). Dordrecht, Nizozemsko: Springer Science + Business Media. ISBN 1-4020-3555-1.
- ^ Brändas, Erkki J .; Kryachko, Eugene S. (2013-03-09). Základní svět kvantové chemie: Pocta paměti Per-Olova Löwdina. ISBN 9789401704489.
