Rodina proteinů z fotosyntetického reakčního centra - Photosynthetic reaction centre protein family
| Protein reakčního centra typu II | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Struktura fotosyntetického reakčního centra z Rhodopseudomonas viridis (PDB: 1PRC). Střední transmembránový úsek jsou dvě podjednotky v této rodině; zelené bloky představují chlorofyl. Horní část je 4hémová (červená) podjednotka cytochromu c (infobox níže). Spodní část spolu s připojenými šroubovicemi TM je podjednotka H. | |||||||||||
| Identifikátory | |||||||||||
| Symbol | Foto_RC | ||||||||||
| Pfam | PF00124 | ||||||||||
| InterPro | IPR000484 | ||||||||||
| STRÁNKA | PDOC00217 | ||||||||||
| SCOP2 | 1prc / Rozsah / SUPFAM | ||||||||||
| TCDB | 3.E.2 | ||||||||||
| OPM nadčeleď | 2 | ||||||||||
| OPM protein | 1dxr | ||||||||||
| |||||||||||
| Protein reakčního centra typu I | |||||||||
|---|---|---|---|---|---|---|---|---|---|
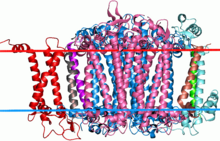 Boční pohled na fotosystém sinic I. Velké téměř symetrické proteiny ve středu, zbarvené modře a růžově, jsou dvě podjednotky této rodiny. | |||||||||
| Identifikátory | |||||||||
| Symbol | PsaA_PsaB | ||||||||
| Pfam | PF00223 | ||||||||
| InterPro | IPR001280 | ||||||||
| STRÁNKA | PDOC00347 | ||||||||
| SCOP2 | 1jb0 / Rozsah / SUPFAM | ||||||||
| TCDB | 5.B.4 | ||||||||
| OPM nadčeleď | 2 | ||||||||
| OPM protein | 1jb0 | ||||||||
| Membranome | 535 | ||||||||
| |||||||||
| Bakteriální reakční centrum typu II, podjednotka cytochromu c | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | CytoC_RC | ||||||||
| Pfam | PF02276 | ||||||||
| Pfam klan | CL0317 | ||||||||
| InterPro | IPR003158 | ||||||||
| SCOP2 | 1prc / Rozsah / SUPFAM | ||||||||
| |||||||||
Proteiny fotosyntetického reakčního centra jsou hlavní proteinové složky fotosyntetická reakční centra (RC) bakterií a rostlin. Jsou to transmembránové proteiny zabudované do chloroplastů thylakoid nebo bakteriální buněčná membrána.
Rostliny, řasy a sinice mají jeden typ PRC pro každý ze svých dvou fotosystémů. Non-kyslík bakterie, na druhé straně, mají RC připomínající buď centrum Photosystem I (typ I) nebo centrum Photosystem II (typ II). V obou případech mají PRC dva příbuzné proteiny (L / M; D1 / D2; PsaA / PsaB), které tvoří kvazi-symetrický komplex 5 šroubovic jádra s kapsami pro vazbu pigmentu. Tyto dva typy jsou strukturálně příbuzné a sdílejí společného předka.[1][2] Každý typ má jiné kapsy pro ligandy, aby se do nich vešlo specifické reakce: zatímco RC Typu I používají k přijímání elektronů shluky železné síry, RC Typu II používají chinony. Centrální jednotky RC Typu I mají také šest dalších transmembránových šroubovic pro shromažďování energie.[2]
V bakteriích
Fotosyntetický aparát typu II v nekysličených bakteriích se skládá z komplexy protein-pigment, které sklízejí světlo LH1 a LH2, které používají karotenoid a bakteriochlorofyl jako primární dárci.[3] LH1 působí jako rozbočovač energie a dočasně jej ukládá před přenosem do fotosyntetického reakčního centra (RC).[4] Elektrony jsou přenášeny z primárního dárce prostřednictvím přechodného akceptoru (bakteriofaleofyt) do primárního akceptoru (chinin Qa) a nakonec do sekundárního akceptoru (chinon Qb), což vede k tvorbě ubichinolu QbH2. RC využívá excitační energii k míchání elektronů přes membránu a jejich přenos přes ubichinol do komplexu cytochromu bc1 za účelem vytvoření protonového gradientu přes membránu, který je používán ATP syntetázou k tvorbě ATP.[5][6][7]
Komplex jádra je zakotven v buněčné membráně, sestávající z jedné jednotky RC obklopené LH1; u některých druhů mohou existovat další podjednotky.[8] RC typu II se skládá ze tří podjednotek: L (lehká), M (střední) a H (těžká; InterPro: IPR005652 ). Podjednotky L a M poskytují lešení pro chromofor, zatímco podjednotka H obsahuje cytoplazmatickou doménu.[9] v Rhodopseudomonas viridis, na periplazmatickém povrchu je také membránová podjednotka cytochromu (4Hcyt), která není membránová.
Struktura systému typu I v anaerobu Heliobacterium modesticaldum byl vyřešen v roce 2017 (PDB: 5V8K). Jako homodimer skládající se pouze z jednoho typu proteinu v komplexu jádra je považován za bližší příklad toho, jaká je rodová jednotka před rozdělením typu I / II ve srovnání se všemi heterodimerními systémy.[2]
Kyslíkové systémy
Proteiny reakčního centra D1 (PsbA) a D2 (PsbD) fotosystému II (PSII) z sinic, řas a rostlin vykazují pouze přibližně 15% sekvenční homologii s podjednotkami L a M, avšak konzervované aminokyseliny odpovídají vazebným místům fotochemicky aktivní kofaktory. Výsledkem je, že reakční centra (RC) fialových fotosyntetických bakterií a PSII vykazují značnou strukturální podobnost, pokud jde o organizaci kofaktorů.
Proteiny D1 a D2 se vyskytují jako heterodimery, které tvoří reakční jádro PSII, vícepodjednotkový komplex protein-pigment obsahující více než čtyřicet různých kofaktorů, které jsou zakotveny v buněčné membráně u sinic a v tylakoidní membráně u řas a rostlin. Po absorpci světelné energie prochází heterodimer D1 / D2 nábojovou separací a elektrony jsou přenášeny z primárního donoru (chlorofyl a) přes feofytin do primárního akceptoru chinonu Qa, poté do sekundárního akceptoru Qb, který má rád bakteriální systém, vrcholí ve výrobě ATP. PSII má však nad bakteriálním systémem další funkci. Na oxidační straně PSII redukuje redoxaktivní zbytek v proteinu D1 P680, oxidovaný tyrosin poté odtahuje elektrony z klastru manganu, který zase odtahuje elektrony z vody, což vede k štěpení vody a tvorbě molekulárního kyslíku . PSII tak poskytuje zdroj elektronů, které může fotosystém I použít k výrobě redukční energie (NADPH) potřebné k převodu CO2 na glukózu.[10][11]
Místo přidělování specializovaných rolí chinonům se centrum fotosystému PsaA-PsaB I vyvinulo tak, aby oba chinony byly nepohyblivé. Rovněž přijal podjednotku PsaC obsahující železo a síru, aby dále zmírnil riziko oxidačního stresu.[2]
Ve virech
V mořích byly objeveny geny fotosyntetického reakčního centra z PSII (PsbA, PsbD) bakteriofág.[12][13][14] Ačkoli je široce přijímané dogma, že svévolné kousky DNA mohou být přenášeny fágem mezi hostiteli (transdukce ), těžko bychom očekávali, že najdeme transdukovanou DNA ve velkém počtu virů. Transdukce se obecně považuje za běžnou, ale rutinní transdukce jakéhokoli kusu DNA by byla velmi neočekávaná. Místo toho by koncepčně gen, který se běžně nachází v průzkumech virové DNA, musel být funkčním prvkem samotného viru (to neznamená, že by gen nebyl přenášen mezi hostitele - což je fotosystém uvnitř virů[15] - ale místo toho existuje genová funkce genu, že nejde pouze o stopování s virem). Volným virům však chybí mechanismy potřebné k podpoře metabolismu, natož fotosyntéza. Výsledkem je, že geny fotosystému pravděpodobně nebudou funkční složkou viru, jako je kapsidový protein nebo ocasní vlákno. Místo toho je exprimován v infikované hostitelské buňce.[16][17] Většina virových genů, které jsou exprimovány v kontextu hostitele, je užitečná pro únos hostitelského aparátu k produkci virů nebo pro replikaci virového genomu. Ty mohou zahrnovat reverzní transkriptázy, integrázy, nukleázy nebo jiné enzymy. Součásti fotosystému se nehodí ani do této formy. Produkce aktivního fotosystému během virové infekce poskytuje aktivní fotosyntézu umírajícím buňkám. Nejedná se však o virový altruismus vůči hostiteli. Problém s virovými infekcemi má tendenci spočívat v tom, že relativně rychle deaktivují hostitele. Protože se proteinová exprese přesouvá z genomu hostitele do genomu viru, fotosystém se degraduje relativně rychle (částečně díky interakci se světlem, která je vysoce korozivní), čímž se přerušuje přísun živin do replikujícího se viru.[18] Řešením tohoto problému je přidání rychle degradovaných genů fotosystému do viru, takže tok živin bude neinhibovaný a bude produkováno více virů. Dalo by se očekávat, že tento objev povede k dalším objevům podobné povahy; že prvky metabolismu hostitele klíčové pro produkci viru a snadno poškozené během infekce jsou aktivně nahrazeny nebo podporovány virem během infekce.
Opravdu, v poslední době se také uvádí, že v mořských mořích existují také kazety genů PSI obsahující celé genové sady [(psaJF, C, A, B, K, E a D) a (psaD, C, A a B)] kyanofágy z Tichého a Indického oceánu [19][20][21]
Podskupiny
- Centrum fotosyntetické reakce, M podjednotka InterPro: IPR005781
- Protein reakčního centra fotosystému II PsbA / D1 InterPro: IPR005867
- Protein reakčního centra fotosystému II PsbD / D2 InterPro: IPR005868
- Centrum fotosyntetické reakce, L podjednotka InterPro: IPR005871
Poznámky
- ^ Sadekar S, Raymond J, Blankenship RE (listopad 2006). „Zachování vzdáleně příbuzných membránových proteinů: fotosyntetická reakční centra sdílejí společné strukturní jádro“. Molekulární biologie a evoluce. 23 (11): 2001–7. doi:10.1093 / molbev / msl079. PMID 16887904.
- ^ A b C d Orf GS, Gisriel C, Redding KE (říjen 2018). "Vývoj fotosyntetických reakčních center: poznatky ze struktury heliobakteriálního reakčního centra". Fotosyntetický výzkum. 138 (1): 11–37. doi:10.1007 / s11120-018-0503-2. OSTI 1494566. PMID 29603081. S2CID 4473759.
- ^ Lancaster CR, Bibikova MV, Sabatino P, Oesterhelt D, Michel H (prosinec 2000). „Strukturální základ drasticky zvýšené počáteční rychlosti přenosu elektronů v reakčním centru z mutantu Rhodopseudomonas viridis popsaného v rozlišení 2,00-A“. The Journal of Biological Chemistry. 275 (50): 39364–8. doi:10,1074 / jbc.M008225200. PMID 11005826.
- ^ Bahatyrova S, Frese RN, Siebert CA, Olsen JD, Van Der Werf KO, Van Grondelle R, Niederman RA, Bullough PA, Otto C, Hunter CN (srpen 2004). „Nativní architektura fotosyntetické membrány“ (PDF). Příroda. 430 (7003): 1058–62. Bibcode:2004 Natur.430.1058B. doi:10.1038 / nature02823. PMID 15329728. S2CID 486505.
- ^ Scheuring S (říjen 2006). „AFM studie supramolekulárního uspořádání bakteriálních fotosyntetických komplexů jádra“. Aktuální názor na chemickou biologii. 10 (5): 387–93. doi:10.1016 / j.cbpa.2006.08.007. PMID 16931113.
- ^ Remy A, Gerwert K (srpen 2003). "Vazba přenosu elektronů indukovaných světlem na absorpci protonů ve fotosyntéze". Přírodní strukturní biologie. 10 (8): 637–44. doi:10.1038 / nsb954. PMID 12872158. S2CID 20008703.
- ^ Deisenhofer J, Michel H (srpen 1989). „Nobelova přednáška. Fotosyntetické reakční centrum z fialové bakterie Rhodopseudomonas viridis“. Časopis EMBO. 8 (8): 2149–70. doi:10.1002 / j.1460-2075.1989.tb08338.x. PMC 401143. PMID 2676514.
- ^ Miki K, Kobayashi M, Nogi T, Fathir I, Nozawa T (2000). „Krystalové struktury fotosyntetického reakčního centra a vysoce potenciálního proteinu železo-síra z Thermochromatium tepidum: termostabilita a přenos elektronů“. Proc. Natl. Acad. Sci. USA. 97 (25): 13561–13566. Bibcode:2000PNAS ... 9713561N. doi:10.1073 / pnas.240224997. PMC 17615. PMID 11095707.
- ^ Michel H, Ermler U, Schiffer M (1994). "Struktura a funkce fotosyntetického reakčního centra z Rhodobacter sphaeroides". J. Bioenerg. Biomembr. 26 (1): 5–15. doi:10.1007 / BF00763216. PMID 8027023. S2CID 84295064.
- ^ Kamiya N, Shen JR (2003). „Krystalová struktura fotosystému II vyvíjejícího kyslík z Thermosynechococcus vulcanus v rozlišení 3,7 A“. Proc. Natl. Acad. Sci. USA. 100 (1): 98–103. Bibcode:2003PNAS..100 ... 98 tis. doi:10.1073 / pnas.0135651100. PMC 140893. PMID 12518057.
- ^ Schroder WP, Shi LX (2004). "Nízkomolekulární podjednotky fotosyntetického suprakomplexu, fotosystém II". Biochim. Biophys. Acta. 1608 (2–3): 75–96. doi:10.1016 / j.bbabio.2003.12.004. PMID 14871485.
- ^ Sharon I, Tzahor S, Williamson S, Shmoish M, Man-Aharonovich D, Rusch DB, Yooseph S, Zeidner G, Golden SS, Mackey SR, Adir N, Weingart U, Horn D, Venter JC, Mandel-Gutfreund Y, Béjà O (2007). „Virové fotosyntetické reakční geny a přepisy v mořském prostředí“. ISME J. 1 (6): 492–501. doi:10.1038 / ismej.2007.67. PMID 18043651.
- ^ Millard A, Clokie MR, Shub DA, Mann NH (2004). „Genetická organizace oblasti psbAD ve fágech infikujících mořské kmeny Synechococcus“. Proc. Natl. Acad. Sci. USA 101 (30): 11007–12. Bibcode:2004PNAS..10111007M. doi:10.1073 / pnas.0401478101. PMC 503734. PMID 15263091.
- ^ Sullivan MB, Lindell D, Lee JA, Thompson LR, Bielawski JP, Chisholm SW (2006). „Prevalence a evoluce hlavních genů fotosystému II v mořských sinicích a jejich hostitelích“. PLoS Biol. 4 (8): e234. doi:10.1371 / journal.pbio.0040234. PMC 1484495. PMID 16802857.

- ^ Lindell D, Sullivan MB, Johnson ZI, Tolonen AC, Rohwer F, Chisholm SW (2004). „Přenos genů pro fotosyntézu do a z virů Prochlorococcus“. Proc. Natl. Acad. Sci. USA 101 (30): 11013–8. Bibcode:2004PNAS..10111013L. doi:10.1073 / pnas.0401526101. PMC 503735. PMID 15256601.
- ^ Lindell D, Jaffe JD, Johnson ZI, Church GM, Chisholm SW (2005). "Geny pro fotosyntézu v mořských virech poskytují proteiny během infekce hostitele". Příroda. 438 (7064): 86–9. Bibcode:2005 Natur.438 ... 86L. doi:10.1038 / nature04111. PMID 16222247. S2CID 4347406.
- ^ Clokie MR, Shan J, Bailey S, Jia Y, Krisch HM, West S, Mann NH (2006). „Transkripce„ fotosyntetického “fága typu T4 během infekce mořské sinice“. Environ. Microbiol. 8 (5): 827–35. doi:10.1111 / j.1462-2920.2005.00969.x. PMID 16623740.
- ^ Bailey S, Clokie MR, Millard A, Mann NH (2004). "Cyanofágová infekce a fotoinhibice v mořských sinicích". Res. Microbiol. 155 (9): 720–5. doi:10.1016 / j.resmic.2004.06.002. PMID 15501648.
- ^ Sharon I, Alperovitch A, Rohwer F, Haynes M, Glaser F, Atamna-Ismaeel N, Pinter RY, Partensky F, Koonin EV, Wolf YI, Nelson N, Béjà O (2009). „Genetické kazety fotosystému-I jsou přítomny v genomech mořských virů“. Příroda. 461 (7261): 258–262. Bibcode:2009Natur.461..258S. doi:10.1038 / nature08284. PMC 4605144. PMID 19710652.
- ^ Alperovitch-Lavy A, Sharon I, Rohwer F, Aro EM, Glaser F, Milo R, Nelson N, Béjà O (2011). „Rekonstrukce hádanky: existence cyanofágů obsahujících genové sady fotosystému I i fotosystému II odvozené z oceánských metagenomických datových souborů“. Environ. Microbiol. 13 (1): 24–32. doi:10.1111 / j.1462-2920.2010.02304.x. PMID 20649642.
- ^ Béjà O, Fridman S, Glaser F (2012). „Virové klony z expedice GOS s neobvyklou organizací genové kazety fotosystému-I“. ISME J. 6 (8): 1617–20. doi:10.1038 / ismej.2012.23. PMC 3400403. PMID 22456446.
Reference
- Deisenhofer J, Epp O, Miki K, Huber R, Michel H (prosinec 1984). "Rentgenová strukturní analýza komplexu membránových proteinů. Mapa elektronové hustoty při rozlišení 3 A a model chromoforů fotosyntetického reakčního centra z Rhodopseudomonas viridis." Journal of Molecular Biology. 180 (2): 385–98. doi:10.1016 / s0022-2836 (84) 80011-x. PMID 6392571.
