Jodoform - Iodoform
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Trijodmethan | |||
| Ostatní jména Jodoform;[1] Jodid uhličitý | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 1697010 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.000.795 | ||
| Číslo ES |
| ||
| KEGG | |||
| Pletivo | jodoform | ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| CHJá3 | |||
| Molární hmotnost | 393.732 g · mol−1 | ||
| Vzhled | Bledé, světle žluté, neprůhledné krystaly | ||
| Zápach | Jako šafrán[2] | ||
| Hustota | 4,008 g cm−3[2] | ||
| Bod tání | 119 ° C (246 ° F; 392 K) [2] | ||
| Bod varu | 218 ° C (424 ° F; 491 K) [2] | ||
| 100 mg L−1[2] | |||
| Rozpustnost v diethylether | 136 g L−1 | ||
| Rozpustnost v aceton | 120 g L−1 | ||
| Rozpustnost v ethanol | 78 g L−1 | ||
| log P | 3.118 | ||
| 3,4 μmol Pa−1 kg−1 | |||
| −117.1·10−6 cm3/ mol | |||
| Struktura | |||
| Šestihranný | |||
| Čtyřúhelníkový | |||
| Čtyřstěn | |||
| Termochemie | |||
Tepelná kapacita (C) | 157,5 J K.−1 mol−1 | ||
Std entalpie of formace (ΔFH⦵298) | 180,1–182,1 kJ mol−1 | ||
Std entalpie of spalování (ΔCH⦵298) | −716,9 - −718,1 kJ mol−1 | ||
| Farmakologie | |||
| D09AA13 (SZO) | |||
| Nebezpečí | |||
| Piktogramy GHS |  | ||
| Signální slovo GHS | Varování | ||
| H315, H319, H335 | |||
| P261, P280, P305 + 351 + 338 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 204 ° C (399 ° F; 477 K) | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | |||
| NIOSH (Limity expozice USA pro zdraví): | |||
PEL (Dovolený) | žádný[3] | ||
REL (Doporučeno) | 0,6 ppm (10 mg / m3)[3] | ||
IDLH (Okamžité nebezpečí) | N.D.[3] | ||
| Související sloučeniny | |||
Související haloalkany | |||
Související sloučeniny | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||

Jodoform (také známý jako trijodmethan a nepřesně jako jodid uhličitý) je organojodová sloučenina s vzorec CHJá3. Bledě žlutá, krystalická, těkavá látka, má pronikavý a charakteristický zápach (ve starších textech o chemii se vůně někdy označuje jako vůně nemocnic, kde se sloučenina stále běžně používá) a analogicky k chloroform, sladká chuť. Občas se používá jako dezinfekční prostředek.
Struktura
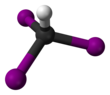
Molekula se adoptuje čtyřboká molekulární geometrie s C.3v symetrie.
Syntéza a reakce
Syntézu jodoformu poprvé popsal Georges-Simon Serullas v roce 1822 reakcí par jódu s párou na rozžhaveném uhlí a také reakcí draslíku s ethanolickým jodem v přítomnosti vody;[5] a současně nezávisle na sobě John Thomas Cooper.[6] Je syntetizován v haloformová reakce reakcí jodu a hydroxidu sodného s kteroukoli z těchto čtyř druhů organických sloučenin: methyl keton (CH3COR), acetaldehyd (CH3CHO), ethanol (CH3CH2OH) a některé sekundární alkoholy (CH3CHROH, kde R je alkylová nebo arylová skupina).
Reakce jodu a báze s methyl ketony je tak spolehlivý, že jodoformový test (vzhled žluté sraženiny) se použije ke zkoumání přítomnosti methylketonu. To je také případ při testování konkrétních sekundární alkoholy obsahující alespoň jeden methyl seskupit alfa pozice.
Některá činidla (např. jodovodík ) převést iodoform na dijodmethan. Také převod na oxid uhličitý je možné: Jodoform reaguje s vodným dusičnan stříbrný k výrobě kysličník uhelnatý. Při ošetření práškovým elementárním stříbrem se jodoform redukuje a produkuje acetylén. Po zahřátí se jodoform rozkládá a vzniká diatomický jod, plynný jodovodík a uhlík.
Přirozený výskyt
The andělská kapota houba obsahuje jodoform a vykazuje charakteristický zápach.
Aplikace
Sloučenina nachází použití v malém měřítku jako dezinfekční prostředek.[4][7] Kolem počátku 20. století se používal v medicíně jako hojivý a antiseptický obvaz na rány a vředy, ačkoli toto použití je nyní nahrazeno nadřazeným antiseptika. Je aktivní složkou mnoha ušních prášků pro psy a kočky, spolu s oxid zinečnatý a kyselina propionová, které se používají k prevenci infekce a usnadnění odstraňování chloupků v uších.[Citace je zapotřebí ]
Viz také
Reference
- ^ „Přední záležitost“. Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 661. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Zachované názvy „bromoform“ pro HCBr3„Chloroform“ pro HCCI3a „jodoform“ pro HCI3 jsou přijatelné v obecné nomenklatuře. Preferované názvy IUPAC jsou substituční názvy.
- ^ A b C d E F G Záznam v databázi látek GESTIS Institut pro bezpečnost a ochranu zdraví při práci
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0343". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b Index společnosti Merck, 12. vydání, 5054
- ^ Surellas, Georges-Simon (1822), Notes sur l'Hydriodate de potasse et l'Acide hydriodique. - Hydriodure de carbone; moyen d'obtenir, à l'instant, ce composé triple [Poznámky k hydrojodidu draselného ak kyselině jodovodíkové - hydrojodidu uhlíku; prostředky k okamžitému získání této sloučeniny tří prvků] (ve francouzštině), Metz, Francie: Antoine, s. 17–20, 28–29
- ^ James, Frank A. J. L. (2004). „Cooper, John Thomas“. Oxfordský slovník národní biografie (online vydání). Oxford University Press. doi:10.1093 / ref: odnb / 39361. Citováno 26. ledna 2012. (Předplatné nebo Členství ve veřejné knihovně ve Velké Británii Požadované.)
- ^ Lyday, Phyllis A. (2005), „Jód a jódové sloučeniny“, Ullmann's Encyclopedia of Industrial Chemistry„Wiley-VCH, Weinheim, s. 1–13, doi:10.1002 / 14356007.a14_381.pub2, ISBN 9783527306732
externí odkazy
- NIOSH Kapesní průvodce chemickými nebezpečími. "#0343". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- MSDS ve společnosti JT Baker
- Metoda specifické přeměny jodoformu na oxid uhličitý
- Příprava
- . Encyklopedie Britannica. 14 (11. vydání). 1911. str. 726.