Tetrajodid uhličitý - Carbon tetraiodide
 | |||
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Tetraiodomethane[1] | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 1733108 | |||
| ChemSpider | |||
| Informační karta ECHA | 100.007.335 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| CJá4 | |||
| Molární hmotnost | 519.629 g · mol−1 | ||
| Vzhled | Tmavě fialové krystaly | ||
| Hustota | 4,32 g ml−1 | ||
| -136·10−6 cm3/ mol | |||
| Struktura | |||
| Čtyřúhelníkový | |||
| Čtyřboká | |||
| 0 D. | |||
| Termochemie | |||
Tepelná kapacita (C) | 0,500 J K.−1 G−1 | ||
Std entalpie of formace (ΔFH⦵298) | 384,0–400,4 kJ mol−1 | ||
Std entalpie of spalování (ΔCH⦵298) | −794,4– −778,4 kJ mol−1 | ||
| Nebezpečí | |||
| Piktogramy GHS |  | ||
| Signální slovo GHS | Varování | ||
| H315, H319, H335 | |||
| P261, P305 + 351 + 338 | |||
| Související sloučeniny | |||
Související alkany | |||
Související sloučeniny | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Tetrajodid uhličitý je tetrahalomethan s molekulárním vzorcem CI4. Jelikož je jasně červená, jedná se o relativně vzácný příklad vysoce barevného metan derivát. Je to pouze 2% hmotnostní uhlíku, i když jsou známy jiné deriváty methanu s ještě menším obsahem uhlíku.
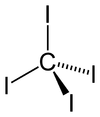
Struktura
Čtyřboká molekula má C-I vzdálenosti 2,12 ± 0,02 Å.[2] Molekula je mírně přeplněná s krátkými kontakty mezi atomy jodu 3,459 ± 0,03 Å, a možná z tohoto důvodu je tepelně a fotochemicky nestabilní.
Uhlík tetrojodid krystalizuje čtyřúhelníkový Krystalická struktura (A 6.409, C 9.558 (.10−1 nm)).[3]
Má nulu dipólový moment kvůli jeho symetricky substituované čtyřboká molekula.
Vlastnosti, syntéza, použití
Tetrojodid uhličitý je mírně reaktivní vůči vodě, což dává jodoform a já2. Je rozpustný v nepolárních organických rozpouštědlech. Rozkládá se tepelně a fotochemicky na tetrajodethylen, C.2Já4. Jeho syntéza vyžaduje AlCl3 - výměna katalyzovaného halogenidu, která se provádí při pokojové teplotě:[4]
Produkt krystalizuje z reakčního roztoku.
Jodíkatý se používá jako jodování činidlo, často při reakci s bázemi.[5] Ketony se po ošetření převedou na 1,1-dijodalkeny trifenylfosfin (PPh3) a tetrajodid uhličitý. Alkoholy se přeměňují na jodid podobným mechanismem Appel reakce. V Appelově reakci chlorid uhličitý se používá k výrobě alkylchloridů z alkoholů.
Bezpečnostní hlediska
Výrobci doporučují skladování jodidu uhličitého při teplotě 0 ° C (32 ° F). Jako připravený zdroj jódu působí dráždivě. Své LD50 je 178 mg.kg−1. Obecně by měly být perhalogenované organické sloučeniny považovány za toxické, s úzkou výjimkou malých perfluoralkanů (v zásadě inertních kvůli síle vazby CF).
Reference
- ^ "Tetraiodomethane - Summary of Compound". PubChem Compound. USA: Národní centrum pro biotechnologické informace. 27. března 2005. Identifikace a související záznamy. Citováno 29. února 2012.
- ^ Finbak, Chr .; Hassel, O. (1937). „Kristallstruktur und Molekülbau von CI4 und CBr4". Zeitschrift für Physikalische Chemie. B36: 301–308. doi:10.1515 / zpch-1937-3621.
- ^ Pohl, S. (1982). „Die Kristallstruktur von CI4". Zeitschrift für Kristallographie. 159: 211–216. doi:10.1524 / zkri.1982.159.14.211.
- ^ McArthur, R.E .; Simons, J. H. (1950). "Tetraiodid uhličitý". Anorganické syntézy. III: 37–39. doi:10.1002 / 9780470132340.ch8.
- ^ P. R. Schreiner, A. A. Fokin (2005). „Tetraiodid uhličitý“. V L. Paquette (ed.). Encyklopedie činidel pro organickou syntézu. John Wiley & Sons, Ltd.
Další čtení
- Sorros H., Hinkam J. B. (1945). „Redistribuční reakce. XI. Aplikace na přípravu tetradiodidu uhličitého a souvisejících halogenidů“. Journal of the American Chemical Society. 67: 1643. doi:10.1021 / ja01226a004.



