Izokyanid - Isocyanide
An isokyanid (také zvaný isonitril nebo karbylamin) je organická sloučenina s funkční skupina -N≡C. To je izomer souvisejících nitril (-C≡N), proto je předpona isokyano.[1] Organický fragment je připojen k isokyanidové skupině prostřednictvím dusík atom, ne přes uhlík. Používají se jako stavební kameny pro syntézu dalších sloučenin.[2]
Vlastnosti
Struktura a lepení
Vzdálenost C-N v izokyanidech je 115,8 pm v methylisokyanid. Úhly C-N-C jsou blízké 180 °.[3]
Podobně kysličník uhelnatý, isokyanidy jsou popsány dvěma rezonanční struktury, jeden s a trojná vazba mezi dusíkem a uhlíkem a jeden s a dvojná vazba mezi. Osamělý pár dusíku π stabilizuje strukturu a odpovídá za linearitu isokyanidů, ačkoli reaktivita isokyanidů odráží alespoň ve formálním smyslu určitý karbenový charakter. Obě rezonanční struktury jsou tedy užitečnými reprezentacemi.[4] Jsou náchylní k polymerizace.[4]
Spektroskopie
Izokyanidy vykazují silnou absorpci ve svých IR spektrech v rozmezí 2165–2110 cm−1.[5]
Elektronická symetrie o isokyanidu 14Výsledek N jádra je pomalý kvadrupolární relaxace aby 13C-14N jaderná rotace spojka lze pozorovat s vazebnými konstantami ca. 5 Hz pro isokyanid 13C jádro a 5–14 Hz pro 13C jádro, ke kterému je isokyanidová skupina připojena.[5]
Zápach
Jejich nepříjemný zápach je legendární. Citovat od Lieke, “Es besitzt einen penetranten, höchst unangenehmen Geruch; das Oeffnen eines Gefässes mit Cyanallyl reicht hin, die Luft eines Zimmers mehrere Tage lang zu verpesten, ...„(Má pronikavý, extrémně nepříjemný zápach; otevření baňky s allyl [iso] kyanidem je dost na to, aby v místnosti po několik dní znečišťovalo vzduch.) Všimněte si, že v Liekových dnech byl rozdíl mezi izokyanidem a nitrilem není plně doceněn.
Ivar Karl Ugi tvrdí, že "Vývoj chemie isokyanidů pravděpodobně utrpěl jen malé zpoždění díky charakteristickému zápachu těkavých isonitrilů, který byl popsán Hofmannem a Gautierem jako „vysoce specifický, téměř silný“, „hrozný“ a „extrémně zoufalý“. Je pravda, že mnoho potenciálních pracovníků v této oblasti bylo zápachem odvráceno, ale to je silně vyváženo skutečností, že izonitrily lze detekovat i ve stopách a že většina cest vedoucích k tvorbě izonitrilů byla objevena prostřednictvím zápach těchto sloučenin. “[6] Isocyanidy byly zkoumány jako potenciální nesmrtící zbraně.[7]
Některé izokyanidy přenášejí méně nepříjemné pachy, jako je slad, přírodní kaučuk, kreosot, jemné třešně nebo staré dřevo.[8] Netěkavé deriváty, jako jsou tosylmethylisokyanid nemají nežádoucí zápachy.[9]
Toxicita
Zatímco některé izokyanidy (např., cyklohexylisokyanid) jsou toxické, jiné „nevykazují žádnou znatelnou toxicitu pro savce“. Pokud jde o ethylisokyanid, toxikologické studie provedené v 60. letech v Bayeru ukázaly, že „myši mohou tolerovat orální a subkutánní dávky 500 až 5 000 mg / kg“.[6]
Syntéza
Bylo vyvinuto mnoho cest k isokyanidům.[2]
Z formamidů
Isokyanidy se běžně syntetizují pomocí dehydratace z formamidy. Formamid lze dehydratovat toluensulfonylchlorid, oxychlorid fosforitý, fosgen, difosgen, nebo Burgessovo činidlo v přítomnosti báze, jako je pyridin nebo triethylamin.[10][11][12]
- RNHC (O) H + ArSO2Cl + 2C5H5N → RNC + [C.5H5NH]+[ArSO3]– + [C.5H5NH]+Cl–
Z dichlorkarbenu
V karbylaminová reakce (také známá jako Hofmannova isokyanidová syntéza) alkalická báze reaguje s chloroform k výrobě dichlorkarbenu. Karben pak převádí primární aminy na isokyanidy. Ilustrativní je syntéza tert-butylisokyanid z tert-butylamin v přítomnosti katalytické částka katalyzátor fázového přenosu benzyltriethylamoniumchlorid.[13]
- Mě3CNH2 + CHCI3 + 3 NaOH → já3CNC + 3 NaCl + 3 H2Ó
Protože je účinná pouze pro primární aminy, lze tuto reakci použít jako a chemický test za jejich přítomnost.
Kyanid stříbrný
Historicky zajímavý, ale ne často praktický, první izokyanid, allyl isokyanid, byl připraven reakcí allyljodid a kyanid stříbrný.[14]
- RX + AgCN → RNC + AgX
Jiné metody
Další cesta k isokyanidům zahrnuje deprotonaci oxazoly a benzoxazoly v poloze 2.[8] Výsledná organolithná sloučenina existuje v chemická rovnováha s 2-isokyanofenolát, které lze zachytit pomocí elektrofil jako je chlorid kyseliny.
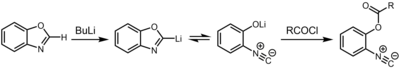
Reakce
Isocyanidy mají různou reaktivitu.[2]
Isocyanidy jsou stabilní na silné bázi (často se vyrábějí za silně bazických podmínek), ale jsou citlivé na kyselinu. V přítomnosti vodné kyseliny se izokyanidy hydrolyzují na odpovídající formamidy:
- RNC + H2O → RN (H) C (O) H
Tato reakce se používá ke zničení zapáchajících směsí isokyanidů. Některé isokyanidy mohou polymerovat v přítomnosti Lewisových a Bronstedových kyselin.[15]
Isocyanidy se účastní mnoha vícesložkové reakce zájmu v organická syntéza, z nichž dva jsou: Ugi reakce a Passeriniho reakce.
Isocyanidy se také účastní cykloadice reakce, jako je [4 + 1] cykloadice s tetraziny.[16] V závislosti na stupni substituce isokyanidu tato reakce převádí isokyanidy na karbonyly nebo poskytuje stabilní cykloadukt.[17] Podstupují také inzerci do C – Cl vazeb acylchloridů v Nef isokyanidová reakce, proces, o kterém se věří, že je ve vzájemné shodě, a ilustruje jeho karbenový charakter.
Ukázalo se také, že isokyanidy jsou užitečným činidlem při reakcích katalyzovaných palladiem, přičemž se pomocí této metody vytváří široká škála sloučenin.[18]
Poloha alfa isokyanidů má podstatnou kyselost. Například benzylisokyanid má pK.A ze dne 27.4. Ve srovnání má benzylkyanid pK.A ze dne 21.9.[19] V plynné fázi CH3NC je o 1,8 kcal / mol méně kyselý než CH3CN.[20]
Ligandy v koordinační chemii

Isokyanidy se tvoří koordinační komplexy s většinou přechodových kovů.[21] Chovají se jako elektronově bohaté analogy oxidu uhelnatého. Například terc-butylisokyanid tvoří Fe2(tBuNC)9, což je analogické s Fe2(CO)9.[22] I když jsou strukturně podobné, analogické karbonyly se liší několika způsoby, hlavně proto, že t-BuNC je lepší donorový ligand než CO. Fe (tBuNC)5 je snadno protonován, zatímco jeho protějšek Fe (CO)5 není.[23]
Přirozeně se vyskytující isokyanidy
Pouze několik přirozeně se vyskytujících sloučenin vykazuje isokyanidovou funkčnost. První byl objeven v roce 1957 v extraktu z plísně Penicillium notatum. Sloučenina xanthocillin později byl použit jako antibiotikum. Od té doby bylo izolováno mnoho dalších izokyanidů. Většina mořských isokyanidů je terpenoid, zatímco některé suchozemské izokyanidy pocházejí z α-aminokyselin.[24]
 Xanthocillin je vzácný přírodní produkt který obsahuje isokyanidovou skupinu (ve skutečnosti dvě).
Xanthocillin je vzácný přírodní produkt který obsahuje isokyanidovou skupinu (ve skutečnosti dvě).
Nomenklatura
Zatímco v Názvosloví IUPAC ve většině případů přípona „nitril“ nebo „karbonitril“ se používá pro organické látky kyanidy (R-C≡N),[25] názvy isokyanidů mají předpona „isokyano“. Názvy IUPAC se stanou isokyanomethan, isokyanoethan, isokyanopropan atd.
Někdy používaný termín „karbylamin“ je v rozporu se systematickou nomenklaturou. An amin vždy má tři jednoduché vazby,[26] zatímco isokyanid má pouze jednu jednoduchou a jednu vícenásobnou vazbu.
The isokyanamid funkční skupina se skládá z aminoskupiny připojené k isokyanové části. pro nomenklaturu jako příponu isonitrilu nebo předponu isokyano se používá v závislosti na tabulce priorit.
Reference
- ^ Zlatá kniha IUPAC isokyanidy
- ^ A b C Patil, Pravin; Ahmadian-Moghaddam, Maryam; Dömling, Alexander (29. 9. 2020). „Isocyanide 2.0“. Zelená chemie. doi:10.1039 / D0GC02722G. ISSN 1463-9270.
- ^ Kessler, M .; Ring, H .; Trambarulo, R .; Gordy, W. (1950). "Mikrovlnná spektra a molekulární struktury methylkyanidu a methylisokyanidu". Fyzický přehled. 79 (1): 54–56. Bibcode:1950PhRv ... 79 ... 54K. doi:10.1103 / PhysRev.79.54.
- ^ A b Ramozzi, R .; Chéron, N .; Braïda, B .; Hiberty, P. C .; Fleurat-Lessard, P. (2012). "Pohled valenční vazby na elektronovou strukturu izokyanidů". New Journal of Chemistry. 36 (5): 1137–1340. doi:10.1039 / C2NJ40050B.
- ^ A b Stephany, R. W .; de Bie, M. J. A .; Drenth, W. (1974). "A 13C-NMR a IR studie isokyanidů a některých jejich komplexů “. Organická magnetická rezonance. 6 (1): 45–47. doi:10.1002 / mrc.1270060112.
- ^ A b Ugi, I .; Fetzer, U .; Eholzer, U .; Knupfer, H .; Offermann, K. (1965). "Izonitrilové syntézy". Angewandte Chemie International Edition. 4 (6): 472–484. doi:10,1002 / anie.196504721.
- ^ Pirrung, M. C .; Ghorai, S .; Ibarra-Rivera, T. R. (2009). "Vícesložkové reakce konvertibilních izonitrilů". The Journal of Organic Chemistry. 74 (11): 4110–4117. doi:10.1021 / jo900414n. PMID 19408909.
- ^ A b Pirrung, M. C .; Ghorai, S. (2006). "Všestranný, voňavý, konvertibilní izonitril". Journal of the American Chemical Society. 128 (36): 11772–11773. doi:10.1021 / ja0644374. PMID 16953613.
- ^ B. E. Hoogenboom, O. H. Oldenziel a A. M. van Leusen „Toluensulfonylmethyl isokyanid“ Organic Syntheses, Coll. Sv. 6, str. 987 (1988).
- ^ R. E. Schuster; J. E. Scott (1966). "Methylisokyanid". Organické syntézy. 46: 75. doi:10.15227 / orgsyn.046.0075.
- ^ Ivar Karl Ugi; R. Meyr (1958). „Neue Darstellungsmethode für Isonitrile“. Angewandte Chemie. 70 (22–23): 702–703. doi:10,1002 / ange.19580702213.
- ^ Siobhan Creedon; H. Kevin Crowley; Daniel G. McCarthy (1998). „Dehydratace formamidů pomocí Burgessova činidla: nová cesta k isokyanidům“. J. Chem. Soc., Perkin Trans. 1 (6): 1015–1018. doi:10.1039 / a708081f.
- ^ G. W. Gokel; R. P. Widera; W. P. Weber (1988). „Fázový přenos Hofmannova karbylaminová reakce: terc-butylizokyanid“. Organické syntézy. 55: 232. doi:10.15227 / orgsyn.055.0096.
- ^ W. Lieke (1859). „Über das Cyanallyl“. Annalen der Chemie und Pharmacie. 112 (3): 316–321. doi:10,1002 / jlac.18591120307.
- ^ Deming, T. J .; Novak, B. M. (1993). "Mechanistické studie nikl katalyzované polymerace isokyanidů". J. Am. Chem. Soc. 115: 9101. doi:10.1021 / ja00073a028.
- ^ Imming, P .; R. Mohr; E. Müller; W. Overheu; G. Seitz (1982). „[4 + 1] Cykloadice isokyanidů na 1,2,4,5-tetraziny: nová syntéza pyrazolu“. Angewandte Chemie International Edition. 21 (4): 284. doi:10,1002 / anie.198202841.
- ^ Stöckmann, H .; A. Neves; S. Schody; K. Brindle; F. Leeper (2011). „Exploring Isonitril-Based Click Chemistry for Ligation with Biomolecules“. Organická a biomolekulární chemie. 9 (21): 7303–7305. doi:10.1039 / C1OB06424J. PMID 21915395.
- ^ Lang, S. (2013). „Rozluštění labyrintu reakcí katalyzovaných palladiem zahrnujících isokyanidy“. Recenze chemické společnosti. 42 (12): 4867–4880. doi:10.1039 / C3CS60022J. PMID 23443313.
- ^ „Tabulka Bordwell pKa (kyselost v DMSO)“. www.chem.wisc.edu. Citováno 2018-12-20.
- ^ Filley, Jonathan; DePuy, Charles H .; Bierbaum, Veronica M. (01.09.1987). "Chemie záporných iontů plynné fáze methylisokyanidu". Journal of the American Chemical Society. 109 (20): 5992–5995. doi:10.1021 / ja00254a017. ISSN 0002-7863.
- ^ Singleton, Eric; Oosthuizen, Hester E. (1983). "Kovové izokyanidové komplexy". Pokroky v organokovové chemii. 22: 209–310. doi:10.1016 / S0065-3055 (08) 60404-9.
- ^ Bassett, J.M .; Barker, G. K.; Green, M .; Howard, J. A.; Stone, GA; Wolsey, W.C. "Chemie nízkovalentních komplexů isokyanidů kovů". J.C.S. Dalton. 1981: 219–227.
- ^ Bassett, J.-M .; Farrugia, L. J .; Stone, F.G.A. (1980). "Protonace pentakis (t-butylisokyanid) železa". J.C.S. Dalton. 1980: 1789–1790. doi:10.1039 / DT9800001789.
- ^ Scheuer, P. J. (1992). "Isocyanidy a kyanidy jako přírodní produkty". Účty chemického výzkumu. 25 (10): 433–439. doi:10.1021 / ar00022a001.
- ^ Názvosloví IUPAC organických sloučenin (doporučení 1993)
- ^ Názvosloví IUPAC organických sloučenin (doporučení 1993)

![{ displaystyle left [{ ce {R}} - { overset { oplus} { ce {N}}} { ce {#}} { overset { ominus} { ce {C}} } { ce {: , <-> R - { ddot {N}} = C {:}}} doprava]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31596ad44ed69b7ad7230333e4059f48ef0d3b65)
