Nitren - Nitrene

v chemie, a nitren nebo imene (R – N) je dusík analogie a karben. Atom dusíku není nabitý a jednomocný,[1] takže má jen 6 elektrony v jeho valenční úrovni - dva kovalentní vazba a čtyři nevázané elektrony. Proto se považuje za elektrofil v důsledku neuspokojený oktet. Nitren je a reaktivní meziprodukt a je zapojen do mnoha chemické reakce.[2][3] Nazývá se nejjednodušší nitren, HN imidogen, a tento termín je někdy používán jako synonymum pro nitrenovou třídu.[4]
Konfigurace elektronů
V nejjednodušším případě má lineární N – H molekula (imidogen) svůj atom dusíku sp hybridizováno, se dvěma ze svých čtyř nevázaných elektronů jako a osamělý pár na orbitálu sp a další dva zabírají a degenerovat pár p orbitaly. The elektronová konfigurace je v souladu s Hundovo pravidlo: nízkoenergetická forma je a trojice s jedním elektronem v každém z p orbitalů a vysoce energetickou formou je tílko s elektronovým párem vyplňujícím jeden p orbitál a druhý p orbitál prázdný.
Stejně jako u karbenů existuje silná korelace mezi hustota odstředění na atomu dusíku, který lze vypočítat in silico a parametr rozdělení nulového pole D z nichž lze experimentálně odvodit elektronová spinová rezonance.[5] Malé nitreny, jako je NH nebo CF3N mají hodnoty D kolem 1,8 cm−1 s hustotou odstřeďování blízkou maximální hodnotě 2. Na spodním konci stupnice jsou molekuly s nízkou D Hodnoty (<0,4) a hustota odstřeďování 1,2 až 1,4, jako je 9-anthrylnitren a 9-fenanthrylnitren.
Formace
Protože nitreny jsou tak reaktivní, nejsou izolovány. Místo toho se během reakce tvoří jako reaktivní meziprodukty. Existují dva běžné způsoby, jak generovat nitreny:
- Z azidy podle termolýza nebo fotolýza, s vyloučením dusík plyn. Tato metoda je obdobou vzniku karbeny z diazo sloučeniny.
- Z isokyanáty, s vyloučením kysličník uhelnatý. Tato metoda je analogická tvorbě karbenů z keteny.
Reakce
Nitrenové reakce zahrnují:
- Vložení nitrenu C – H. Nitren se může snadno vložit do uhlíku na vodík kovalentní vazba čímž se získá amin nebo amid. Singlet nitren reaguje s zachování konfigurace. V jedné studii[6] nitren, vzniklý oxidací a karbamát s persíran draselný, dává inzerční reakce do palladium na dusíkovou vazbu reakčního produktu sloučeniny octan palladnatý s 2-fenylpyridin na methyl N- (2-pyridylfenyl) karbamát v a kaskádová reakce:
- V této inzerci C – H je podezření na nitrenový meziprodukt zahrnující oxim, anhydrid kyseliny octové vedoucí k isoindol:[7]
- Nitrenová cykloadice. S alkeny, nitreny reagují za vzniku aziridiny, velmi často s nitrenoid prekurzory jako nosyl- nebo tosyl-substituovaný [N- (fenylsulfonyl) imino] fenyljodinan (PhI = NNs nebo PhI = NTs)), ale je známo, že reakce funguje přímo s sulfonamid v přítomnosti a přechodový kov na základě katalyzátor jako měď, palladium nebo zlato:[8][9][10][11][12]
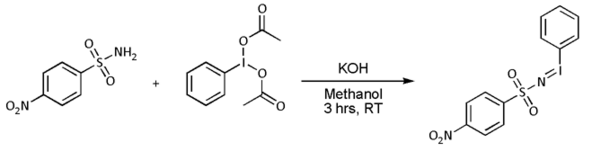
- Ve většině případů však [N-(str-nitrofenylsulfonyl) imino] fenyljodinan (PhI = NNs) se připravuje samostatně následujícím způsobem:
- Přenos nitrenu probíhá dále:
- V této konkrétní reakci oba cis -stilben ilustrované a trans forma (není zobrazena) má za následek totéž trans-aziridinový produkt, což naznačuje dvoustupňový proces mechanismus reakce. Energetický rozdíl mezi nitrily tripletů a singletů může být v některých případech velmi malý, což umožňuje interkonverze pokojová teplota. Tripletové nitreny jsou termodynamicky stabilnější, ale reagují postupně, což umožňuje volnou rotaci, a tím vytváří směs stereochemie.[13]
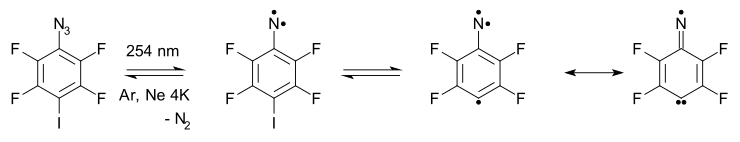
- Arylnitrenová expanze kruhu a kontrakce kruhu: Arylnitreny vykazují expanzi kruhu na 7členný kruh kumuleny, reakce otevírání kruhu a nitrilové formace mnohokrát ve složitých reakčních cestách. Například azid 2 ve schématu níže[5] uvězněn v argon matice při 20 K při fotolýze vypuzuje dusík na triplet nitren 4 (pozorováno experimentálně s ESR a ultrafialově viditelná spektroskopie ), který je v rovnováze s produktem expanze kruhu 6.
- Nitren se nakonec přemění na kruh otevřený nitril 5 skrz diradical středně pokročilí 7. Při vysokoteplotní reakci FVT při 500–600 ° C také poskytuje nitril 5 v 65% výtěžku.[14]
Nitrenové radikály
Pro několik sloučenin obsahujících jak nitrenovou skupinu, tak a volné radikály skupina byla zaznamenána ESR kvarteta s vysokým spinem (matice, kryogenní teploty). Jeden z nich má aminoxid začleněna radikální skupina,[15] jiný systém má uhlíkovou radikálovou skupinu.[16]
(4 K znamená -452,2 ° Fahrenheita, rovné 4 Kelvinům)
V tomto systému je jeden z dusíkových nepárových elektronů delokalizován v aromatickém kruhu, čímž je sloučenina σ – σ – π triradikální. A karben dusíkový radikál (imidylový radikál) rezonanční struktura přispívá k celkovému elektronickému obrazu.
V roce 2019 izolovali Betley a Lancaster autentický triplet nitren stabilizovaný koordinací s centrem mědi v objemném ligandu.[17]
Reference
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “nitreny ". doi:10.1351 / zlatá kniha.N04145
- ^ Lwowski, W., ed. (1970). Nitrenové. New York: Mezivědnost.
- ^ Wentrup, C. (1984). Reaktivní meziprodukty. New York: Wiley.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “imidogeny ". doi:10.1351 / goldbook.I02951
- ^ A b Kvaskoff, David; Bednarek, Paweł; George, Lisa; Waich, Kerstin; Wentrup, Curt (2006). "Nitrenes, Diradicals, and Ylides. Expanze kruhu a otevření kruhu ve 2-chinazolylnitrénech". J. Org. Chem. 71 (11): 4049–4058. doi:10.1021 / jo052541i. PMID 16709043.
- ^ Čt, Hung-Yat; Yu, Wing-Yiu; Che, Chi-Ming (2006). „Intermolekulární amidace neaktivovaného sp2 a sp3 C – H vazby prostřednictvím aktivace kaskádou C – H aktivovanou palladiem / vložením nitrenu “. J. Am. Chem. Soc. 128 (28): 9048–9049. doi:10.1021 / ja062856v. PMID 16834374.
- ^ Savarin, Cécile G .; Grisé, Christiane; Murry, Jerry A .; Výstružník, Robert A .; Hughes, David L. (2007). „Nová intramolekulární reaktivita oximů: Syntéza cyklických a spiro-fúzovaných iminů“. Org. Lett. 9 (6): 981–983. doi:10.1021 / ol0630043. PMID 17319674.
- ^ Li, Zigang; Ding, Xiangyu; On, Chuan (2006). „Reakce přenosu nitrenu katalyzované komplexy zlata“. J. Org. Chem. 71 (16): 5876–5880. doi:10.1021 / jo060016t.
- ^ Evans, David A .; Faul, Margaret M .; Bilodeau, Mark T. (1994). „Vývoj reakce na aziridaci olefinů katalyzovanou mědí“. J. Am. Chem. Soc. 116 (7): 2742–2753. doi:10.1021 / ja00086a007.
- ^ Brandt, Peter; Sodergren, Mikael J .; Andersson, Pher G .; Norrby, Per-Ola (2000). „Mechanistické studie aziridace alkenem katalyzovanou mědí“. J. Am. Chem. Soc. 122 (33): 8013–8020. doi:10.1021 / ja993246g.
- ^ Watson, Iain D. G .; Yu, Lily; Yudi, Andrei K. (2006). „Pokroky v reakcích přenosu dusíku zahrnujících aziridiny“. Acc. Chem. Res. 39 (3): 194–206. doi:10,1021 / ar050038m. PMID 16548508.
- ^ Reaktanty cis-stilben nebo trans-stilben, prekurzor nitrenu str-nitrosulfonamid nebo nosylamin který je oxidován jodosobenzen diacetát. Zlatý katalyzátor je založen na a terpyridin trojzubec ligand.
- ^ Yudin, Andrei K., vyd. (2007). Aziridiny a epoxidy v organické syntéze. str. 120. ISBN 978-3-527-31213-9.
- ^ The chinazolin se připraví z odpovídajícího bromidu a azid sodný. Azid je v rovnováze s tetrazol 3.
- ^ Lahti, Paul M .; Esat, Burak; Liao, Yi; Serwinski, Paul; Lan, Jiang; Walton, Richard (30. května 2001). "Heterospin organické molekuly: nitren-radikální vazby". Mnohostěn. 20 (11–14): 1647–1652. doi:10.1016 / S0277-5387 (01) 00667-2.
- ^ Sander, Wolfram; Grote, Dirk; Kossmann, Simone; Neese, Frank (2008). „2,3,5,6-Tetrafluorfenylnitren-4-yl: elektronová paramagnetická rezonanční spektroskopická charakterizace nitreno radikálu kvarteta v základním stavu“. J. Am. Chem. Soc. 130 (13): 4396–4403. doi:10.1021 / ja078171s. PMID 18327939.
- ^ Carsch, K. M .; DiMucci, I. M .; Iovan, D. A .; Li, A .; Zheng, S.-L .; Titus, C. J .; Lee, S. J .; Irwin, K. D .; Nordlund, D .; Lancaster, K. M .; Betley, T. A. (2019). „Syntéza komplexu triplet nitrenu podporovaného mědí, který je relevantní pro aminaci katalyzovanou mědí“. Věda. 365 (6458): 1138–1143. doi:10.1126 / science.aax4423. PMC 7256962. PMID 31515388.CS1 maint: více jmen: seznam autorů (odkaz)