Borohydrid sodný - Sodium borohydride
 | |||
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Tetrahydridoboritan sodný (1–) | |||
| Systematický název IUPAC Boranuid sodný | |||
| Identifikátory | |||
| |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.037.262 | ||
| Číslo ES |
| ||
| 23167 | |||
| Pletivo | Sodík + borohydrid | ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 1426 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
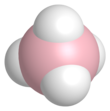
| NaBH4 | |||
| Molární hmotnost | 37,83 g / mol | ||
| Vzhled | bílé krystaly hygroskopický | ||
| Hustota | 1,07 g / cm3[1] | ||
| Bod tání | 400 ° C (752 ° F; 673 K) (rozkládá se)[1] | ||
| 550 g / l[1] | |||
| Rozpustnost | rozpustný v kapalině amoniak, aminy, pyridin | ||
| Struktura[2] | |||
| Krychlový (NaCl), cF8 | |||
| Fm3m, č. 225 | |||
A = 0,6157 nm | |||
| Nebezpečí | |||
| H260, H301, H311, H314 | |||
| P223, P231, P232, P280, P301 + 310, P370 + 378, P422 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 70 ° C (158 ° F; 343 K) | ||
| ca. 220 ° C (428 ° F; 493 K) | |||
| Výbušné limity | 3% | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 160 mg / kg (orálně - krysa) 230 mg / kg (dermálně - králík) | ||
| Související sloučeniny | |||
jiný anionty | Kyanoborohydrid sodný Hydrid sodný Boritan sodný Borax Hydrid hlinito-sodný | ||
jiný kationty | Borohydrid lithný | ||
Související sloučeniny | Lithiumaluminiumhydrid Triacetoxyborohydrid sodný | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Borohydrid sodný, také známý jako tetrahydridoboritan sodný a tetrahydroboritan sodný,[3] je anorganická sloučenina s vzorec NaBH4. Tato bílá pevná látka, se kterou se obvykle setkáváme jako prášek, je redukční činidlo který nachází uplatnění v chemii, a to jak v laboratoři, tak v průmyslovém měřítku. Byl testován jako předúprava na rozvlákňování dřeva, ale je příliš nákladný na to, aby byl komercializován.[4][5] Sloučenina je rozpustná v alkoholy jisté ethery a voda, i když pomalu hydrolyzuje.[6]
Sloučenina byla objevena ve 40. letech 20. století H. I. Schlesinger, který vedl tým hledající těkavé sloučeniny uranu.[7][8] Výsledky tohoto válečného výzkumu byly odtajněny a zveřejněny v roce 1953.
Vlastnosti
| Solventní | Rozpustnost (g / 100 ml)[6] |
|---|---|
| MeOH | 13 |
| EtOH | 3.16 |
| Diglyme | 5.15 |
| Et2Ó | nerozpustný |
Borohydrid sodný je bílý až šedobílý bez zápachu mikrokrystalický prášek, který často tvoří hrudky. Může být čištěn rekrystalizací z tepla (50 ° C) diglyme.[9] Borohydrid sodný je rozpustný v protická rozpouštědla jako je voda a nižší alkoholy. Také s nimi reaguje protická rozpouštědla vyrábět H2; tyto reakce jsou však poměrně pomalé. Úplný rozklad methanolového roztoku vyžaduje téměř 90 minut při 20 ° C.[10] Rozkládá se v neutrálních nebo kyselých vodných roztocích, ale je stabilní při pH 14.[6]
Struktura
NaBH4 je sůl sestávající z čtyřboké [BH4]− anion. Je známo, že pevná látka existuje jako tři polymorfy: α, β a y. Stabilní fáze při pokojové teplotě a tlaku je α-NaBH4, který je krychlový a přijímá an NaCl -typová struktura, v Fm3m vesmírná skupina. Při tlaku 6,3 GPa se struktura změní na tetragonální β-NaBH4 (vesmírná skupina P421C) a při 8,9 GPa, ortorombické y-NaBH4 (vesmírná skupina Pnma) se stává nejstabilnějším.[11][12][13]
 |  |  |
Syntéza a manipulace
Pro komerční NaBH4 výroba, proces Brown-Schlesinger a Bayerův proces jsou nejoblíbenější metody. V procesu Brown-Schlesinger se průmyslově připravuje borohydrid sodný hydrid sodný (vyrobeno reakcí Na a H2) a trimethylborát při 250–270 ° C:
- B (OCH3)3 + 4 NaH → NaBH4 + 3 NaOCH3
Ročně se vyprodukují miliony kilogramů, což výrazně překračuje úroveň výroby jakéhokoli jiného hydridového redukčního činidla.[4] Borohydrid sodný lze také vyrobit působením NaH na prášek borosilikátové sklo.[14]
Liší se od toho, Bayerův proces je založen na reakci mezi borax (Na2B4Ó7), Na, H2, a oxid křemičitý (SiO2) při 700 ° C za vzniku borohydridu sodného a křemičitanu sodného
- Na2B4Ó7 + 16 Na + 8 H2 + 7 SiO2 → 4 NaBH4 + 7 Na2SiO3
V současné době existuje snaha upravit Bayerův proces tak, že se místo sodíku použije levnější redukční kovový hořčík (Mg). Reakce jako:
- 8 MgH2 + Na2B4Ó7 + Na2CO3 → 4 NaBH4 + 8 MgO + CO2
a
- 2 MgH2 + NaBO2 → NaBH4 + 2 MgO
jsou slibné úpravy Bayerova procesu, ale nebyly vyvinuty dostatečně daleko, aby vykazovaly vysoký výtěžek i rychlé reakční rychlosti.[15][16]
Reaktivita
NaBH4 redukuje mnoho organických karbonylů, v závislosti na přesných podmínkách. Nejtypičtěji se používá v laboratoři pro přeměnu ketonů a aldehydů na alkoholy. Účinně snižuje acylchloridy, anhydridy, a-hydroxylaktony, thioestery, a iminy při pokojové teplotě nebo nižší. S nadbytkem činidla a / nebo zvýšenými teplotami redukuje estery pomalu a neúčinně, zatímco karboxylové kyseliny a amidy nejsou redukovány vůbec.[17] NaBH4 reaguje s vodou a alkoholy, s vývojem plynného vodíku a tvorbou odpovídajícího boritanu, přičemž reakce je zvláště rychlá při nízkém pH.
Nicméně alkohol, často methanol nebo ethanol, je obecně rozpouštědlem volby pro redukci borohydridu sodného na ketony a aldehydy. Mechanismus redukce ketonů a aldehydů byl zkoumán kinetickými studiemi a na rozdíl od populárních vyobrazení v učebnicích tento mechanismus nezahrnuje čtyřčlenný přechodný stav, jako je hydroborace alkenu,[18] nebo šestičlenný přechodný stav zahrnující molekulu alkoholového rozpouštědla.[19] Aktivace vodíkových vazeb je nutná, protože v aprotickém rozpouštědle, jako je diglym, nedochází k redukci. Avšak rychlostní pořadí v alkoholu je 1,5, zatímco karbonylová sloučenina a borohydrid jsou oba prvního řádu, což naznačuje mechanismus složitější než ten, který zahrnuje šestičlenný přechodný stav, který zahrnuje pouze jednu molekulu alkoholu. Bylo navrženo, že dochází k současné aktivaci karbonylové sloučeniny a borohydridu prostřednictvím interakce s alkoholem, respektive alkoxidovým iontem, a že reakce probíhá v otevřeném přechodovém stavu.[20][21]
a, β-nenasycené ketony mají tendenci být redukovány NaBH4 v 1,4-smyslu, i když se často tvoří směsi. Přidání chloridu ceričitého jako přísady výrazně zlepšuje selektivita pro 1,2-redukci nenasycených ketonů (Snížení Luche ). a, β-nenasycené estery také podléhají 1,4-redukci v přítomnosti NaBH4.[6]
Mnoho dalších hydridových činidel silněji redukuje. Ty obvykle zahrnují nahrazení hydridu alkylovými skupinami, jako je triethylborohydrid lithný a L-selectride (lithium tri-sek-butylborohydrid) nebo nahrazením B Al. Změny protiiontu také ovlivňují reaktivitu borohydridu.[22]
Reaktivita NaBH4 mohou být vylepšeny nebo rozšířeny řadou sloučenin.[23][24] Oxidace s jód v tetrahydrofuran dává boran-tetrahydrofuran komplex, který může redukovat karboxylové kyseliny.[25] Podobně NaBH4-MeOH systém, vytvořený přidáním methanolu na borohydrid sodný ve zpětném toku THF, redukuje estery na odpovídající alkoholy.[26] Smícháním vody nebo alkoholu s borohydridem se část z ní převede na nestabilní ester hydridu, který je účinnější při redukci, ale redukční činidlo se nakonec spontánně rozloží na plynný vodík a boritany. Stejná reakce může také nastat intramolekulárně: α-ketoester se přemění na diol, protože vyrobený alkohol napadá borohydrid za vzniku esteru borohydridu, který pak redukuje sousední ester.[27] Kombinace NaBH4 s karboxylové kyseliny vede k tvorbě druhů acyloxyborohydridů, jako je např BODNOUT. Mohou provádět řadu redukcí, které obvykle nejsou spojeny s chemií borohydridů, jako jsou alkoholy na uhlovodíky a nitrily na primární aminy.[28]
Koordinační chemie
BH4− je ligand pro ionty kovů. Takové borohydridové komplexy se často připravují působením NaBH4 (nebo LiBH4) na odpovídajícím halogenidu kovu. Jedním z příkladů je titanocen derivát:[29]
- 2 (C.5H5)2TiCl2 + 4 NaBH4 → 2 (C.5H5)2TiBH4 + 4 NaCl + B2H6 + H2
Zdroj vodíku
V přítomnosti kovových katalyzátorů uvolňuje borohydrid sodný vodík. S využitím této reaktivity se borohydrid sodný používá v prototypech přímý borohydridový palivový článek. Vodík je generován pro palivový článek pomocí katalytické rozklad vodného roztoku borohydridu:
- NaBH4 + 2 H2O → NaBO2 + 4 H2 (ΔH <0)
Aplikace
Hlavní aplikací borohydridu sodného je výroba dithioničitan sodný z oxidu siřičitého: Dithioničitan sodný se používá jako bělicí prostředek pro dřevní buničinu a v barvicím průmyslu.
Borohydrid sodný snižuje aldehydy a ketony dát související alkoholy. Tato reakce se používá při výrobě různých antibiotik včetně chloramfenikol, dihydrostreptomycin, a thiofenikol. Různé steroidy a vitamin A. se připravují za použití borohydridu sodného v alespoň jednom kroku.
Borohydrid sodný byl považován za pevný stav skladování vodíku kandidát. Ačkoli nebylo dosaženo praktických teplot a tlaků pro skladování vodíku, v roce 2012 jádro-plášť nanostruktura borohydridu sodného bylo úspěšně použito pro skladování, uvolňování a reabsorpci vodíku za mírných podmínek.[30]
K redukci lze použít borohydrid sodný liška ve starých knihách a dokumentech.[31]
Bezpečnost
Borohydrid sodný je zdrojem bazické látky borát - soli, které mohou být korozivní, a - vodík nebo diboran, které jsou hořlavé. Spontánní vznícení může vzniknout z roztoku borohydridu sodného v dimethylformamid.
Viz také
Reference
- ^ A b C Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92. vydání). CRC Press. p. 4,89. ISBN 978-1439855119.
- ^ Ford, P. T. a Powell, H. M. (1954). „Jednotková buňka borohydridu draselného, KBH4, při 90 ° K ". Acta Crystallogr. 7 (8): 604–605. doi:10.1107 / S0365110X54002034.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Busch, D.H. (2009). Anorganické syntézy. 20. Wiley. p. 137. ISBN 9780470132869. Citováno 20. května 2015.
- ^ A b Rittmeyer, Peter a Wietelmann, Ulrich (2002) "Hydrides" v Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a13_199
- ^ Istek, A. a Gonteki, E. (2009). "Využití borohydridu sodného (NaBH4) v procesu výroby sulfátové buničiny " (PDF). Journal of Environmental Biology. 30 (6): 951–953. PMID 20329388.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b C d Banfi, L .; Narisano, E .; Riva, R .; Stiasni, N .; Hiersemann, M. (2004). "Borohydrid sodný". Encyklopedie činidel pro organickou syntézu. New York: J. Wiley & Sons. doi:10.1002 / 047084289X.rs052. ISBN 978-0471936237.
- ^ Schlesinger, H. I .; Brown, H. C.; Abraham, B .; Bond, A. C .; Davidson, N .; Finholt, A.E .; Gilbreath, J. R .; Hoekstra, H .; Horvitz, L .; Hyde, E.K .; Katz, J. J .; Knight, J .; Lad, R. A .; Mayfield, D. L .; Rapp, L .; Ritter, D. M .; Schwartz, A. M .; Sheft, I .; Tuck, L. D .; Walker, A. O. (1953). „Nový vývoj v chemii diboranu a borohydridů. Obecné shrnutí“. J. Am. Chem. Soc. 75: 186–90. doi:10.1021 / ja01097a049.
- ^ Hermann I. Schlesinger a Herbert C Brown (1945) "Příprava sloučenin alkalických kovů ". Patent USA 2461661. udělený dne 1949-02-15; platnost vypršela 15.2.1966.
- ^ Brown, H. C. „Organic Syntheses via Boranes“ John Wiley & Sons, Inc. New York: 1975. ISBN 0-471-11280-1. strana 260-1.
- ^ Lo, Chih-ting F .; Karan, Kunal; Davis, Boyd R. (2007). „Kinetické studie reakce mezi borohydridem sodným a methanolem, vodou a jejich směsmi“. Výzkum průmyslové a inženýrské chemie. 46 (17): 5478–5484. doi:10.1021 / ie0608861.
- ^ "Strukturální přechody v NaBH [sub 4] pod tlakem". Appl. Phys. Lett. 87 (26): 261916. 2005. doi:10.1063/1.2158505.
- ^ Filinchuk, Y .; Talyzin, A. V .; Chernyshov, D .; Dmitriev, V. (2007). „Vysokotlaká fáze NaBH4: Krystalová struktura ze synchrotronových práškových difrakčních dat ". Phys. Rev. B. 76 (9): 092104. Bibcode:2007PhRvB..76i2104F. doi:10.1103 / PhysRevB.76.092104. S2CID 122588719.
- ^ Kim, E .; Kumar, R .; Weck, P. F .; Cornelius, A. L .; Nicol, M .; Vogel, S. C .; Zhang, J .; Hartl, M .; Stowe, A. C .; Daemen, L .; Zhao, Y. (2007). „Fázové přechody řízené tlakem v NaBH4: teorie a experimenty ". J. Phys. Chem. B. 111 (50): 13873–13876. doi:10.1021 / jp709840w. PMID 18031032.
- ^ Schubert, F .; Lang, K .; Burger, A. (1960) "Borohydridy alkalických kovů" (Bayer). Německý patent DE 1088930 19600915 (ChemAbs: 55: 120851). Dodatek k. Ger. 1 067 005 (CA 55, 11778i). Z abstraktu: „Borosilikáty alkalických kovů se zpracují hydridy alkalických kovů v poměru přibližně 1: 1 při> 100 ° C s tlakem H nebo bez něj.“
- ^ Wu, Ying a kol. (2004) Přehled chemických procesů pro syntézu borohydridu sodného. Millennium Cell Inc.
- ^ Ouyang, Liuzhang; Zhong, Hao; Li, Hai-Wen; Zhu, Min (2018). „Systém recyklace vodíku NaBH4 na základě procesu snadné regenerace: recenze“. Anorganické látky. 6: 10. doi:10,3390 / anorganické látky6010010.
- ^ Banfi, Luca; Narisano, Enrica; Riva, Renata; Stiasni, Nikola; Hiersemann, Martin; Yamada, Tohru; Tsubo, Tatsuyuki (2014), „Sodium Borohydride“, Encyklopedie činidel pro organickou syntézu„John Wiley & Sons, s. 1–13, doi:10.1002 / 047084289x.rs052.pub3, ISBN 9780470842898
- ^ Carey, Francis A. (01.01.2016). Organická chemie. Giuliano, Robert M., 1954– (desáté vydání). New York, NY. ISBN 9780073511214. OCLC 915135847.
- ^ Loudon, Marc (2009). Organická chemie (5. vydání). Greenwood Village, Colo .: Roberts and Co. ISBN 9780981519432. OCLC 263409353.
- ^ Wigfield, Donald C .; Gowland, Frederick W. (březen 1977). „Kinetická role hydroxylového rozpouštědla při redukci ketonů borohydridem sodným. Nové návrhy mechanismu, geometrie přechodového stavu a komentář k původu stereoselektivity“. The Journal of Organic Chemistry. 42 (6): 1108–1109. doi:10.1021 / jo00426a048.
- ^ Wigfield, Donald C. (leden 1979). "Stereochemie a mechanismus redukce ketonů hydridovými činidly". Čtyřstěn. 35 (4): 449–462. doi:10.1016/0040-4020(79)80140-4. ISSN 0040-4020.
- ^ Seyden-Penne, J. (1991) Redukce alumino- a borohydridy v organické syntéze. VCH – Lavoisier: Paříž. p. 9. ISBN 978-0-471-19036-3
- ^ Periasamy, Mariappan; Thirumalaikumar, Muniappan (2000). "Metody zvýšení reaktivity a selektivity borohydridu sodného pro aplikace v organické syntéze". Journal of Organometallic Chemistry. 609 (1–2): 137–151. doi:10.1016 / S0022-328X (00) 00210-2.
- ^ Nora de Souza, Marcus Vinícius; Alves Vasconcelos; Thatyana Rocha (1. listopadu 2006). "Nedávné metodiky zprostředkované borohydridem sodným při redukci různých tříd sloučenin". Aplikovaná organokovová chemie. 20 (11): 798–810. doi:10,1002 / aoc.1137.
- ^ Kanth, J. V. Bhaskar; Periasamy, Mariappan (1. září 1991). "Selektivní redukce karboxylových kyselin na alkoholy za použití borohydridu sodného a jódu". The Journal of Organic Chemistry. 56 (20): 5964–5965. doi:10.1021 / jo00020a052.
- ^ da Costa, Jorge C.S .; Pais, Karla C .; Fernandes, Elisa L .; de Oliveira, Pedro S. M .; Mendonça, Jorge S .; de Souza, Marcus V. N .; Peralta, Mônica A .; Vasconcelos, Thatyana R.A. (2006). „Jednoduchá redukce ethyl, isopropyl a benzyl aromatických esterů na alkoholy pomocí systému borohydrid sodný-methanol“ (PDF). Arkivoc: 128–133. Citováno 29. srpna 2006.
- ^ Dalla, V .; Catteau, J.P .; Pale, P. (1999). „Mechanické zdůvodnění NaBH4 redukce α-ketoesterů “. Čtyřstěn dopisy. 40 (28): 5193–5196. doi:10.1016 / S0040-4039 (99) 01006-0.
- ^ Gribble, Gordon, W. (1998). „Borohydrid sodný v médiu karboxylové kyseliny: fenomenální redukční systém“. Recenze chemické společnosti. 27 (6): 395. doi:10.1039 / A827395Z. S2CID 96906861.
- ^ Lucas, C. R. (1977). Bis (5-cyklopentadienyl) [tetrahydroborát (1 -)] titan. Anorganické syntézy. 17. p. 93. doi:10.1002 / 9780470132487.ch27. ISBN 9780470132487.
- ^ Stuart Gary, “Skladování vodíku již není ve vzduchu " v ABC Science 16. srpna 2012, s odvoláním Christian, Meganne; Aguey-Zinsou, Kondo François (2012). „Strategie Core – Shell vedoucí k vysoké reverzibilní skladovací kapacitě vodíku pro NaBH4". ACS Nano. 6 (9): 7739–7751. doi:10.1021 / nn3030018. PMID 22873406.
- ^ Mistři, Kristin. „Jak zabránit a zvrátit lišku ve vzácných knihách“. bookstellyouwhy.com. Citováno 3. dubna 2018.