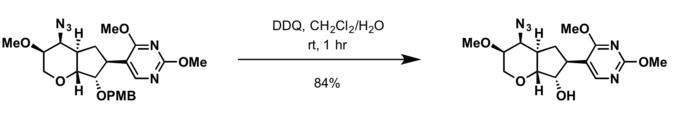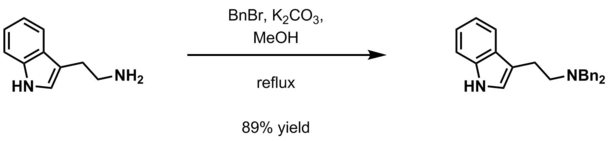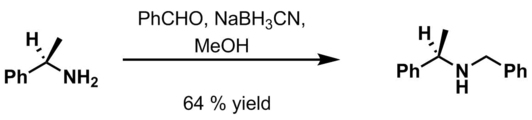Benzylová skupina - Benzyl group

v organická chemie, benzyl je substituent nebo molekulární fragment mající strukturu C6H5CH2-. Benzylová funkce a benzen kruh připojený k CH2 skupina.[1]
Nomenklatura
V nomenklatuře IUPAC předpona benzyl označuje C6H5CH2 substituent, například benzylchlorid nebo benzylbenzoát. Benzyl nelze zaměňovat fenyl se vzorcem C.6H5. Termín benzylová se používá k popisu polohy prvního uhlíku navázaného na benzen nebo jiný aromatický prsten. Například (C.6H5) (CH3)2C+ se označuje jako „benzyl“ karbokace. Benzyl volné radikály má vzorec C
6H
5CH•
2. Benzylovým kationtem nebo fenylkarbeniovým iontem je karbokace se vzorcem C
6H
5CH+
2; benzyl aniont nebo fenylmethanidový ion je karbanion se vzorcem C
6H
5CH−
2. Žádný z těchto druhů nemůže být vytvořen ve významném množství ve fázi roztoku za normálních podmínek, ale jsou užitečnými referenty pro diskusi reakční mechanismy a mohou existovat jako reaktivní meziprodukty.
Zkratky
Zkratka „Bn“ označuje benzyl. Například, benzylalkohol lze reprezentovat jako BnOH. Tuto zkratku nelze zaměňovat s „Bz“, což je zkratka pro benzoyl skupina C.6H5C (O) - nebo fenylová skupina C6H5, zkráceně „Ph“. Matoucí je, že ve staré literatuře se „Bz“ používalo také pro benzyl.
Reaktivita benzylových center
Zvýšená reaktivita benzylových pozic je přičítána nízké energie disociace vazby pro benzylové vazby C-H. Konkrétně vazba C6H5CH2−H je asi o 10–15% slabší než jiné druhy C-H vazeb. Sousední aromatický kruh stabilizuje benzylové radikály. Níže uvedená data srovnávají benzylovou vazbu C-H se souvisejícími silami vazby C-H.
| Pouto | Pouto | Energie disociace vazeb | Komentář | |
|---|---|---|---|---|
| (kcal / mol) | (kJ / mol) | |||
| C6H5CH2-H | benzylová vazba C-H | 90 | 377 | podobný allylickým C-H vazbám takové vazby vykazují zvýšenou reaktivitu |
| H3C-H | methyl C-H vazba | 105 | 439 | jedna z nejsilnějších alifatických C-H vazeb |
| C2H5-H | ethyl C-H vazba | 101 | 423 | o něco slabší než H3C-H |
| C6H5-H | fenyl C-H vazba | 113 | 473 | srovnatelné s vinylovým radikálem, vzácné |
| CH2= CHCH2-H | allylický Vazba C – H | 89 | 372 | takové vazby vykazují zvýšenou reaktivitu |
Slabost vazby C-H odráží stabilitu benzylového radikálu. Ze souvisejících důvodů vykazují benzylové substituenty zvýšenou reaktivitu, jako v oxidace, halogenace volných radikálů nebo hydrogenolýza. Jako praktický příklad, v přítomnosti vhodných katalyzátorů, p-xylen oxiduje výhradně na benzylových pozicích kyselina tereftalová:
- CH3C6H4CH3 + 3 O.2 → HO2CC6H4CO2H + 2 H2Ó.
Touto metodou se ročně vyrobí miliony tun kyseliny tereftalové.[2]
Funkcionalizace v benzylové poloze
V několika případech k těmto benzylovým transformacím dochází za podmínek vhodných pro syntetické podmínky. The Wohl-Zieglerova reakce bude bromovat benzyl C-H vazbu: (ArCHR2 → ArCBrR2).[3] Jakákoli neterciární benzylová alkylová skupina bude oxidována na karboxylovou skupinu vodným manganistanem draselným (KMnO4) nebo koncentrovaná kyselina dusičná (HNO3): (ArCHR2 → ArCOOH).[4] Nakonec komplex oxid chromitý a 3,5-dimethylpyrazol (CrO3–Dmpyz) selektivně oxiduje benzylovou methylenovou skupinu na karbonyl: (ArCH2R → ArC (O) R).[5] Poslední dobou, Kyselina 2-jodoxybenzoová v DMSO bylo hlášeno provést stejnou transformaci.[6]
Jako chránící skupina
Benzylové skupiny se občas používají jako chránící skupiny v organické syntéze. Jejich instalace a zejména jejich demontáž vyžadují relativně drsné podmínky, takže benzyl není pro ochranu typicky preferován.[7]
Ochrana proti alkoholu
Benzyl se běžně používá v organické syntéze jako silná chránící skupina pro alkoholy a karboxylové kyseliny.
- Ošetření alkoholu silným základem, například práškovým hydroxid draselný nebo hydrid sodný a benzylhalogenid (BnCl nebo BnBr )[7][8]
- Monobenzylace dioly lze dosáhnout pomocí Ag2Ó v dimethylformamid (DMF) při okolní teplotě při zvýšených teplotách[9]
- Primární alkoholy může být selektivně benzylován v přítomnosti fenolických funkčních skupin za použití Cu (acac)2[10]
Metody deprotekce
Benzylethery lze odstranit pod redukční podmínky, oxidační podmínkya použití Lewisovy kyseliny.[7]
- Odebráno pomocí hydrogenolýza[11]
- Proces s jedním elektronem s Na /NH3 nebo Li / NH3
- Skupiny chránící benzyl lze odstranit pomocí široké škály oxidačních činidel, včetně:
- CrO3 /octová kyselina při okolní teplotě
- Ozón
- N-Bromosukcinimid (NBS)
- N-Iodosukcinimid (NIS)
- Trimethylsilyl jodid (já3SiI) dichlormethan při teplotě okolí (selektivity lze dosáhnout za konkrétních podmínek)
The p-methoxybenzyl chránící skupina
p-Methoxybenzyl (PMB) se používá jako a chránící skupina pro alkoholy v organická syntéza (4-methoxybenzylthiol se používá k ochraně thiolů).

- Silný základ, jako je prášek hydroxid draselný nebo hydrid sodný a p-methoxybenzylhalogenid (chlorid nebo bromid)[12][13]
- 4-methoxybenzyl-2,2,2-trichloracetimidát lze použít k instalaci skupiny PMB za přítomnosti:
- Skandium (III) triflát (Sc (OTf)3) v toluenu při 0 ° C[14]
- Kyselina trifluormethansulfonová (TfOH) v dichlormethan při 0 ° C[15]
Metody deprotekce
- 2,3-dichlor-5,6-dikyano-p-benzochinon (DDQ)[16]
- Podmínky pro deprotekci benzylové skupiny jsou použitelné pro odštěpení chránící skupiny PMB
Ochrana proti aminům
Benzylová skupina se příležitostně používá jako a chránící skupina pro aminy v organická syntéza. Existují i jiné metody.[7]
- Vodný Uhličitan draselný a benzylhalogenid (BnCl, BnBr ) v methanolu[17]
- Benzaldehyd, 6 mil HCl a NaBH3CN v methanolu[18]
Metody deprotekce
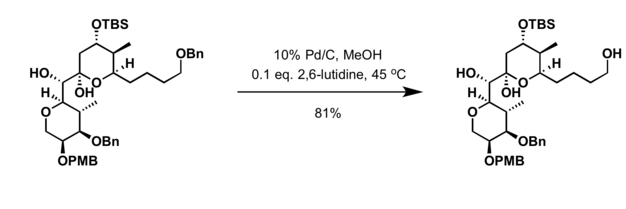
- Hydrogenace v přítomnosti palladium katalyzátor[19]
Viz také
Reference
- ^ Carey, F. A .; Sundberg, R. J. (2008). Advanced Organic Chemistry, Část A: Struktura a mechanismy (5. vydání). New York, NY: Springer. str.806 –808, 312–313. ISBN 9780387448978.
- ^ Sheehan, Richard J. „Kyselina tereftalová, dimethyltereftalát a kyselina isoftalová“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a26_193.
- ^ C., Vollhardt, K. Peter (2018-01-29). Organická chemie: struktura a funkce. Schore, Neil Eric, 1948- (8e ed.). New York. ISBN 9781319079451. OCLC 1007924903.
- ^ Chandler), Norman, R. O. C. (Richard Oswald (1993). Principy organické syntézy. Coxon, J. M. (James Morriss), 1941- (3. vyd.). London: Blackie Academic & Professional. ISBN 978-0751401264. OCLC 27813843.
- ^ Johnston, Jeffrey N. (2001), „Chromium (VI) Oxide-3,5-Dimethylpyrazol“, Oxid chromitý - 3,5-dimethylpyrazol, Encyklopedie činidel pro organickou syntézu, Americká rakovinová společnost, doi:10.1002 / 047084289x.rc170, ISBN 9780470842898
- ^ Baran, Phil S .; Zhong, Yong-Li (01.01.2001). "Selektivní oxidace na uhlí sousedící s aromatickými systémy s IBX". Journal of the American Chemical Society. 123 (13): 3183–3185. doi:10.1021 / ja004218x. ISSN 0002-7863. PMID 11457049.
- ^ A b C d Wuts, Peter G. M .; Greene, Theodora W. (2006). Greeneovy ochranné skupiny v organické syntéze (4. vydání). Wiley Online knihovna. doi:10.1002/0470053488. ISBN 9780470053485.
- ^ Fukuzawa, Akio; Sato, Hideaki; Masamune, Tadashi (01.01.1987). "Syntéza (±) -prepinnaterpenu, bromoditerpenu z červené řasy Yamada". Čtyřstěn dopisy. 28 (37): 4303–4306. doi:10.1016 / S0040-4039 (00) 96491-8.
- ^ Van Hijfte, Luc; Malý, R. Daniel (01.10.1985). "Intramolekulární reakce zachycující 1,3-diyl. Formální celková syntéza (±) -koriolinu". The Journal of Organic Chemistry. 50 (20): 3940–3942. doi:10.1021 / jo00220a058. ISSN 0022-3263.
- ^ Sirkecioglu, Okan; Karliga, Bekir; Talinli, Naciye (10. 11. 2003). "Benzylace alkoholů za použití bis [acetylacetonato] mědi jako katalyzátoru". Čtyřstěn dopisy. 44 (46): 8483–8485. doi:10.1016 / j.tetlet.2003.09.106.
- ^ Smith, Amos B .; Zhu, Wenyu; Shirakami, Shohei; Sfouggatakis, Chris; Doughty, Victoria A .; Bennett, Clay S .; Sakamoto, Yasuharu (01.03.2003). „Total Synthesis of (+) - Spongistatin 1. Efektivní konstrukce druhé generace pokročilé EF Wittigovy soli, fragmentační unie a závěrečné zpracování“. Organické dopisy. 5 (5): 761–764. doi:10.1021 / ol034037a. ISSN 1523-7060. PMID 12605509.
- ^ Marco, José L .; Hueso-Rodríguez, Juan A. (01.01.1988). "Syntéza opticky čistých 1- (3-furyl) -1,2-dihydroxyethanových derivátů". Čtyřstěn dopisy. 29 (20): 2459–2462. doi:10.1016 / S0040-4039 (00) 87907-1.
- ^ Takaku, Hiroši; Kamaike, Kazuo; Tsuchiya, Hiromichi (01.01.1984). "Syntéza oligonukleotidů. Část 21. Syntéza ribooligonukleotidů s použitím 4-methoxybenzylové skupiny jako nové chránící skupiny pro 2'-hydroxylovou skupinu". The Journal of Organic Chemistry. 49 (1): 51–56. doi:10.1021 / jo00175a010. ISSN 0022-3263.
- ^ Trost, Barry M .; Waser, Jerome; Meyer, Arndt (01.11.2007). "Celková syntéza (-) - kyseliny pseudolarové B". Journal of the American Chemical Society. 129 (47): 14556–14557. doi:10.1021 / ja076165q. ISSN 0002-7863. PMC 2535803. PMID 17985906.
- ^ Mukaiyama, Teruaki; Shiina, Isamu; Iwadare, Hayato; Saitoh, Masahiro; Nishimura, Toshihiro; Ohkawa, Naoto; Sakoh, Hiroki; Nishimura, Koji; Tani, Yu-ichirou (04.01.1999). "Asymetrická celková syntéza taxolu R". Chemistry - A European Journal. 5 (1): 121–161. doi:10.1002 / (SICI) 1521-3765 (19990104) 5: 1 <121 :: AID-CHEM121> 3.0.CO; 2-O. ISSN 1521-3765.
- ^ Hanessian, Stephen; Marcotte, Stéphane; Machaalani, Roger; Huang, Guobin (01.11.2003). „Celková syntéza a strukturní potvrzení malayamycinu A: nová bicyklická látka C-Nukleosid ze Streptomyces malaysiensis “. Organické dopisy. 5 (23): 4277–4280. doi:10.1021 / ol030095k. ISSN 1523-7060. PMID 14601979.
- ^ Kuehne, Martin E .; Xu, Feng (01.12.1993). „Celková syntéza alkaloidů strychnanu a aspidospermatanu. 3. Celková syntéza (±) -strychninu“. The Journal of Organic Chemistry. 58 (26): 7490–7497. doi:10.1021 / jo00078a030. ISSN 0022-3263.
- ^ Cain, Christian M .; Cousins, Richard P. C .; Coumbarides, Greg; Simpkins, Nigel S. (01.01.1990). „Asymetrická deprotonace prochirálních ketonů za použití chirálních bází amidu lithného“. Čtyřstěn. 46 (2): 523–544. doi:10.1016 / S0040-4020 (01) 85435-1.
- ^ Zhou, Hao; Liao, Xuebin; Cook, James M. (01.01.2004). „Regiospecifická, enantiospecifická celková syntéza 12-alkoxysubstituovaných indolových alkaloidů, (+) - 12-methoxy-Na-methylvellosiminu, (+) - 12-methoxyafinisinu a (-) - fuchsiaefolinu". Organické dopisy. 6 (2): 249–252. doi:10.1021 / ol0362212. ISSN 1523-7060. PMID 14723540.
- ^ Rong, Yi; Al-Harbi, Ahmed; Parkin, Gerard (2012). „Vysoce variabilní vazebné úhly Zr – CH2 – Ph v tetrabenzylzirkoniu: analýza koordinačních režimů benzyl ligandu“. Organometallics. 31 (23): 8208–8217. doi:10.1021 / om300820b.
externí odkazy
 Chemický portál
Chemický portál Citace související s Benzylová skupina na Wikiquote
Citace související s Benzylová skupina na Wikiquote