Pyruvátdehydrogenáza - Pyruvate dehydrogenase
| pyruvátdehydrogenáza (přenášející acetyl) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Krystalografická struktura pyruvátdehydrogenázy (PDH). PH je dimenze šesti domén s oblastmi α (modrá), α '(žlutá), β (červená) a β' (zelenomodrá) označenými různými barvami. Thiaminpyrofosfát (TPP) je zobrazen ve formě šedé koule a tyčinky, dva ionty hořčíku ve fialové barvě podstupují ligaci kovů s TPP a dva ionty draslíku v oranžové barvě.[1] | |||||||||
| Identifikátory | |||||||||
| EC číslo | 1.2.4.1 | ||||||||
| Číslo CAS | 9014-20-4 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
Pyruvátdehydrogenáza je enzym který katalyzuje reakci pyruvátu a a lipoamid za vzniku acetylovaného dihydrolipoamidu a oxid uhličitý. Konverze vyžaduje koenzym thiamin pyrofosfát.
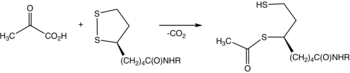
S pyruvátdehydrogenázou se obvykle setkáváme jako s komponentou, označovanou jako E1 komplex pyruvátdehydrogenázy (PDC). PDC se skládá z dalších enzymů označovaných jako E2 a E3. Souhrnně transformace E1-E3 pyruvát, NAD+, koenzym A do acetyl-CoA, CO2a NADH. Konverze je zásadní, protože acetyl-CoA může být poté použit v cyklus kyseliny citronové provést buněčné dýchání.[2]. K rozlišení mezi tímto enzymem a PDC se systematicky nazývá pyruvátdehydrogenáza (přenášející acetyl).
Mechanismus

Thiaminpyrofosfát (TPP) se převede na ylid deprotonací. Ylid napadá ketonovou skupinu pyruvátu. Výsledný adukt dekarboxyláty. Výsledný 1,3-dipol redukčně acetyláty lipoamid-E2.[2]
Pokud jde o podrobnosti, biochemické a strukturální údaje pro E1 odhalily mechanismus aktivace koenzymu TPP vytvořením konzervované vodíkové vazby s glutamátovým zbytkem (Glu59 v lidském E1) a zavedením V-konformace, která přináší atom N4 'aminopyrimidinu k intramolekulární vodíkové vazbě s thiazoliovým atomem C2. Tato jedinečná kombinace kontaktů a konformací TPP vede nakonec k tvorbě reaktivního C2-karbaniontu. Poté, co kofaktor TPP dekarboxyláty pyruvátu, acetylová část se stane hydroxyethylderivátem kovalentně připojeným k TPP.[1]
Struktura
E1 je multimerní protein. Savčí E1, včetně lidských E1, jsou tetramerní, složené ze dvou a- a dvou p-podjednotek.[1] Některé bakteriální E1, včetně E1 z Escherichia coli, se skládají ze dvou podobných podjednotek, z nichž každá je velká jako součet molekulových hmotností α- a β- podjednotek.[3]
.
Aktivní stránky
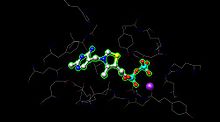
E1 má dvě katalytická místa, každé poskytuje thiamin pyrofosfát (TPP ) a iont hořčíku jako kofaktory. Α-podjednotka váže ionty hořčíku a pyrofosforečnanu, zatímco p-podjednotka váže pyrimidinový fragment TPP, tvořící společně katalytické místo na rozhraní podjednotek.[1]
The Aktivní stránky pro pyruvátdehydrogenázu (obrázek vytvořen z PDB: 1NI4) Drží TPP ligací kovů na ionty hořčíku (fialová koule) a vodíkovou vazbou na aminokyseliny. Zatímco v aktivním místě lze nalézt více než 20 aminokyselin, aminokyseliny Tyr 89, Arg 90, Gly 136, Val 138, Asp 167, Gly 168, Ala 169, Asn, 196 a His 263 se skutečně účastní vodíkových vazeb, které drží TPP a pyruvát (není zde zobrazen) na aktivním místě. Aminokyseliny jsou zobrazeny jako dráty a TPP je ve formě koule a tyčinky. Aktivní místo také pomáhá při přenosu acylu na TPP na lipoamid čekající na E2.[1]
Nařízení
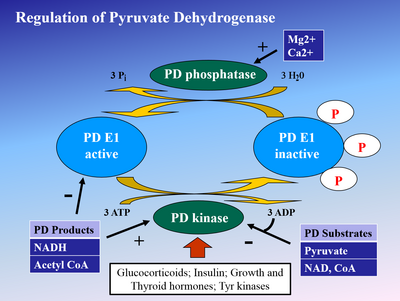
Fosforylace z E1 od pyruvátdehydrogenáza kináza (PDK) deaktivuje E1 a následně celý komplex. PDK je inhibován kyselina dichloroctová a pyruvát, což vede k vyššímu množství aktivního, nefosforylovaného PDH.[4] Fosforylaton je obrácen pyruvátdehydrogenáza fosfatáza, který je stimulován inzulín, ŘÍZ, a AMP, ale kompetitivně potlačen ATP, NADH, a Acetyl-CoA.
Patologie
Pyruvátdehydrogenáza je zaměřena na autoantigen známé jako anti-mitochondriální protilátky (AMA), což vede k progresivní destrukci malých žlučových cest jater, což vede k primární biliární cirhóza. Zdá se, že tyto protilátky rozpoznávají oxidovaný protein, který je výsledkem zánětlivých imunitních odpovědí. Některé z těchto zánětlivých reakcí mohou souviset citlivost na lepek protože více než 50% pacientů s akutním selháním jater v jedné studii vykazovalo a nonmitochondriální autoprotilátka proti tkáni transglutamináza.[5] Zahrnují další mitochondriální autoantigeny oxoglutarát dehydrogenáza a komplex alfa-ketokyseliny dehydrogenázy s rozvětveným řetězcem, což jsou antigeny rozpoznávané anti-mitochondriální protilátky.
Deficit pyruvátdehydrogenázy (PDH) je vrozené degenerativní metabolické onemocnění vyplývající z mutace komplexu pyruvátdehydrogenázy (PDC) umístěného na chromozomu X. Zatímco defekty byly identifikovány u všech 3 enzymů komplexu, podjednotka E1-α je převážně viníkem. Porucha cyklu kyseliny citronové v důsledku nedostatku PDH zbavuje tělo energie a vede k abnormálnímu hromadění laktátu. Nedostatek PDH je častou příčinou laktátové acidózy u novorozenců a často se projevuje těžkou letargií, špatnou výživou, tachypnoe a případy úmrtí.[6]
Příklady
Lidské proteiny, které mají aktivitu pyruvátdehydrogenázy, zahrnují:
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Související enzymy
v bakterie existuje forma pyruvátdehydrogenázy (nazývaná také pyruvát oxidáza, EC 1.2.2.2), která spojuje oxidaci pyruvátu na acetát a oxid uhličitý se snížením ferrocytochromu. v E-coli tento enzym je kódován neštovice B. gen a protein má flavinový kofaktor.[7] Tento enzym zvyšuje účinnost růstu E-coli za aerobních podmínek.[8]
Viz také
Reference
- ^ A b C d E PDB: 1ni4; Ciszak EM, Korotchkina LG, Dominiak PM, Sidhu S, Patel MS (červen 2003). „Strukturální základ pro klopný účinek thiamin-pyrofosfát-závislých enzymů odhalený lidskou pyruvátdehydrogenázou“. J. Biol. Chem. 278 (23): 21240–6. doi:10,1074 / jbc.M300339200. PMID 12651851.
- ^ A b J. M. Berg; J. L. Tymoczko, L. Stryer (2007). Biochemie (6. vyd.). Freemane. ISBN 978-0-7167-8724-2.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Arjunan P, Nemeria N, Brunskill A, Chandrasekhar K, Sax M, Yan Y a kol. (Duben 2002). "Struktura pyruvátdehydrogenázového multienzymového komplexu E1 složky z Escherichia coli při rozlišení 1,85 A". Biochemie. 41 (16): 5213–21. doi:10.1021 / bi0118557. PMID 11955070.
- ^ Jaimes, R 3. (červenec 2015). „Funkční odpověď izolovaného, perfundovaného normoxického srdce na aktivaci pyruvátdehydrogenázy pomocí dichloracetátu a pyruvátu“. Pflügers Arch. 468 (1): 131–42. doi:10.1007 / s00424-015-1717-1. PMC 4701640. PMID 26142699.
- ^ Leung PS, Rossaro L, Davis PA a kol. (2007). „Antimitochondriální protilátky při akutním selhání jater: důsledky pro primární biliární cirhózu“. Hepatologie. 46 (5): 1436–42. doi:10,1002 / hep. 21828. PMC 3731127. PMID 17657817.
- ^ Nedostatek komplexu pyruvátdehydrogenázy na eMedicína
- ^ Recny MA, Hager LP (1982). "Rekonstituce nativního Escherichia coli pyruvát oxidáza z apoenzymových monomerů a FAD ". J. Biol. Chem. 257 (21): 12878–86. PMID 6752142.
- ^ Abdel-Hamid AM, Attwood MM, host JR (2001). „Pyruvát oxidáza přispívá k účinnosti aerobního růstu Escherichia coli". Mikrobiologie. 147 (Pt 6): 1483–1498. doi:10.1099/00221287-147-6-1483. PMID 11390679.
- Ochoa S (1954). "Enzymové mechanismy v cyklu kyseliny citronové". Pokroky v enzymologii a souvisejících oblastech molekulární biologie. Pokroky v enzymologii a příbuzných předmětech biochemie. Pokroky v enzymologii a souvisejících oblastech molekulární biologie. 15. 183–270. doi:10.1002 / 9780470122600.ch5. ISBN 9780470122600. PMID 13158180.
- Scriba P, Holzer H (1961). „Gewinnung von alphaHydroxyathyl-2-thiaminpyrophosphat mit Pyruvatoxydase aus Schweineherzmuskel“. Biochem. Z. 334: 473–486.
- Perham RN (2000). "Kyvné ramena a kyvné domény v multifunkčních enzymech: katalytické stroje pro vícestupňové reakce". Roční přehled biochemie. 69 (1): 961–1004. doi:10.1146 / annurev.biochem.69.1.961. PMID 10966480.
externí odkazy
- Pyruvát + dehydrogenáza-E1 v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- http://www.brookscole.com/chemistry_d/templates/student_resources/shared_resources/animations/pdc/pdc.html
- PDBe-KB poskytuje přehled všech strukturních informací dostupných v PDB pro lidskou pyruvátdehydrogenázu (lipoamid) alfa 1.
- PDBe-KB poskytuje přehled všech strukturních informací dostupných v PDB pro beta verzi lidské pyruvátdehydrogenázy (lipoamid).
ATP ADP ATP ADP + + 2 ×  2 ×  2 × 3-fosfoglycerát 2 ×  2 × 2-fosfoglycerát 2 ×  2 × Fosfoenolpyruvát 2 ×  ADP ATP 2 × Pyruvát 2 × |





