Lysin - Lysine
 L-lysin | |
| Jména | |
|---|---|
| Název IUPAC (2S) -2,6-diaminohexanová kyselina (L-lysin) (2R) -2,6-diaminohexanová kyselina (D-lysin) | |
| Ostatní jména Lysin, D-lysin, L-lysin, LYS, h-Lys-OH | |
| Identifikátory | |
3D model (JSmol ) |
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.000.673 |
| KEGG | |
PubChem CID | |
| UNII | |
| |
| |
| Vlastnosti | |
| C6H14N2Ó2 | |
| Molární hmotnost | 146.190 g · mol−1 |
| 1,5 kg / l | |
| Farmakologie | |
| B05XB03 (SZO) | |
| Stránka s doplňkovými údaji | |
| Index lomu (n), Dielektrická konstanta (εr), atd. | |
Termodynamické data | Fázové chování pevná látka - kapalina - plyn |
| UV, IR, NMR, SLEČNA | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Lysin (symbol Lys nebo K.)[1] je a-aminokyselina který se používá při biosyntéze bílkoviny. Obsahuje α-aminoskupinu (která je v protonoval - NH3+ forma za biologických podmínek), skupina a-karboxylové kyseliny (která je v deprotonované -CO)− za biologických podmínek) a lysyl postranního řetězce ((CH2)4NH2), klasifikovat jej jako a základní, nabitý (při fyziologickém pH), alifatický aminokyselina. to je kódovaný podle kodony AAA a AAG. Stejně jako téměř všechny ostatní aminokyseliny je i-uhlík chirální a lysin může odkazovat se na jeden enantiomer nebo a racemická směs oba. Pro účely tohoto článku bude lysin označovat biologicky aktivní enantiomer L-lysin, kde a-uhlík je v S konfiguraci.
Lidské tělo nedokáže syntetizovat lysin. to je nezbytné u lidí a musí být získány ze stravy. V organismech, které syntetizují lysin, má dva hlavní biosyntetické dráhy, diaminopimelát a a-aminoadipát cesty, které používají odlišné enzymy a substráty a nacházejí se v různých organismech. Lysin katabolismus dochází jednou z několika cest, z nichž nejběžnější je sacharopinová dráha.
Lysin hraje v lidech několik rolí, co je nejdůležitější proteinogeneze, ale také při síťování kolagen polypeptidy, příjem základních minerálních živin a při výrobě karnitin, což je klíčové metabolismus mastných kyselin. Lysin je také často zapojen do histonové modifikace, a tím má dopad na epigenom. The ε -amino skupina se často účastní vodíkových vazeb a jako obecná báze v katalýza. Ε-amonný skupina (NH3+) je navázán na čtvrtý uhlík z a-uhlíku, který je navázán na karboxylovou (C = OOH) skupinu.[2]
Vzhledem k jeho důležitosti v několika biologických procesech může nedostatek lysinu vést k několika chorobným stavům, včetně vadných pojivových tkání, zhoršeného metabolismu mastných kyselin, anémie a systémového deficitu proteinové energie. Naproti tomu nadměrné množství lysinu způsobené neúčinným katabolismem může způsobit vážné následky neurologické poruchy.
Lysin byl poprvé izolován německým biologickým chemikem Ferdinandem Heinrichem Edmundem Drechselem v roce 1889 z proteinu kasein v mléce.[3] Pojmenoval to "lysin".[4] V roce 1902 němečtí chemici Emil Fischer a Fritz Weigert určil chemickou strukturu lysinu jeho syntézou.[5]
Biosyntéza

V přírodě byly pro syntézu lysinu identifikovány dvě cesty. The diaminopimelát (DAP) patří do aspartát odvozená biosyntetická rodina, která se také podílí na syntéze threonin, methionin a isoleucin.[6][7] Vzhledem k tomu, že dráha α-aminoadipátu (AAA) je součástí glutamát biosyntetická rodina.[8][9]
DAP cesta se nachází v obou prokaryoty a rostliny a začíná s dihydrodipikolinát syntáza (DHDPS) (E.C 4.3.3.7) katalyzovaný kondenzační reakce mezi odvozeným aspartátem, L-aspartate semialdehyde, a pyruvát tvořit (4S) -4-hydroxy-2,3,4,5-tetrahydro- (2S) -dipikolinová kyselina (HTPA).[10][11][12][13][14] Produkt je tedy snížena podle dihydrodipikolinát reduktáza (DHDPR) (E.C. 1.3.1.26), s NAD (P) H jako donor protonu, čímž se získá 2,3,4,5-tetrahydrodipikolinát (THDP).[15] Od tohoto okamžiku byly nalezeny čtyři varianty drah, a to cesty acetylázy, aminotransferázy, dehydrogenázy a sukcinylázy.[6][16] Cesty varianty acetylázy i sukcinylázy používají čtyři enzym katalyzované kroky, aminotransferázová dráha používá dva enzymy a dehydrogenázová dráha používá jediný enzym.[17] Tyto čtyři varianty cest se sbíhají při tvorbě předposledního produktu, mezo–Diaminopimelate, který je následně enzymaticky dekarboxylovaný v nevratné reakci katalyzované diaminopimelát dekarboxyláza (DAPDC) (E.C 4.1.1.20) k výrobě L-lysin.[18][19] DAP dráha je regulována na několika úrovních, včetně upstream u enzymů zapojených do zpracování aspartátu, stejně jako v počátečním kroku kondenzace katalyzované DHDPS.[19][20] Lysin dodává silnou látku negativní zpětná vazba smyčka na těchto enzymech a následně reguluje celou cestu.[20]
Cesta AAA zahrnuje kondenzaci α-ketoglutarát a acetyl-CoA prostřednictvím meziproduktu AAA pro syntézu L-lysin. Ukázalo se, že tato cesta je přítomna v několika droždí druhů, jakož i protistů a vyšších hub.[9][21][22][23][24][25][26] Rovněž bylo hlášeno, že v roce byla nalezena alternativní varianta cesty AAA Thermus thermophilus a Pyrococcus horikoshii, což by mohlo naznačovat, že tato cesta je u prokaryot rozšířena více, než se původně navrhovalo.[27][28][29] První a krok omezující rychlost v dráze AAA je kondenzační reakce mezi acetyl-CoA a α-ketoglutarátem katalyzovaná homocitrát-syntáza (HCS) (E.C 2.3.3.14), čímž se získá meziprodukt homocitryl-CoA, který je hydrolyzovaný produkovaný stejným enzymem homocitrát.[30] Homocitrát je enzymaticky dehydratovaný podle homoakonitáza (HAc) (E.C. 4.2.1.36) cis-homoaconitate.[31] HAc poté katalyzuje druhou reakci, při které cis-homoaconitate podstoupí rehydratace k výrobě homoisocitrát.[9] Výsledný produkt prochází oxidační dekarboxylace pomocí homoisocitrate dehydrogenase (HIDH) (E.C 1.1.1.87), čímž se získá α-ketoadipát.[9] AAA se poté vytvoří pomocí a pyridoxal 5'-fosfát (PLP) -závislý aminotransferáza (PLP-AT) (E.C 2.6.1.39), s použitím glutamátu jako dárce aminoskupiny.[30] Od tohoto okamžiku se cesta AAA liší podle [něco zde chybí? -> přinejmenším záhlaví sekce! ] o království. U hub je AAA redukována na α ‑ aminoadipát-semialdehyd pomocí AAA reduktázy (E.C 1.2.1.95) v jedinečném procesu zahrnujícím jak adenylace a redukce, která je aktivována a fosfopantetheinyl transferáza (E.C. 2.7.8.7).[9] Jakmile se vytvoří semialdehyd, sacharopin reduktáza (E.C 1.5.1.10) katalyzuje kondenzační reakci s glutamátem a NAD (P) H jako donorem protonu a já těžím se redukuje na produkci předposledního produktu, sacharopinu.[29] Poslední krok cesty v houbách zahrnuje sacharopin dehydrogenáza (SDH) (E.C 1.5.1.8) katalyzovaný oxidační deaminace sacharopinu, což má za následek L-lysin.[9] Ve variantě AAA dráhy nalezené u některých prokaryot je AAA nejprve převedena na N–Acetyl-α-aminoadipát, což je fosforylovaný a pak reduktivně defosforylovaný na ε-aldehyd.[29][30] Aldehyd je tedy transaminovaný na N–Acetyl-lysin, který je deacetylován za vzniku L-lysin.[29][30] Enzymy podílející se na této variantní cestě však vyžadují další validaci.
Katabolismus
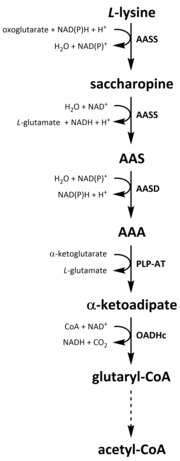
Jako všechny aminokyseliny, katabolismus lysinu se iniciuje z příjmu lysinu v potravě nebo z rozkladu lysinu intracelulární protein. Katabolismus se také používá jako prostředek k řízení intracelulární koncentrace volného lysinu a udržování a ustálený stav k prevenci toxických účinků nadměrného volného lysinu.[32] Existuje několik cest zapojených do katabolismu lysinu, ale nejčastěji používanou cestou je sacharopin, který primárně probíhá v játra (a ekvivalentní orgány) u zvířat, konkrétně v rámci mitochondrie.[33][32][34][35] Toto je opak výše popsané dráhy AAA.[33][36] U zvířat a rostlin jsou první dva kroky sacharopinové dráhy katalyzovány bifunkčním enzymem, α-aminoadipová semialdehyd syntáza (AASS), které mají jak aktivity lysin-ketoglutarát reduktázy (LKR) (E.C 1.5.1.8), tak SDH, zatímco v jiných organismech, jako jsou bakterie a houby, jsou oba tyto enzymy kódovány samostatnými geny.[37][38] První krok zahrnuje redukci katalyzovanou LKR L-lysin v přítomnosti a-ketoglutarátu za vzniku sacharopinu, přičemž NAD (P) H působí jako donor protonu.[39] Saccharopin poté podstoupí dehydratační reakci, katalyzovanou SDH v přítomnosti NAD+, k výrobě AAS a glutamátu.[40] AAS dehydrogenáza (AASD) (E.C 1.2.1.31) pak dále dehydratuje molekulu na AAA.[39] Následně PLP-AT katalyzuje reverzní reakci na reakci biosyntetické dráhy AAA, což vede k převodu AAA na a-ketoadipát. Produkt, α-ketoadipát, je dekarboxylován v přítomnosti NAD+ a koenzym A, čímž se získá glutaryl-CoA, avšak enzym, který se na tom podílí, ještě není zcela objasněn.[41][42] Některé důkazy naznačují, že komplex 2-oxoadipát dehydrogenázy (OADHc), který je strukturně homologní s podjednotkou E1 komplex oxoglutarát dehydrogenázy (OGDHc) (E.C 1.2.4.2), je odpovědný za dekarboxylační reakci.[41][43] Nakonec je glutaryl-CoA oxidačně dekarboxylován na krotony-CoA pomocí glutaryl-CoA dehydrogenáza (E.C 1.3.8.6), který se dále zpracovává několika enzymatickými kroky, čímž se získá acetyl-CoA; základní uhlík metabolit podílí se na cyklus trikarboxylové kyseliny (TCA).[39][44][45][46]
Nutriční hodnota
Lysin je jednou z devíti esenciálních aminokyselin u lidí.[47] Potřeba výživy člověka se pohybuje od ~ 60 mg · kg−1· D−1 v kojeneckém věku do ~ 30 mg · kg−1· D−1 u dospělých.[33] Tento požadavek je běžně splněn v a západní společnost s příjmem lysin z masa a zeleniny výrazně nad doporučený požadavek.[33] Ve vegetariánské stravě je příjem lysinu menší kvůli omezujícímu množství lysinu v něm obilniny ve srovnání se zdroji masa.[33]
Vzhledem k omezující koncentraci lysinu v obilninových plodinách se již dlouho spekulovalo, že obsah lysinu lze zvýšit prostřednictvím genetická úprava praktik.[48][49] Tyto praktiky často zahrnovaly záměrnou dysregulaci DAP dráhy zavedením necitlivé na zpětnou vazbu lysinu ortology enzymu DHDPS.[48][49] Tyto metody se setkaly s omezeným úspěchem pravděpodobně kvůli toxický vedlejší účinky zvýšeného volného lysinu a nepřímé účinky na TCA cyklus.[50] Rostliny akumulují lysin a další aminokyseliny ve formě semen zásobní proteiny, který se nachází v semenech rostliny, a to představuje jedlou složku obilnin.[51] To zdůrazňuje potřebu nejen zvýšit volný lysin, ale také nasměrovat lysin k syntéze stabilních proteinů pro skladování semen a následně zvýšit nutriční hodnotu konzumovatelné složky plodin.[52][53] Zatímco postupy genetické modifikace se setkaly s omezeným úspěchem, tradičnějším šlechtění techniky umožnily izolaci „Kvalitní proteinová kukuřice ", který významně zvýšil hladinu lysinu a tryptofan, také esenciální aminokyselina. Toto zvýšení obsahu lysinu se připisuje neprůhledný-2 mutace, která snížila transkripce nedostatek lysinu zein související proteiny pro skladování semen a ve výsledku zvýšily hojnost dalších proteinů, které jsou bohaté na lysin.[53][54] Běžně překonat omezující množství lysinu v hospodářská zvířata krmivo, přidává se průmyslově vyráběný lysin.[55][56] Průmyslový proces zahrnuje fermentační kultivace Corynebacterium glutamicum a následné čištění lysinu.[55]
Zdroje stravy
Dobrým zdrojem lysinu jsou potraviny s vysokým obsahem bílkovin, jako jsou vejce, maso (zejména červené maso, jehněčí, vepřové a drůbeží maso), sója, fazole a hrášek, sýr (zejména parmezán) a některé ryby (např treska a sardinky ).[57] Lysin je omezující aminokyselina (esenciální aminokyselina nalezená v nejmenším množství v konkrétní potravině) ve většině obilná zrna, ale ve většině je hojný pulzy (luštěniny).[58] Vegetariánská strava nebo strava s nízkým obsahem živočišných bílkovin může být dostatečná pro bílkoviny, včetně lysinu, pokud obsahuje jak obilná zrna, tak luštěniny, ale není nutné, aby byly tyto dvě skupiny potravin konzumovány ve stejných jídlech.
Za potravinu se považuje dostatek lysinu, pokud obsahuje alespoň 51 mg lysinu na gram bílkoviny (takže bílkovina je 5,1% lysinu).[59] L-lysin HCl se používá jako a doplněk stravy, poskytující 80,03% L-lysinu.[60] Jako takový je 1 g L-lysinu obsažen v 1,25 g L-lysinu HCl.
| Jídlo | Lysin (% bílkovin) |
|---|---|
| Ryba | 9.19% |
| Hovězí maso, mleté, 90% libové / 10% tuku, vařené | 8.31% |
| Kuře, pražení, maso a kůže, vařené, pečené | 8.11% |
| Azuki fazole (fazole adzuki), zralá semena, surová | 7.53% |
| Mléko, bez tuku | 7.48% |
| Sójové boby, zralá semena, surová | 7.42% |
| Vejce, celé, syrové | 7.27% |
| Hrášek, rozdělená, zralá semena, surová | 7.22% |
| Čočka, růžový, syrový | 6.97% |
| Fazole, zralá semena, surová | 6.87% |
| Cizrna, (fazole garbanzo, bengálský gram), zralá semena, surová | 6.69% |
| Navy fazole, zralá semena, surová | 5.73% |
Biologické role
Nejběžnější rolí lysinu je proteinogeneze. Lysin často hraje důležitou roli v proteinová struktura. Protože jeho boční řetězec obsahuje kladně nabitou skupinu na jednom konci a dlouhou hydrofobní uhlíkový ocas v blízkosti páteře, lysin je považován za něco amfipatický. Z tohoto důvodu lze lysin nalézt pohřbený i častěji v kanálech rozpouštědel a na vnější straně proteinů, kde může interagovat s vodným prostředím.[61] Lysin může také přispívat ke stabilitě proteinu, protože jeho ε-aminoskupina se často účastní vodíkové vazby, solné mosty a kovalentní interakce za vzniku a Schiffova základna.[61][62][63][64]
Druhá hlavní role lysinu je v epigenetický regulace prostřednictvím histon modifikace.[65][66] Existuje několik typů kovalentních histonových modifikací, které obvykle zahrnují lysinové zbytky nacházející se v vyčnívajícím ocasu histonů. Úpravy často zahrnují přidání nebo odebrání souboru acetyl (-CH3CO) tváření acetyllysin nebo návrat k lysinu, až tři methyl (-CH3), ubikvitin nebo a sumo protein skupina.[65][67][68][69][70] Různé úpravy mají následné účinky na genová regulace, ve kterých lze aktivovat nebo potlačovat geny.
Lysin také hraje klíčovou roli v dalších biologických procesech včetně; strukturní proteiny pojivové tkáně, vápník homeostáza, a metabolismus mastných kyselin.[71][72][73] Bylo prokázáno, že lysin je zapojen do síťování mezi těmi třemi spirálovité polypeptidy v kolagen, což má za následek jeho stabilitu a pevnost v tahu.[71][74] Tento mechanismus je podobný roli lysinu v bakteriální buněčné stěny, ve kterém lysin (a mezo-diaminopimelát) jsou rozhodující pro tvorbu zesíťování, a tedy stability buněčné stěny.[75] Tento koncept byl dříve zkoumán jako prostředek k obcházení potenciálního nechtěného uvolnění patogenní geneticky modifikované bakterie. Bylo navrženo, aby auxotrofní kmen Escherichia coli (X1776) lze použít pro všechny postupy genetické modifikace, protože kmen není schopen přežít bez doplnění DAP, a proto nemůže žít mimo laboratorní prostředí.[76] Bylo také navrženo, aby se lysin podílel na absorpci vápníku ve střevě a na retenci ledvin, a proto může hrát roli v homeostáza vápníku.[72] Nakonec se ukázalo, že lysin je předchůdcem karnitin, který transportuje mastné kyseliny do mitochondrie, kde mohou být oxidovány za účelem uvolnění energie.[73][77] Karnitin je syntetizován z trimethyllysin, který je produktem odbourávání určitých proteinů, protože takový lysin musí být nejprve inkorporován do proteinů a před převedením na karnitin musí být methylován.[73] U savců je však primárním zdrojem karnitinu spíše zdroj potravy, než přeměna lysinu.[73]
v opsiny jako rhodopsin a vizuální opsiny (kódované geny OPN1SW, OPN1MW, a OPN1LW ), retinaldehyd tvoří a Schiffova základna se zachovaným zbytkem lysinu a interakcí světla s retinyliden skupina způsobí přenos signálu v barevné vidění (Vidět vizuální cyklus pro detaily).
Sporné role
Probíhá dlouhá diskuse, že lysin, pokud se podává intravenózně nebo orálně, může významně zvýšit uvolňování růstové hormony.[78] To vedlo k tomu, že sportovci používají lysin jako prostředek k podpoře růstu svalů při tréninku, dosud však nebyly nalezeny žádné významné důkazy na podporu této aplikace lysinu.[78][79]
Protože virus herpes simplex (HSV) proteiny jsou bohatší na arginin a chudší na lysin než buňky, které infikují, lysinové doplňky byly vyzkoušeny jako léčba. Vzhledem k tomu, že tyto dvě aminokyseliny jsou přijímány ve střevě, regenerovány v ledvinách a stejné do buněk transportéry aminokyselin, nadbytek lysinu by teoreticky omezil množství argininu dostupného pro replikaci viru.[80] Klinické studie neposkytují dobré důkazy o účinnosti jako a profylaktický nebo při léčbě ohnisek HSV.[81][82] V reakci na tvrzení o produktu, že lysin by mohl zlepšit imunitní reakce na HSV, přezkoumání Evropský úřad pro bezpečnost potravin nenašel žádný důkaz vztahu příčina-účinek. Stejný přehled, publikovaný v roce 2011, nenalezl žádné důkazy na podporu tvrzení, že lysin by mohl snížit hladinu cholesterolu, zvýšit chuť k jídlu, přispět k syntéze bílkovin v jakékoli jiné roli než jako běžná živina nebo zvýšit absorpci nebo retenci vápníku.[83]
Role v nemoci
Nemoci související s lysinem jsou výsledkem následného zpracování lysinu, tj. Inkorporace do proteinů nebo modifikace do alternativních biomolekul. Úloha lysinu v kolagenu byla naznačena výše, nicméně nedostatek lysinu a hydroxylysin účastnící se zesítění kolagenových peptidů byla spojena s chorobným stavem pojivové tkáně.[84] Vzhledem k tomu, že karnitin je klíčovým metabolitem odvozeným od lysinu, který se podílí na metabolismu mastných kyselin, může nestandardní strava postrádající dostatek karnitinu a lysinu vést ke snížení hladiny karnitinu, což může mít významné kaskádové účinky na zdraví jedince.[77][85] Bylo také prokázáno, že v nich hraje roli lysin anémie, protože existuje podezření, že lysin má vliv na absorpci žehlička a následně koncentrace feritin v krevní plazma.[86] Přesný mechanismus účinku je však ještě třeba objasnit.[86] Nejčastěji je nedostatek lysinu pozorován v nezápadních společnostech a projevuje se jako protein-energetická podvýživa, který má hluboké a systémové účinky na zdraví jedince.[87][88] Je tam také dědičný genetické onemocnění, které zahrnuje mutace v enzymech odpovědných za katabolismus lysinu, jmenovitě bifunkční enzym AASS sacharidové dráhy.[89] V důsledku nedostatku katabolismu lysinu se aminokyselina hromadí v plazmě a dochází k rozvoji pacientů hyperlysinémie, které se mohou projevovat jako asymptomatické až závažné neurologická postižení, počítaje v to epilepsie, ataxie, spasticita, a psychomotorické poškození.[89][90] Klinický význam hyperlysinemie je předmětem debaty v této oblasti, přičemž některé studie nezjistily žádnou korelaci mezi tělesným nebo mentálním postižením a hyperlysinemií.[91] Kromě toho byly mutace v genech souvisejících s metabolizmem lysinu zahrnuty v několika chorobných stavech, včetně pyridoxin-dependentní epilepsie (Gen ALDH7A1 ), a-ketoadipová a a-aminoadipová acidurie (Gen DHTKD1 ), a glutarová acidurie typu 1 (Gen GCDH ).[41][92][93][94][95]
Hyperlysinurie se vyznačuje vysokým množstvím lysinu v moči.[96] Je to často způsobeno a metabolické onemocnění ve kterém a protein podílející se na rozkladu lysinu je nefunkční kvůli genetické mutaci.[97] Může také nastat v důsledku poruchy ledvin trubková doprava.[97]
Použití lysinu v krmivech pro zvířata
Produkce lysinu pro krmení zvířat je významným světovým průmyslovým odvětvím a v roce 2009 dosáhla téměř 700 000 tun při tržní hodnotě přes 1,22 miliardy EUR.[98] Lysin je důležitou přísadou do krmiv pro zvířata, protože je omezující aminokyselinou při optimalizaci růstu určitých zvířat, jako jsou prasata a kuřata, pro produkci masa. Suplementace lysinem umožňuje použití levnějších rostlinných bílkovin (například kukuřice, spíše než) sója ) při zachování vysokých rychlostí růstu a omezení znečištění z vylučování dusíku.[99] Na druhé straně je však znečištění fosfáty významnými environmentálními náklady, když se kukuřice používá jako krmivo pro drůbež a prasata.[100]
Lysin se průmyslově vyrábí mikrobiální fermentací, zejména na bázi cukru. Výzkum genetického inženýrství aktivně sleduje bakteriální kmeny, aby zlepšil efektivitu produkce a umožnil výrobu lysinu z jiných substrátů.[98]
V populární kultuře
Film z roku 1993 Jurský park (na základě 1990 Michael Crichton román stejného jména ) funkce dinosauři kteří byli geneticky pozměněno aby nemohli produkovat lysin, příklad inženýrství auxotrofie.[101] Toto bylo známé jako „pohotovost pro lysin“ a mělo to zabránit naklonovaný dinosauři přežili mimo park a nutili je, aby byli závislí na lysinových doplňcích poskytovaných veterinářem parku. Ve skutečnosti žádná zvířata nejsou schopna produkovat lysin (je to esenciální aminokyselina ).[102]
V roce 1996 se lysin stal středem a cena-stanovení případ, největší v historii Spojených států. The Archer Daniels Midland Company zaplatil pokutu ve výši 100 milionů USD a tři z jeho vedoucích pracovníků byli odsouzeni a byli odsouzeni do vězení. Viny v případě stanovení cen byly uznány vinnými také dvě japonské firmy (Ajinomoto Kyowa Hakko) a jihokorejská firma (Sewon).[103] Tajné videozáznamy spiklenců, kteří určují cenu lysinu, lze najít online nebo na videu od amerického ministerstva spravedlnosti, protimonopolní divize. Tento případ sloužil jako základ filmu Informátor! a kniha stejného titulu.[104]
Reference
![]() Tento článek byl upraven z následujícího zdroje pod a CC BY 4.0 licence (2018 ) (zprávy recenzenta ): "Lysin: biosyntéza, katabolismus a role" (PDF), WikiJournal of Science, 1 (1): 4, 1. června 2018, doi:10.15347 / WJS / 2018.004, ISSN 2470-6345, Wikidata Q55120301
Tento článek byl upraven z následujícího zdroje pod a CC BY 4.0 licence (2018 ) (zprávy recenzenta ): "Lysin: biosyntéza, katabolismus a role" (PDF), WikiJournal of Science, 1 (1): 4, 1. června 2018, doi:10.15347 / WJS / 2018.004, ISSN 2470-6345, Wikidata Q55120301
- ^ „Smíšená komise IUPAC-IUB pro biochemickou nomenklaturu (JCBN). Nomenklatura a symbolika pro aminokyseliny a peptidy. Doporučení 1983“. Biochemical Journal. 219 (2): 345–373. 15.dubna 1984. doi:10.1042 / bj2190345. PMC 1153490. PMID 6743224.
- ^ Lysin. Projekt biologie, Katedra biochemie a molekulární biofyziky, Arizonská univerzita.
- ^ Drechsel E (1889). „Zur Kenntniss der Spaltungsprodukte des Caseïns“ [[Příspěvek] k [naší] znalosti produktů štěpení kaseinu]. Journal für Praktische Chemie. 2. série (v němčině). 39: 425–429. doi:10.1002 / prac.18890390135. Na str. 428, Drechsel představil empirický vzorec pro chloroplatinátovou sůl lysinu - C8H16N2Ó2Cl2• PtCl4 + H2O - ale později připustil, že tento vzorec byl špatný, protože krystaly soli obsahovaly místo vody ethanol. Vidět: Drechsel E (1891). „Der Abbau der Eiweissstoffe“ [Demontáž proteinů]. Archiv pro anatomii a fyziologii (v němčině): 248–278.; Drechsel E. „Zur Kenntniss der Spaltungsproducte des Caseïns“ [Příspěvek] k [našim] znalostem produktů štěpení kaseinu] (v němčině): 254–260.
Od p. 256:] „… Umírá darhal enthaltene Base hat die Formel C.6H14N2Ó2. Der anfängliche Irrthum ist dadurch veranlasst worden, dass das Chloroplatinat nicht, wie angenommen ward, Krystallwasser, sondern Krystallalkohol enthält,… " (... základna, která je v něm obsažena, má [empirický] vzorec C6H14N2Ó2. Počáteční chyba byla způsobena tím, že chloroplatinát neobsahoval v krystalu vodu (jak se předpokládalo), ale ethanol…)
Citovat deník vyžaduje| deník =(Pomoc) - ^ Drechsel E (1891). „Der Abbau der Eiweissstoffe“ [Demontáž proteinů]. Archiv pro anatomii a fyziologii (v němčině): 248–278.; Fischer E (1891). „Ueber neue Spaltungsproducte des Leimes“ [O nových štěpných produktech želatiny] (v němčině): 465–469.
Od p. 469:] „… Zemřít základna C.6H14N2Ó2, welche mit dem Namen Lysin bezeichnet werden mag,… " (... základna C.6H14N2Ó2, které lze označit názvem „lysin“,…) [Poznámka: Ernst Fischer byl postgraduálním studentem Drechsela.]
Citovat deník vyžaduje| deník =(Pomoc) - ^ Fischer E, Weigert F (1902). „Synthese der α, ε - Diaminocapronsäure (Inactives Lysin)“ [Syntéza kyseliny α, ε-diaminohexanové ([opticky] neaktivní lysin]]. Berichte der Deutschen Chemischen Gesellschaft (v němčině). 35 (3): 3772–3778. doi:10,1002 / cber.190203503211.
- ^ A b Hudson AO, Bless C, Macedo P, Chatterjee SP, Singh BK, Gilvarg C, Leustek T (leden 2005). "Biosyntéza lysinu v rostlinách: důkazy o variantě známých bakteriálních drah". Biochimica et Biophysica Acta (BBA) - Obecné předměty. 1721 (1–3): 27–36. doi:10.1016 / j.bbagen.2004.09.008. PMID 15652176.
- ^ Velasco AM, Leguina JI, Lazcano A (říjen 2002). "Molekulární vývoj biosyntetických drah lysinu". Journal of Molecular Evolution. 55 (4): 445–59. doi:10.1007 / s00239-002-2340-2. PMID 12355264.
- ^ Miyazaki T, Miyazaki J, Yamane H, Nishiyama M (červenec 2004). „alfa-aminoadipátaminotransferáza z extrémně teplomilné bakterie, Thermus thermophilus“ (PDF). Mikrobiologie. 150 (Pt 7): 2327–34. doi:10,1099 / mic. 0,27037-0. PMID 15256574.
- ^ A b C d E F Xu H, Andi B, Qian J, West AH, Cook PF (2006). „Alfa-aminoadipátová cesta pro biosyntézu lysinu v houbách“. Buněčná biochemie a biofyzika. 46 (1): 43–64. doi:10,1385 / CBB: 46: 1: 43. PMID 16943623.
- ^ Atkinson SC, Dogovski C, Downton MT, Czabotar PE, Dobson RC, Gerrard JA, Wagner J, Perugini MA (březen 2013). „Strukturální, kinetické a výpočetní vyšetření DHDPS z Vitis vinifera odhaluje nový pohled na mechanismus alysterické inhibice zprostředkované lysinem“. Molekulární biologie rostlin. 81 (4–5): 431–46. doi:10.1007 / s11103-013-0014-7. PMID 23354837.
- ^ Griffin MD, Billakanti JM, Wason A, Keller S, Mertens HD, Atkinson SC, Dobson RC, Perugini MA, Gerrard JA, Pearce FG (2012). „Charakterizace prvních enzymů vázaných na biosyntézu lysinu v Arabidopsis thaliana“. PLOS ONE. 7 (7): e40318. doi:10.1371 / journal.pone.0040318. PMC 3390394. PMID 22792278.
- ^ Soares da Costa TP, Muscroft-Taylor AC, Dobson RC, Devenish SR, Jameson GB, Gerrard JA (červenec 2010). "Jak zásadní je 'základní' lysin v aktivním místě v dihydrodipikolinát syntáze?". Biochimie. 92 (7): 837–45. doi:10.1016 / j.biochi.2010.03.004. PMID 20353808.
- ^ Soares da Costa TP, Christensen JB, Desbois S, Gordon SE, Gupta R, Hogan CJ, Nelson TG, Downton MT, Gardhi CK, Abbott BM, Wagner J, Panjikar S, Perugini MA (2015). "Kvartérní strukturní analýzy esenciálního oligomerního enzymu". Analytická ultracentrifugace. Metody v enzymologii. 562. str. 205–23. doi:10.1016 / bs.mie.2015.06.020. ISBN 9780128029084. PMID 26412653.
- ^ Muscroft-Taylor AC, Soares da Costa TP, Gerrard JA (březen 2010). „Nové poznatky o mechanismu dihydrodipikolinát syntázy pomocí izotermické titrační kalorimetrie“. Biochimie. 92 (3): 254–62. doi:10.1016 / j.biochi.2009.12.004. PMID 20025926.
- ^ Christensen JB, Soares da Costa TP, Faou P, Pearce FG, Panjikar S, Perugini MA (listopad 2016). "Struktura a funkce sinic DHDPS a DHDPR". Vědecké zprávy. 6 (1): 37111. doi:10.1038 / srep37111. PMC 5109050. PMID 27845445.
- ^ McCoy AJ, Adams NE, Hudson AO, Gilvarg C, Leustek T, Maurelli AT (listopad 2006). „L, L-diaminopimelát aminotransferáza, enzym trans-království sdílený Chlamydií a rostlinami pro syntézu diaminopimelátu / lysinu“. Sborník Národní akademie věd Spojených států amerických. 103 (47): 17909–14. doi:10.1073 / pnas.0608643103. PMC 1693846. PMID 17093042.
- ^ Hudson AO, Gilvarg C, Leustek T (květen 2008). „Biochemická a fylogenetická charakterizace nové dráhy biosyntézy diaminopimelátu u prokaryot identifikuje odlišnou formu LL-diaminopimelátaminotransferázy.“. Journal of Bacteriology. 190 (9): 3256–63. doi:10.1128 / jb.01381-07. PMC 2347407. PMID 18310350.
- ^ Peverelli MG, Perugini MA (srpen 2015). "Optimalizovaný vázaný test pro kvantifikaci aktivity diaminopimelát dekarboxylázy". Biochimie. 115: 78–85. doi:10.1016 / j.biochi.2015.05.004. PMID 25986217.
- ^ A b Soares da Costa TP, Desbois S, Dogovski C, Gorman MA, Ketaren NE, Paxman JJ, Siddiqui T, Zammit LM, Abbott BM, Robins-Browne RM, Parker MW, Jameson GB, Hall NE, Panjikar S, Perugini MA (srpen 2016). „Strukturální determinanty definující alosterickou inhibici základního cíle antibiotika“. Struktura. 24 (8): 1282–1291. doi:10.1016 / j.str.2016.05.019. PMID 27427481.
- ^ A b Jander G, Joshi V (1. ledna 2009). „Biosyntéza aminokyselin odvozených od aspartátu v Arabidopsis thaliana“. Kniha Arabidopsis. 7: e0121. doi:10.1199 / tab.0121. PMC 3243338. PMID 22303247.
- ^ Andi B, West AH, Cook PF (září 2004). "Kinetický mechanismus histidinem značené homocitrát syntázy ze Saccharomyces cerevisiae". Biochemie. 43 (37): 11790–5. doi:10.1021 / bi048766p. PMID 15362863.
- ^ Bhattacharjee JK (1985). „alfa-aminoadipátová cesta pro biosyntézu lysinu u nižších eukaryot“. Kritické recenze v mikrobiologii. 12 (2): 131–51. doi:10.3109/10408418509104427. PMID 3928261.
- ^ Bhattacharjee JK, Strassman M (květen 1967). "Akumulace trikarboxylových kyselin souvisejících s biosyntézou lysinu u kvasinkového mutanta". The Journal of Biological Chemistry. 242 (10): 2542–6. PMID 6026248.
- ^ Gaillardin CM, Ribet AM, Heslot H (listopad 1982). "Divoký typ a mutantní formy homoisocitrické dehydrogenázy v kvasinkách Saccharomycopsis lipolytica". European Journal of Biochemistry. 128 (2–3): 489–94. doi:10.1111 / j.1432-1033.1982.tb06991.x. PMID 6759120.
- ^ Jaklitsch WM, Kubicek CP (červenec 1990). „Homocitrát syntáza z Penicillium chrysogenum. Lokalizace, čištění cytosolického izoenzymu a citlivost na lysin“. The Biochemical Journal. 269 (1): 247–53. doi:10.1042 / bj2690247. PMC 1131560. PMID 2115771.
- ^ Ye ZH, Bhattacharjee JK (prosinec 1988). "Dráha biosyntézy lysinu a biochemické bloky lysinových auxotrofů Schizosaccharomyces pombe". Journal of Bacteriology. 170 (12): 5968–70. doi:10.1128 / jb.170.12.5968-5970.1988. PMC 211717. PMID 3142867.
- ^ Kobashi N, Nishiyama M, Tanokura M (březen 1999). „Syntéza lysinu nezávislá na aspartátkináze v extrémně termofilní bakterii, Thermus thermophilus: lysin je syntetizován prostřednictvím kyseliny alfa-aminoadipové, nikoli prostřednictvím kyseliny diaminopimelické“. Journal of Bacteriology. 181 (6): 1713–8. doi:10.1128 / JB.181.6.1713-1718.1999. PMC 93567. PMID 10074061.
- ^ Kosuge T, Hoshino T (1999). „Alfa-aminoadipátová dráha pro biosyntézu lysinu je široce distribuována mezi kmeny Thermus“. Journal of Bioscience and Bioengineering. 88 (6): 672–5. doi:10.1016 / S1389-1723 (00) 87099-1. PMID 16232683.
- ^ A b C d Nishida H, Nishiyama M, Kobashi N, Kosuge T, Hoshino T, Yamane H (prosinec 1999). „Prokaryotický genový klastr podílející se na syntéze lysinu prostřednictvím aminoadipátové dráhy: klíč k vývoji biosyntézy aminokyselin“. Výzkum genomu. 9 (12): 1175–83. doi:10,1101 / gr. 9.12.1175. PMID 10613839.
- ^ A b C d Nishida H, Nishiyama M (září 2000). "Co je charakteristické pro syntézu houbového lysinu cestou alfa-aminoadipátu?". Journal of Molecular Evolution. 51 (3): 299–302. doi:10,1007 / s002390010091. PMID 11029074.
- ^ Zabriskie TM, Jackson MD (únor 2000). "Biosyntéza lysinu a metabolismus v houbách". Zprávy o přírodních produktech. 17 (1): 85–97. doi:10.1039 / a801345d. PMID 10714900.
- ^ A b Zhu X, Galili G (květen 2004). „Metabolismus lysinu je současně regulován syntézou a katabolismem v reprodukční i vegetativní tkáni“. Fyziologie rostlin. 135 (1): 129–36. doi:10.1104 / pp.103.037168. PMC 429340. PMID 15122025.
- ^ A b C d E Tomé D, Bos C (červen 2007). „Požadavek na lysin v průběhu lidského životního cyklu“. The Journal of Nutrition. 137 (6 Suppl 2): 1642S – 1645S. doi:10.1093 / jn / 137.6.1642S. PMID 17513440.
- ^ Blemings KP, Crenshaw TD, Swick RW, Benevenga NJ (srpen 1994). „Lysin-alfa-ketoglutarátreduktáza a sacharopindehydrogenáza jsou lokalizovány pouze v mitochondriální matrici v játrech potkanů.“ The Journal of Nutrition. 124 (8): 1215–21. doi:10.1093 / jn / 124.8.1215. PMID 8064371.
- ^ Galili G, Tang G, Zhu X, Gakiere B (červen 2001). „Lysinový katabolismus: stresově a vývojově regulovaná metabolická cesta“. Aktuální názor na biologii rostlin. 4 (3): 261–6. doi:10.1016 / s1369-5266 (00) 00170-9. PMID 11312138.
- ^ Arruda P, Kemper EL, Papes F, Leite A (srpen 2000). "Regulace katabolismu lysinu u vyšších rostlin". Trendy ve vědě o rostlinách. 5 (8): 324–30. doi:10.1016 / s1360-1385 (00) 01688-5. PMID 10908876.
- ^ Sacksteder KA, Biery BJ, Morrell JC, Goodman BK, Geisbrecht BV, Cox RP, Gould SJ, Geraghty MT (červen 2000). „Identifikace genu pro alfa-aminoadipickou semialdehyd syntázu, který je vadný u familiární hyperlysinemie“. American Journal of Human Genetics. 66 (6): 1736–43. doi:10.1086/302919. PMC 1378037. PMID 10775527.
- ^ Zhu X, Tang G, Galili G (prosinec 2002). „Aktivita bifunkčního enzymu lysin-ketoglutarátreduktáza / sacharopindehydrogenáza Arabidopsis lysinového katabolismu je regulována funkční interakcí mezi jeho dvěma doménami enzymů.“. The Journal of Biological Chemistry. 277 (51): 49655–61. doi:10.1074 / jbc.m205466200. PMID 12393892.
- ^ A b C Kiyota E, Pena IA, Arruda P (listopad 2015). "Cesta sacharopinu ve vývoji semen a stresové reakci kukuřice". Rostlina, buňka a životní prostředí. 38 (11): 2450–61. doi:10.1111 / pce.12563. PMID 25929294.
- ^ Serrano GC, Rezende e Silva Figueira T, Kiyota E, Zanata N, Arruda P (březen 2012). „Odbourávání lysinu cestou sacharopinu v bakteriích: LKR a SDH v bakteriích a jeho vztah k rostlinným a živočišným enzymům“. FEBS Dopisy. 586 (6): 905–11. doi:10.1016 / j.febslet.2012.02.023. PMID 22449979.
- ^ A b C Danhauser K, Sauer SW, Haack TB, Wieland T, Staufner C, Graf E, Zschocke J, Strom TM, Traub T, Okun JG, Meitinger T, Hoffmann GF, Prokisch H, Kölker S (prosinec 2012). „Mutace DHTKD1 způsobují 2-aminoadipovou a 2-oxoadipovou acidurii“. American Journal of Human Genetics. 91 (6): 1082–7. doi:10.1016 / j.ajhg.2012.10.006. PMC 3516599. PMID 23141293.
- ^ Sauer SW, Opp S, Hoffmann GF, Koeller DM, Okun JG, Kölker S (leden 2011). „Terapeutická modulace cerebrálního metabolismu L-lysinu v myším modelu pro glutarovou acidurii typu I“. Mozek. 134 (Pt 1): 157–70. doi:10.1093 / brain / awq269. PMID 20923787.
- ^ Goncalves RL, Bunik VI, Brand MD (únor 2016). „Produkce superoxidu / peroxidu vodíku komplexem mitochondriální 2-oxoadipátdehydrogenázy“. Radikální biologie a medicína zdarma. 91: 247–55. doi:10.1016 / j.freeradbiomed.2015.12.020. PMID 26708453.
- ^ Goh DL, Patel A, Thomas GH, Salomons GS, Schor DS, Jakobs C, Geraghty MT (červenec 2002). "Charakterizace lidského genu kódujícího alfa-aminoadipátaminotransferázu (AADAT)". Molekulární genetika a metabolismus. 76 (3): 172–80. doi:10.1016 / s1096-7192 (02) 00037-9. PMID 12126930.
- ^ Härtel U, Eckel E, Koch J, Fuchs G, Linder D, Buckel W (1. února 1993). „Čištění glutaryl-CoA dehydrogenázy z Pseudomonas sp., Enzymu podílejícího se na anaerobní degradaci benzoátu“. Archiv mikrobiologie. 159 (2): 174–81. doi:10.1007 / bf00250279. PMID 8439237.
- ^ Sauer SW (říjen 2007). „Biochemistry and bioenergetics of glutaryl-CoA dehydrogenase deficiency“. Journal of Inherited Metabolic Disease. 30 (5): 673–80. doi:10.1007 / s10545-007-0678-8. PMID 17879145.
- ^ Nelson DL, Cox MM, Lehninger AL (2013). Lehningerovy principy biochemie (6. vydání). New York: W.H. Freeman a společnost. ISBN 978-1-4641-0962-1. OCLC 824794893.
- ^ A b Galili G, Amir R (únor 2013). „Obohacení rostlin esenciálními aminokyselinami lysinem a methioninem za účelem zlepšení kvality výživy“. Plant Biotechnology Journal. 11 (2): 211–22. doi:10.1111 / pbi.12025. PMID 23279001.
- ^ A b Wang G, Xu M, Wang W, Galili G (červen 2017). „Obohacení zahradnických plodin základními aminokyselinami: recenze“. International Journal of Molecular Sciences. 18 (6): 1306. doi:10,3390 / ijms18061306. PMC 5486127. PMID 28629176.
- ^ Angelovici R, Fait A, Fernie AR, Galili G (leden 2011). „Znak s vysokým obsahem lysinu v semenu je negativně spojen s cyklem TCA a zpomaluje klíčení semen Arabidopsis“. Nový fytolog. 189 (1): 148–59. doi:10.1111 / j.1469-8137.2010.03478.x. PMID 20946418.
- ^ Edelman M, Colt M (2016). „Nutriční hodnota listu vs. osiva“. Hranice v chemii. 4: 32. doi:10.3389 / fchem.2016.00032. PMC 4954856. PMID 27493937.
- ^ Jiang SY, Ma A, Xie L, Ramachandran S (září 2016). „Zlepšení obsahu a kvality bílkovin nadměrnou expresí uměle syntetických fúzních proteinů s vysokým obsahem lysinu a threoninu v rostlinách rýže“. Vědecké zprávy. 6 (1): 34427. doi:10.1038 / srep34427. PMC 5039639. PMID 27677708.
- ^ A b Shewry PR (listopad 2007). "Zlepšení obsahu bílkovin a složení obilného zrna". Journal of Cereal Science. 46 (3): 239–250. doi:10.1016 / j.jcs.2007.06.006.
- ^ Prasanna B, Vasal SK, Kassahun B, Singh NN (2001). "Kvalitní proteinová kukuřice". Současná věda. 81 (10): 1308–1319. JSTOR 24105845.
- ^ A b Kircher M, Pfefferle W (duben 2001). "Fermentační produkce L-lysinu jako doplňkové látky pro zvířata". Chemosféra. 43 (1): 27–31. doi:10.1016 / s0045-6535 (00) 00320-9. PMID 11233822.
- ^ Junior L, Alberto L, Letti GV, Soccol CR, Junior L, Alberto L, Letti GV, Soccol CR (2016). „Vývoj větve obohacené o L-lysin pro výživu zvířat pomocí ponořené fermentace Corynebacterium glutamicum za použití agroindustriálních substrátů“. Brazilský archiv biologie a technologie. 59. doi:10.1590/1678-4324-2016150519. ISSN 1516-8913.
- ^ Lékařské centrum University of Maryland. "Lysin". Citováno 30. prosince 2009.
- ^ Young VR, Pellett PL (1994). „Rostlinné proteiny ve vztahu k výživě lidských bílkovin a aminokyselin“. American Journal of Clinical Nutrition. 59 (5 doplňků): 1203S – 1212S. doi:10.1093 / ajcn / 59.5.1203s. PMID 8172124.
- ^ Lékařský ústav národních akademií. „Dietní referenční příjem pro makroživiny“. p. 589. Citováno 29. října 2017.
- ^ „Databáze doplňků stravy: Informace o směsi (DSBI)“.
L-LYSIN HCL 10000820 80,03% lysinu
- ^ A b Betts MJ, Russell RB (2003). Barnes MR, Gray IC (eds.). Bioinformatika pro genetiky. John Wiley & Sons, Ltd. str. 289–316. doi:14.1002 / 0470867302.ch14. ISBN 978-0-470-86730-3.
- ^ Blickling S, Renner C, Laber B, Pohlenz HD, Holak TA, Huber R (leden 1997). "Reakční mechanismus dihydrodipikolinát syntázy Escherichia coli zkoumán rentgenovou krystalografií a NMR spektroskopií". Biochemie. 36 (1): 24–33. doi:10.1021 / bi962272d. PMID 8993314.
- ^ Kumar S, Tsai CJ, Nussinov R (březen 2000). „Faktory zvyšující termostabilitu bílkovin“. Proteinové inženýrství. 13 (3): 179–91. doi:10.1093 / protein / 13.3.179. PMID 10775659.
- ^ Sokalingam S, Raghunathan G, Soundrarajan N, Lee SG (9. července 2012). "A study on the effect of surface lysine to arginine mutagenesis on protein stability and structure using green fluorescent protein". PLOS ONE. 7 (7): e40410. doi:10.1371/journal.pone.0040410. PMC 3392243. PMID 22792305.
- ^ A b Dambacher S, Hahn M, Schotta G (July 2010). "Epigenetic regulation of development by histone lysine methylation". Dědičnost. 105 (1): 24–37. doi:10.1038/hdy.2010.49. PMID 20442736.
- ^ Martin C, Zhang Y (November 2005). "The diverse functions of histone lysine methylation". Recenze přírody. Molekulární buněčná biologie. 6 (11): 838–49. doi:10.1038/nrm1761. PMID 16261189.
- ^ Black JC, Van Rechem C, Whetstine JR (November 2012). „Dynamika methylace histonového lysinu: vznik, regulace a biologický dopad“. Molekulární buňka. 48 (4): 491–507. doi:10.1016 / j.molcel.2012.11.006. PMC 3861058. PMID 23200123.
- ^ Choudhary C, Kumar C, Gnad F, Nielsen ML, Rehman M, Walther TC, Olsen JV, Mann M (August 2009). "Lysine acetylation targets protein complexes and co-regulates major cellular functions". Věda. 325 (5942): 834–40. doi:10.1126 / science.1175371. PMID 19608861.
- ^ Shiio Y, Eisenman RN (November 2003). "Histone sumoylation is associated with transcriptional repression". Sborník Národní akademie věd Spojených států amerických. 100 (23): 13225–30. doi:10.1073/pnas.1735528100. PMC 263760. PMID 14578449.
- ^ Wang H, Wang L, Erdjument-Bromage H, Vidal M, Tempst P, Jones RS, Zhang Y (October 2004). "Role of histone H2A ubiquitination in Polycomb silencing". Příroda. 431 (7010): 873–8. doi:10.1038/nature02985. hdl:10261/73732. PMID 15386022.
- ^ A b Ramena MD, Raines RT (2009). "Kolagenová struktura a stabilita". Roční přehled biochemie. 78: 929–58. doi:10,1146 / annurev.biochem.77.032207.120833. PMC 2846778. PMID 19344236.
- ^ A b Civitelli R, Villareal DT, Agnusdei D, Nardi P, Avioli LV, Gennari C (1992). "Dietary L-lysine and calcium metabolism in humans". Výživa. 8 (6): 400–5. PMID 1486246.
- ^ A b C d Vaz FM, Wanders RJ (February 2002). "Carnitine biosynthesis in mammals". The Biochemical Journal. 361 (Pt 3): 417–29. doi:10.1042/bj3610417. PMC 1222323. PMID 11802770.
- ^ Yamauchi M, Sricholpech M (25 May 2012). "Lysine post-translational modifications of collagen". Eseje v biochemii. 52: 113–33. doi:10.1042/bse0520113. PMC 3499978. PMID 22708567.
- ^ Vollmer W, Blanot D, de Pedro MA (March 2008). "Peptidoglycan structure and architecture". Recenze mikrobiologie FEMS. 32 (2): 149–67. doi:10.1111/j.1574-6976.2007.00094.x. PMID 18194336.
- ^ Curtiss R (May 1978). "Biological containment and cloning vector transmissibility". The Journal of Infectious Diseases. 137 (5): 668–75. doi:10.1093/infdis/137.5.668. PMID 351084.
- ^ A b Flanagan JL, Simmons PA, Vehige J, Willcox MD, Garrett Q (April 2010). "Role of carnitine in disease". Výživa a metabolismus. 7: 30. doi:10.1186/1743-7075-7-30. PMC 2861661. PMID 20398344.
- ^ A b Chromiak JA, Antonio J (2002). "Use of amino acids as growth hormone-releasing agents by athletes". Výživa. 18 (7–8): 657–61. doi:10.1016/s0899-9007(02)00807-9. PMID 12093449.
- ^ Corpas E, Blackman MR, Roberson R, Scholfield D, Harman SM (July 1993). "Oral arginine-lysine does not increase growth hormone or insulin-like growth factor-I in old men". Časopis gerontologie. 48 (4): M128–33. doi:10.1093/geronj/48.4.M128. PMID 8315224.
- ^ Gaby AR (2006). "Natural remedies for Herpes simplex". Altern Med Rev. 11 (2): 93–101. PMID 16813459.
- ^ Tomblin FA, Lucas KH (2001). "Lysine for management of herpes labialis". Am J Health Syst Pharm. 58 (4): 298–300, 304. doi:10.1093/ajhp/58.4.298. PMID 11225166.
- ^ Chi CC, Wang SH, Delamere FM, Wojnarowska F, Peters MC, Kanjirath PP (7 August 2015). "Interventions for prevention of herpes simplex labialis (cold sores on the lips)". Cochrane Database of Systematic Reviews (8): CD010095. doi:10.1002/14651858.CD010095.pub2. PMC 6461191. PMID 26252373.
- ^ "Scientific Opinion on the substantiation of health claims related to L-lysine and immune defence against herpes virus (ID 453), maintenance of normal blood LDL-cholesterol concentrations (ID 454, 4669), increase in appetite leading to an increase in energ". Deník EFSA. 9 (4): 2063. 2011. doi:10.2903/j.efsa.2011.2063. ISSN 1831-4732.
- ^ Pinnell SR, Krane SM, Kenzora JE, Glimcher MJ (May 1972). "A heritable disorder of connective tissue. Hydroxylysine-deficient collagen disease". The New England Journal of Medicine. 286 (19): 1013–20. doi:10.1056/NEJM197205112861901. PMID 5016372.
- ^ Rudman D, Sewell CW, Ansley JD (September 1977). "Deficiency of carnitine in cachectic cirrhotic patients". The Journal of Clinical Investigation. 60 (3): 716–23. doi:10.1172/jci108824. PMC 372417. PMID 893675.
- ^ A b Rushton DH (July 2002). "Nutritional factors and hair loss". Klinická a experimentální dermatologie. 27 (5): 396–404. doi:10.1046/j.1365-2230.2002.01076.x. PMID 12190640.
- ^ Emery PW (October 2005). "Metabolic changes in malnutrition". Oko. 19 (10): 1029–34. doi:10.1038/sj.eye.6701959. PMID 16304580.
- ^ Ghosh S, Smriga M, Vuvor F, Suri D, Mohammed H, Armah SM, Scrimshaw NS (October 2010). "Effect of lysine supplementation on health and morbidity in subjects belonging to poor peri-urban households in Accra, Ghana". American Journal of Clinical Nutrition. 92 (4): 928–39. doi:10.3945/ajcn.2009.28834. PMID 20720257.
- ^ A b Houten SM, Te Brinke H, Denis S, Ruiter JP, Knegt AC, de Klerk JB, Augoustides-Savvopoulou P, Häberle J, Baumgartner MR, Coşkun T, Zschocke J, Sass JO, Poll-The BT, Wanders RJ, Duran M (April 2013). "Genetic basis of hyperlysinemia". Orphanet Journal of Rare Diseases. 8: 57. doi:10.1186/1750-1172-8-57. PMC 3626681. PMID 23570448.
- ^ Hoffmann GF, Kölker S (2016). Inborn Metabolic Diseases. Springer, Berlín, Heidelberg. pp. 333–348. doi:10.1007/978-3-662-49771-5_22. ISBN 978-3-662-49769-2.
- ^ Dancis J, Hutzler J, Ampola MG, Shih VE, van Gelderen HH, Kirby LT, Woody NC (May 1983). "The prognosis of hyperlysinemia: an interim report". American Journal of Human Genetics. 35 (3): 438–42. PMC 1685659. PMID 6407303.
- ^ Mills PB, Struys E, Jakobs C, Plecko B, Baxter P, Baumgartner M, Willemsen MA, Omran H, Tacke U, Uhlenberg B, Weschke B, Clayton PT (March 2006). „Mutace v antikvitinu u jedinců se záchvaty závislými na pyridoxinu“. Přírodní medicína. 12 (3): 307–9. doi:10,1038 / nm1366. PMID 16491085.
- ^ Mills PB, Footitt EJ, Mills KA, Tuschl K, Aylett S, Varadkar S, Hemingway C, Marlow N, Rennie J, Baxter P, Dulac O, Nabbout R, Craigen WJ, Schmitt B, Feillet F, Christensen E, De Lonlay P, Pike MG, Hughes MI, Struys EA, Jakobs C, Zuberi SM, Clayton PT (July 2010). "Genotypic and phenotypic spectrum of pyridoxine-dependent epilepsy (ALDH7A1 deficiency)". Mozek. 133 (Pt 7): 2148–59. doi:10.1093/brain/awq143. PMC 2892945. PMID 20554659.
- ^ Hagen J, te Brinke H, Wanders RJ, Knegt AC, Oussoren E, Hoogeboom AJ, Ruijter GJ, Becker D, Schwab KO, Franke I, Duran M, Waterham HR, Sass JO, Houten SM (September 2015). "Genetic basis of alpha-aminoadipic and alpha-ketoadipic aciduria". Journal of Inherited Metabolic Disease. 38 (5): 873–9. doi:10.1007/s10545-015-9841-9. PMID 25860818.
- ^ Hedlund GL, Longo N, Pasquali M (May 2006). "Glutaric acidemia type 1". American Journal of Medical Genetics Part C: Seminars in Medical Genetics. 142C (2): 86–94. doi:10.1002/ajmg.c.30088. PMC 2556991. PMID 16602100.
- ^ "Hyperlysinuria | Define Hyperlysinuria at Dictionary.com".
- ^ A b Walter, John; John Fernandes; Jean-Marie Saudubray; Georges van den Berghe (2006). Vrozené metabolické nemoci: diagnostika a léčba. Berlín: Springer. p. 296. ISBN 978-3-540-28783-4.
- ^ A b "Norwegian granted for improving lysine production process". All About Feed. 26. ledna 2010. Archivovány od originál dne 11. března 2012.
- ^ Toride Y (2004). "Lysine and other amino acids for feed: production and contribution to protein utilization in animal feeding". Protein sources for the animal feed industry; FAO Expert Consultation and Workshop on Protein Sources for the Animal Feed Industry; Bangkok, 29 April - 3 May 2002. Řím: Organizace OSN pro výživu a zemědělství. ISBN 978-92-5-105012-5.
- ^ Abelson PH (March 1999). "A potential phosphate crisis". Věda. 283 (5410): 2015. doi:10.1126/science.283.5410.2015. PMID 10206902.
- ^ Coyne JA (10 October 1999). "The Truth Is Way Out There". The New York Times. Citováno 6. dubna 2008.
- ^ Wu G (May 2009). "Amino acids: metabolism, functions, and nutrition". Aminokyseliny. 37 (1): 1–17. doi:10.1007/s00726-009-0269-0. PMID 19301095.
- ^ Connor JM (2008). Global Price Fixing (2. vyd.). Heidelberg: Springer-Verlag. ISBN 978-3-540-78669-6.
- ^ Eichenwald K (2000). The Informant: a true story. New York: Broadway Books. ISBN 978-0-7679-0326-4.

