Upstream a downstream (transdukce) - Upstream and downstream (transduction)
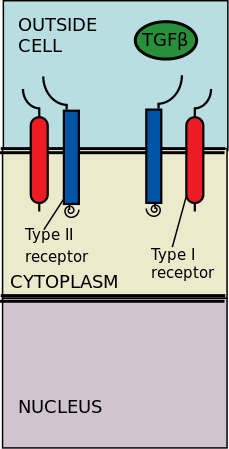

The proti proudu signální dráha je spuštěna vazbou signální molekuly, a ligand, na přijímající molekulu, a receptor. Receptory a ligandy existují v mnoha různých formách a budou rozpoznávat / vázat pouze konkrétní molekuly. Upstream extracelulární signalizace transduce nekonečná paleta intracelulárních kaskád.[1]
Receptory a ligandy jsou běžné upstream signalizační molekuly, které diktují po proudu prvky signální dráhy. Spousta různých faktorů ovlivňuje, na které ligandy se vážou, na které receptory a následnou buněčnou reakci, kterou iniciují.
TGF-p
Extracelulární receptory kinázy typu II a typu I se váží na ligandy TGF-p. Transformující růstový faktor-β (TGF-β) je nadrodina cytokinů, které hrají významnou upstreamovou roli v regulaci Morfogeneze, Homeostáza, buněčná proliferace a diferenciace.[2] Význam TGF-p je zjevný u lidských onemocnění, ke kterým dochází při narušení procesů TGF-p, jako je rakovina a onemocnění skeletu, střeva a kardiovaskulární choroby.[3][4] TGF-p je pleiotropní a multifunkční, což znamená, že jsou schopni působit na širokou škálu typů buněk.[5]
Mechanismus
Účinky transformujícího růstového faktoru-β (TGF-β) jsou určeny celulárním kontextem. Existují tři druhy kontextových faktorů, které určují tvar odpovědi TGF-β: signální transdukce komponenty, transkripční kofaktory a epigenetický stav buňky. Různé ligandy a receptory TGF-p jsou také významné v signální transdukční cestě složení.[2]
- komponenty přenosu signálu: izoformy ligandu lapače ligandů, ko-receptory, podtypy receptorů, inhibiční SMAD bílkoviny, přeslechové vstupy
- transkripční kofaktory proteinů SMAD: pluripotenční faktory, regulátory linie, Kofaktory vázající DNA, Klobouky a HDAC, SNF, čtečky chromatinu
- epigenetické faktory: heterochromatin, pluripotence značky, značky linie, EMT značky, značky buněk iPS, onkogenní známky.
Cesta proti proudu
Receptory typu II fosforylují receptory typu I; receptory typu I jsou poté umožněny fosforylovat cytoplazmatické R-Smady, které pak působí jako transkripční regulátory.[6][2] Signalizace je zahájena vazbou TGF-p na jeho serinové / threoninové receptory. Serenové / threoninové receptory jsou receptory typu II a typu I na buněčné membráně. Vazba členů TGF-β indukuje shromáždění heterotetramerického komplexu dvou receptorů typu I a dvou receptorů typu II na plazmatická membrána.[6] Jednotliví členové rodiny TGF-p se vážou na určitou sadu charakteristické kombinace těchto receptorů typu I a typu II.[7] Receptory typu I lze rozdělit do dvou skupin, které závisí na cytoplazmatických R-Smads že se vážou a fosforylují. První skupina receptorů typu I (Alk1 / 2/3/6) váže a aktivuje R-Smads, Smad1 / 5/8. Druhá skupina reaktorů typu I (Alk4 / 5/7) působí na R-Smads, Smad2 / 3. Fosforylované R-Smads pak tvoří komplexy a signály jsou přiváděny dvěma regulačními kanály Smad (R-Smad) (Smad1 / 5/8 nebo Smad2 / 3).[6][2] Poté, co komplexy ligand-receptor fosforylují cytoplazmatické R-Smady, je signál odeslán přes Smad 1/5/8 nebo Smad 2/3. To vede k následné signální kaskádě a cílení na buněčné geny.[6][5]
Cesta po proudu
TGF-β reguluje několik navazujících procesů a buněčných funkcí. Cesta je vysoce variabilní na základě buněčného kontextu. TGF-β downstream signální kaskáda zahrnuje regulaci buněčného růstu, proliferace buněk, diferenciace buněk, a apoptóza.[8]
Reference
- ^ Miller DS, Schmierer B, Hill CS (červenec 2019). „Ligandy rodiny TGF-β vykazují odlišnou signální dynamiku, která je řízena lokalizací receptoru“. Journal of Cell Science. 132 (14): jcs234039. doi:10,1242 / jcs.234039. PMC 6679586. PMID 31217285.
- ^ A b C d Massagué J (říjen 2012). "TGFβ signalizace v kontextu". Recenze přírody. Molekulární buněčná biologie. 13 (10): 616–30. doi:10.1038 / nrm3434. PMC 4027049. PMID 22992590.
- ^ Kashima R, Hata A (leden 2018). „Role signalizace superrodiny TGF-β při neurologických poruchách“. Acta Biochimica et Biophysica Sinica. 50 (1): 106–120. doi:10.1093 / abbs / gmx124. PMC 5846707. PMID 29190314.
- ^ Huang T, Schor SL, Hinck AP (září 2014). „Rozdíly v biologické aktivitě mezi TGF-β1 a TGF-β3 korelují s rozdíly v tuhosti a uspořádání jejich monomerů.“. Biochemie. 53 (36): 5737–49. doi:10.1021 / bi500647d. PMC 4165442. PMID 25153513.
- ^ A b Letterio JJ, Roberts AB (01.04.1998). "Regulace imunitních odpovědí pomocí TGF-beta". Výroční přehled imunologie. 16 (1): 137–61. doi:10.1146 / annurev.immunol.16.1.137. PMID 9597127.
- ^ A b C d Vilar JM, Jansen R, Sander C (leden 2006). "Zpracování signálu v síti TGF-beta nadrodiny ligand-receptor". PLOS výpočetní biologie. 2 (1): e3. arXiv:q-bio / 0509016. Bibcode:2006PLSCB ... 2 .... 3V. doi:10.1371 / journal.pcbi.0020003. PMC 1356091. PMID 16446785.
- ^ Heldin CH, Moustakas A (srpen 2016). "Signální receptory pro členy rodiny TGF-β". Perspektivy Cold Spring Harbor v biologii. 8 (8): a022053. doi:10.1101 / cshperspect.a022053. PMC 4968163. PMID 27481709.
- ^ Li N, Xie C, Lu NH (2015). „Transformující růstový faktor-β: důležitý mediátor v patogenezi spojené s Helicobacter pylori“. Hranice v buněčné a infekční mikrobiologii. 5: 77. doi:10.3389 / fcimb.2015.00077. PMC 4632021. PMID 26583078.
