Spojení vezikul - Vesicle fusion
Spojení vezikul je sloučení vezikuly s jinými vezikuly nebo část a buněčná membrána. V druhém případě se jedná o konečnou fázi vylučování ze sekrečních vezikul, kde je jejich obsah vyloučen z buňky skrz exocytóza. Vezikuly se mohou také spojit s jinými oddíly cílových buněk, jako je a lysozom. Exocytóza nastává, když se sekreční vezikuly přechodně dokují a fúzují na základně kalíškovitých struktur na tzv porozom, univerzální sekreční aparát v buňkách. Fúze vezikul může záviset na SNARE proteiny v přítomnosti zvýšené intracelulární vápník (Ca2+) koncentrace.
Spouštěče
Stimuly, které spouštějí fúzi vezikul, působí zvýšením intracelulárního Ca2+.
- Synaptické vezikuly spáchat fúzi vezikul pomocí a nervový impuls dosažení synapse, aktivace napěťově závislé vápníkové kanály které způsobují příliv Ca2+ do cely.
- V endokrinní systém, mnoho hormonů je uvolňováno jejich uvolňující hormony vazba na Receptory spojené s G proteinem spojený s Gq alfa podjednotka, aktivace IP3 / DAG cesta ke zvýšení Ca2+. Mezi příklady tohoto mechanismu patří:
- Gonadotropin uvolňující hormon [1]
- Hormon uvolňující thyrotropin[1]
- Hormon uvolňující růstový hormon[1] (vedlejší cesta - hlavní je cAMP závislá cesta [2])
Modelové systémy
Modelové systémy skládající se z jednoho fosfolipid nebo směs byla studována fyzikálními chemiky. Kardiolipin se nachází hlavně v mitochondriálních membránách a ionty vápníku hrají důležitou roli v dýchacích procesech zprostředkovaných mitochondrie. Příslušné síly byly vysvětleny[3] tento proces z hlediska nukleace pro aglomeraci menších supramolekulárních entit nebo fázové změny ve struktuře biomembrán.[4]
Mechanismy
Synaptická štěpná fúze
v synaptický váček fúze, vezikul musí být do několika nanometrů cílové membrány, aby mohl proces fúze začít. Tato blízkost umožňuje buněčné membráně a váčku vyměňovat si lipidy, které jsou zprostředkovány určitými proteiny, které odstraňují vodu, která přichází mezi formujícím se spojem. Jakmile je vezikul na svém místě, musí počkat, až Ca2+ vstupuje do buňky šířením akční potenciál na presynaptickou membránu.[5] Ca.2+ váže se na specifické proteiny, z nichž jeden je Synaptotagmin v neuronech, které spouští úplnou fúzi vezikuly s cílovou membránou.[6]
Předpokládá se také, že proteiny SNARE pomáhají zprostředkovat, která membrána je cílem kterého vezikulu.[7]
SNARE tvorba bílkovin a pórů

Shromáždění SNARE do „trans“ komplexů pravděpodobně přemostí protivníky lipidové dvojvrstvy membrán patřících do buňky a sekreční granule, čímž se dostávají do blízkosti a vyvolávají jejich fúzi. Příliv vápníku do buňky spouští dokončení montážní reakce, která je zprostředkována interakcí mezi domnělým senzorem vápníku, synaptotagmin, s membránovými lipidy a / nebo částečně sestaveným komplexem SNARE.
Jedna hypotéza implikuje molekulu Complexin v komplexu SNARE a jeho interakce s molekulou synaptotagmin.[9] Známá jako „svorková“ hypotéza, přítomnost komplexinu normálně inhibuje fúzi vezikuly s buněčnou membránou. Vazba iontů vápníku na synaptotagmin však spouští uvolňování nebo inaktivaci komplexinu, takže váček se potom může fúzovat.[10]
Podle hypotézy „zipu“ začíná komplexní sestava v N-koncových částech motivů SNARE a postupuje směrem k C-koncům, které ukotvují interagující proteiny v membránách. Tvorba komplexu "trans" -SNARE probíhá prostřednictvím přechodného komplexu složeného ze SNAP-25 a syntaxinu-1, který se později přizpůsobí synaptobrevin-2 (citované syntaxinové a synaptobrevinové izotypy se účastní uvolňování neuronových neuromeditorů).
Na základě stability výslednice komplex cis-SNARE, bylo předpokládáno, že energie uvolněná během procesu montáže slouží jako prostředek k překonání odpudivých sil mezi membránami. Existuje několik modelů, které navrhují vysvětlení dalšího kroku - vytvoření stonku a fúzních pórů, ale přesná povaha těchto procesů zůstává diskutována. Dva z nejvýznamnějších modelů na fúzní pór formace jsou teorie fúzních pórů lemovaných lipidy a proteiny.[11]
Teorie fúzních pórů lemovaná lipidy
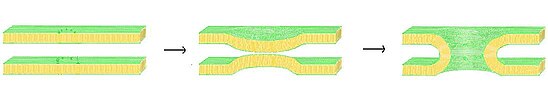
Jedním z možných modelů pro tvorbu fúzních pórů je teorie pórů lipidové linie. V tomto modelu, jakmile byly membrány uvedeny do dostatečně těsné blízkosti pomocí "zipového" mechanismu SNARE komplex, membránová fúze nastává spontánně. Ukázalo se, že když se obě membrány dostanou do kritické vzdálenosti, je možné, aby hydrofilní lipidové čelní skupiny jedné membrány splynuly s protilehlou membránou.[12] V modelu lipidových fúzních pórů působí komplex SNARE jako lešení, které přitahuje membránu a způsobuje, že se obě membrány stáhnou, aby mohly dosáhnout kritické fúzní vzdálenosti. Jakmile se obě membrány začnou spojovat, vytvoří se stopka lemovaná lipidy, která se postupem času rozšiřuje radiálně směrem ven.
Zatímco póry lemované lipidy jsou možné a mohou dosáhnout všech stejných vlastností pozorovaných při časné tvorbě pórů, neexistují dostatečné údaje, které by prokázaly, že jde o jedinou metodu tvorby.[13] V současné době neexistuje navrhovaný mechanismus mezibuněčné regulace fluktuace pórů lemovaných lipidy a měly by podstatně obtížnější čas způsobující účinky, jako je „kiss-and-run“ ve srovnání s jejich protějšky lemovanými proteiny. Účinnost pórů lemovaných lipidy by také velmi závisela na složení obou membrán a její úspěch nebo neúspěch by se mohl divoce měnit se změnami pružnosti a tuhosti.[13]
Teorie fúzí pórů lemovaných proteiny
Dalším možným modelem pro tvorbu fúzních pórů je teorie pórů lemovaná proteinem. V tomto modelu po aktivaci synaptotagmin vápníkem se několik komplexů SNARE spojilo a vytvořilo kruhovou strukturu s synaptobrevin tvoří póry v membráně vezikul a Syntaxin tvoří póry v buněčné membráně.[14] Jak se počáteční pór rozšiřuje, obsahuje lipidy z obou dvojvrstev, což nakonec vede k úplné fúzi dvou membrán. Komplex SNARE má mnohem aktivnější roli v teorii pórů lemovaných proteiny; protože póry se zpočátku skládají výhradně z proteinů SNARE, póry jsou snadno schopné podstoupit mezibuněčnou regulaci, což umožňuje snadno dosáhnout fluktuace a mechanismů „polibek a běh“.[9]
Pór lemovaný bílkovinami dokonale splňuje všechny pozorované požadavky pórů časné fúze a zatímco některá data tuto teorii podporují,[14] neexistuje dostatek údajů, aby bylo možné jej prohlásit za primární metodu fúze. Pór lemovaný proteinem vyžaduje nejméně pět kopií komplexu SNARE, zatímco fúze byla pozorována již u dvou.[14]
V obou teoriích zůstává funkce komplexu SNARE do značné míry nezměněna a pro zahájení fúze je nezbytný celý komplex SNARE. Je však prokázáno, že in vitro Syntaxin per se je dostatečný k řízení spontánní fúze synaptických vezikul obsahujících v-SNARE nezávislé na vápníku.[15] To naznačuje, že v Ca2+-závislá neuronální exocytóza synaptotagmin je duální regulátor, při absenci Ca2+ ionty inhibovat SNARE dynamiku, zatímco v přítomnosti Ca2+ ionty jednat jako agonista v procesu fúze membrány.
Polibek a hypotéza
v synaptické vezikuly, někteří neurochemici navrhli, že vezikuly občas nemusí úplně fúzovat s presynaptickými membránami v uvolňování neurotransmiteru do synaptická štěrbina. Spor spočívá v tom, zda endocytóza vždy dochází při reformování vezikul po uvolnění neurotransmiteru. Další navrhovaný mechanismus pro uvolňování obsahu vezikul do extracelulární tekutiny se nazývá polibek a běh fúze.
Existují určité náznaky, že vezikuly mohou tvořit pouze malý pór v presynaptické membráně, což umožňuje krátkodobé uvolnění obsahu standardní difúzí před ústupem zpět do presynaptické buňky. Tento mechanismus může být cestou kolem klatrinem zprostředkovaná endocytóza. Rovněž se navrhuje, aby se váček nemusel vracet k endozom znovu naplnit, i když není zcela jasné, jakým mechanismem by se doplnilo. To nevylučuje úplnou fúzi vezikul, ale pouze uvádí, že oba mechanismy mohou fungovat v synaptických rozštěpech.
Ukázalo se, že „polibek a běh“ se vyskytuje v endokrinních buňkách, i když v synaptických mezerách nebyl přímo svědkem.[16]
Viz také
- SNARE
- Presynaptická aktivní zóna
- Liposomy používané jako modely pro umělé buňky v fúze membrány studie.
Reference
- ^ A b C Stránka 237 v: Costanzo, Linda S. (2007). Fyziologie. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-7311-9.
- ^ Walter F., PhD. Boron (2003). Lékařská fyziologie: buněčný a molekulární přístup. Elsevier / Saunders. p. 1300. ISBN 978-1-4160-2328-9.
- ^ Papahadjopoulos, Demetrios (1990). "Molekulární mechanismy fúze membrány vyvolané vápníkem". Journal of Bioenergetics and Biomembranes. 22 (2): 157–179. doi:10.1007 / BF00762944. PMID 2139437.
- ^ sciencedirect
- ^ Pigino, Gustavo; Morfini, Gerardo; Brady, Scott (2006). "Kapitola 9: Intracelulární obchodování". In Siegal, George J .; Albers, R. Wayne; Brady, Scott T .; et al. (eds.). Základní neurochemie: Molekulární, buněčné a lékařské aspekty (Učebnice) (7. vydání). Burlington, MA: Elsevier Academic Press. p. 143. ISBN 978-0-12-088397-4.
- ^ Pigino a kol. 158
- ^ Pigino a kol. s. 143
- ^ Georgiev, Danko D.; James F. Glazebrook (2007). "Subneuronální zpracování informací osamělými vlnami a stochastickými procesy". V Lyshevski, Sergey Edward (ed.). Příručka pro nano a molekulární elektroniku. Série nano a mikroinženýrství. CRC Press. str. 17–1–17–41. doi:10.1201/9781315221670-17. ISBN 978-0-8493-8528-5.
- ^ A b Kümmel, D .; Krishnakumar, S. S .; Radoff, D. T .; Li, F .; Giraudo, C. G .; Pincet, F .; Rothman, J. E.; Reinisch, K. M. (2011). "Complexin cross-links prefusion SNAREs to a cikcak array". Přírodní strukturní a molekulární biologie. 18 (8): 927–933. doi:10.1038 / nsmb.2101. PMC 3410656. PMID 21785414.
- ^ Richmond, Janet. "Funkce Synapse".
- ^ Jackson, Meyer B .; Chapman, Edwin R. (2006). "Fúzní póry a fúzní stroje v Ca2 + spouští exocytózu". Roční přehled biofyziky a biomolekulární struktury. 35 (1): 135–160. doi:10.1146 / annurev.biophys.35.040405.101958. PMID 16689631.
- ^ Marrink, Siewert J .; Mark, Alan E. (01.09.2003). „Mechanismus fúze vezikul, jak ho odhalili simulace molekulární dynamiky“ (PDF). Journal of the American Chemical Society. 125 (37): 11144–11145. doi:10.1021 / ja036138 +. ISSN 0002-7863. PMID 16220905.
- ^ A b Nanavati, C; Markin, VS; Oberhauser, A F; Fernandez, J. M. (10.10.1992). „Exocytotický fúzní pór modelovaný jako lipidový pór“. Biofyzikální deník. 63 (4): 1118–1132. doi:10.1016 / s0006-3495 (92) 81679-x. ISSN 0006-3495. PMC 1262250. PMID 1420930.
- ^ A b C Chang, Che-Wei; Hui, Enfu; Bai, Jihong; Bruns, Dieter; Chapman, Edwin R .; Jackson, Meyer B. (08.04.2015). „Strukturální role pro transmembránovou doménu Synaptobrevin 2 v pórech fúze hustých jader vezikul“. The Journal of Neuroscience. 35 (14): 5772–5780. doi:10.1523 / JNEUROSCI.3983-14.2015. ISSN 0270-6474. PMC 4388931. PMID 25855187.
- ^ Woodbury DJ, Rognlien K (2000). „Syntaxin t-SNARE je dostatečný pro spontánní fúzi synaptických vesivlů na rovinné membrány“ (PDF). Cell Biology International. 24 (11): 809–818. doi:10.1006 / cbir.2000.0631. PMID 11067766. Archivovány od originál (PDF) dne 19. 7. 2011. Citováno 2009-05-31.
- ^ Piginio a kol. 161-162
