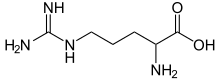
Arginin - Arginine
 | |
| Jména | |
|---|---|
| Ostatní jména Kyselina 2-amino-5-guanidinopentanová | |
| Identifikátory | |
3D model (JSmol ) |
|
| 3DMet | |
| 1725411, 1725412 R, 1725413 S | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.000.738 |
| Číslo ES |
|
| 364938 R | |
| KEGG | |
| Pletivo | Arginin |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6H14N4Ó2 | |
| Molární hmotnost | 174.204 g · mol−1 |
| Vzhled | Bílé krystaly |
| Zápach | Bez zápachu |
| Bod tání | 260 ° C; 500 ° F; 533 tis |
| Bod varu | 368 ° C (694 ° F; 641 K) |
| 14,87 g / 100 ml (20 ° C) | |
| Rozpustnost | málo rozpustný v ethanol nerozpustný v ethylether |
| log P | −1.652 |
| Kyselost (strK.A) | 2,18 (karboxyl), 9,09 (amino), 13,2 (guanidino) |
| Termochemie | |
Tepelná kapacita (C) | 232,8 J K.−1 mol−1 (při 23,7 ° C) |
Std molární entropie (S | 250,6 J K.−1 mol−1 |
Std entalpie of formace (ΔFH⦵298) | −624,9– −622,3 kJ mol−1 |
Std entalpie of spalování (ΔCH⦵298) | −3,7396– -3,7370 MJ mol−1 |
| Farmakologie | |
| B05XB01 (SZO) S | |
| Nebezpečí | |
| Bezpečnostní list | Vidět: datová stránka www.sigmaaldrich.com |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H319 | |
| P305 + 351 + 338 | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 5110 mg / kg (potkan, orálně) |
| Související sloučeniny | |
Související alkanové kyseliny | |
Související sloučeniny | |
| Stránka s doplňkovými údaji | |
| Index lomu (n), Dielektrická konstanta (εr), atd. | |
Termodynamické data | Fázové chování pevná látka - kapalina - plyn |
| UV, IR, NMR, SLEČNA | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Arginin, také známý jako l-arginin (symbol Arg nebo R),[1] je α-aminokyselina který se používá při biosyntéze bílkoviny.[2] Obsahuje α-amino skupina, α-karboxylová kyselina skupina a postranní řetězec sestávající z 3-uhlíku alifatický přímý řetěz končící a guanidino skupina. Při fyziologickém pH je karboxylová kyselina deprotonována (-CO)−), je aminoskupina protonována (-NH3+) a guanidinová skupina je také protonována za vzniku guanidiniové formy (-C- (NH2)2+), čímž se z argininu stala nabitá alifatická aminokyselina.[3] To je předchůdce pro biosyntézu oxid dusnatý. to je kódovaný podle kodony CGU, CGC, CGA, CGG, AGA a AGG.
Arginin je klasifikován jako semesenciální nebo podmíněně esenciální aminokyselina, v závislosti na vývojovém stadiu a zdravotním stavu jedince.[4] Předčasně narozené děti nejsou schopny interně syntetizovat nebo vytvářet arginin, což pro ně činí aminokyselinu nutričně nezbytnou.[5] Většina zdravých lidí nemusí arginin doplňovat, protože je součástí všech potravin obsahujících bílkoviny[6] a mohou být syntetizovány v těle z glutamin přes citrulin.[7]
Dějiny
Arginin byl poprvé izolován v roce 1886 z žlutý vlčí bob sazenice německého chemika Ernst Schulze a jeho asistent Ernst Steiger.[8][9] Pojmenoval to z řečtiny árgyros (ἄργυρος) znamená „stříbro“ kvůli stříbřitě bílému vzhledu krystalů dusičnanu argininu.[10] V roce 1897 určili Schulze a Ernst Winterstein (1865–1949) strukturu argininu.[11] Schulze a Winterstein syntetizovali arginin z ornitin a kyanamid v roce 1899,[12] ale určité pochybnosti o struktuře argininu přetrvávaly[13] dokud Sørensen syntéza z roku 1910.[14]
Zdroje
Výroba
Tradičně se získává hydrolýzou různých levných zdrojů bílkovin, jako je např želatina.[15] Komerčně se získává fermentací. Tímto způsobem lze vyrobit 25-35 g / litr za použití glukózy jako zdroje uhlíku.[16]
Zdroje stravy
Arginin je podmíněně esenciální aminokyselina u lidí a hlodavců,[17] jak to může být vyžadováno v závislosti na zdravotním stavu nebo životním cyklu jedince. Například zatímco zdraví dospělí mohou uspokojovat své vlastní požadavky na arginin, nezralí a rychle rostoucí jedinci vyžadují arginin ve své stravě,[18] a je také nezbytné při fyziologickém stresu, například při zotavení z popálenin, zranění a sepse,[18] nebo když tenké střevo a ledviny, které jsou hlavními místy biosyntézy argininu, byly poškozeny.[17] Je to však pro ptáky esenciální aminokyselina, protože nemají močovinový cyklus.[19] U některých masožravců, například koček, psů[20] a fretky, arginin je nezbytný,[17] protože po jídle jsou velmi efektivní proteinový katabolismus vyrábí velké množství amoniak které je třeba zpracovat močovinovým cyklem, a pokud není přítomen dostatek argininu, může být výsledná toxicita amoniaku smrtelná.[21] V praxi to není problém, protože maso obsahuje dostatek argininu, aby se této situaci zabránilo.[21]
Mezi živočišné zdroje argininu patří maso, mléčné výrobky a vejce,[22][23] a rostlinné zdroje zahrnují semena všech druhů, například zrna, fazole a ořechy.[23]
Biosyntéza
Arginin je syntetizován z citrulin v metabolismus argininu a prolinů sekvenčním působením cytosolických enzymů argininosukcinát syntetáza a argininosukcinát lyáza. Jedná se o energeticky nákladný proces, protože pro každou molekulu argininosukcinát která je syntetizována, jedna molekula adenosintrifosfát (ATP) se hydrolyzuje na adenosinmonofosfát (AMP), konzumující dva ekvivalenty ATP.
Citrulin lze odvodit z několika zdrojů:
- ze samotného argininu prostřednictvím syntáza oxidu dusnatého, jako vedlejší produkt výroby oxidu dusnatého pro signalizace účely
- z ornitin prostřednictvím rozpadu prolin nebo glutamin /glutamát
- z asymetrický dimethylarginin přes DDAH
Cesty spojující arginin, glutamin, a prolin jsou obousměrné. Čisté využití nebo produkce těchto aminokyselin tedy velmi závisí na typu buňky a vývojovém stadiu.

Na celém těle dochází k syntéze argininu hlavně prostřednictvím intestinální-renální osy: epitelové buňky z tenké střevo vyrábět citrulin, zejména z glutamin a glutamát, který je veden v krevním řečišti do buňky proximálního tubulu z ledviny, které extrahují citrulin z oběhu a přeměňují ho na arginin, který se vrací do oběhu. To znamená, že zhoršená funkce tenkého střeva nebo ledvin může snížit syntézu argininu a zvýšit stravovací požadavky.
Syntéza argininu z citrulinu se také vyskytuje na nízké úrovni v mnoha jiných buňkách a buněčná kapacita pro syntézu argininu může být výrazně zvýšena za okolností, které zvyšují produkci indukovatelný NOS. To umožňuje, aby byl citrulin, vedlejší produkt produkce oxidu dusnatého katalyzovaný NOS, recyklován na arginin cestou známou jako cesta citrulin-NO nebo arginin-citrulin. To dokazuje skutečnost, že v mnoha typech buněk může být syntéza NO do určité míry podporována citrulinem, nejen argininem. Tato recyklace však není kvantitativní, protože citrulin se hromadí v buňkách produkujících NO spolu s dusičnan a dusitany, stabilní konečné produkty rozkladu NO.[24]
Funkce
Arginin hraje důležitou roli v buněčné dělení, hojení ran odstranění amoniaku z těla, imunitní funkce,[25] a uvolňování hormonů.[4][26][27] Je předchůdcem syntézy oxid dusnatý (NE),[28] což je důležité při regulaci krevní tlak.[29][30][31]
Proteiny
Argininův postranní řetězec je amfipatický, protože při fyziologickém pH obsahuje pozitivně nabitou guanidiniovou skupinu, která je na konci hydrofobní vysoce polární alifatický uhlovodíkový řetězec. Protože globulární proteiny mají hydrofobní vnitřky a hydrofilní povrchy,[32] arginin se obvykle nachází na vnější straně proteinu, kde hydrofilní skupina hlav může interagovat s polárním prostředím, například účastnit se vodíkové vazby a solné mosty.[33] Z tohoto důvodu se často vyskytuje na rozhraní mezi dvěma proteiny.[34] Alifatická část postranního řetězce někdy zůstává pod povrchem proteinu.[33]
Argininové zbytky v bílkovinách mohou být sníženy pomocí PAD enzymů za vzniku citrulinu, v a posttranslační modifikace proces volal citrulinace To je důležité při vývoji plodu, je součástí normálního imunitního procesu, stejně jako řízení genové exprese, ale je také významné u autoimunitní onemocnění.[35]:275 Další posttranslační modifikace argininu zahrnuje methylace podle bílkovin methyltransferázy.[35]:176
Předchůdce
Arginin je bezprostředním prekurzorem NO, důležité signální molekuly, která může působit jako druhý posel, stejně jako mezibuněčný posel, který reguluje vazodilataci a má také funkce v reakci imunitního systému na infekci.
Arginin je také předchůdcem močovina, ornitin, a agmatin; je nezbytný pro syntézu kreatin; a lze je také použít pro syntézu polyaminy (hlavně prostřednictvím ornitinu a v menší míře prostřednictvím agmatinu, citrulinu a glutamátu.) asymetrický dimethylarginin (ADMA), blízký příbuzný, inhibuje reakci oxidu dusnatého; proto je ADMA považován za značku pro cévní onemocnění, stejně jako L-arginin je považován za známku zdravého endotel.
Struktura

The aminokyselina postranní řetěz argininu sestává z 3-uhlíku alifatický přímý řetěz, jehož distální konec je zakryt a guanidinium skupina, která má strK.A 12,48, a proto je vždy protonován a kladně nabitý při fyziologickém pH. Kvůli časování mezi dvojnou vazbou a dusíkem osamělé páry, je kladný náboj delokalizován, což umožňuje vznik násobku Vodíkové vazby.
Výzkum
Růstový hormon
Intravenózně podávaný arginin se používá při stimulačních testech růstového hormonu[36] protože stimuluje sekreci růstový hormon.[37] Přehled klinických studií dospěl k závěru, že orální arginin zvyšuje růstový hormon, ale snižuje sekreci růstového hormonu, která je obvykle spojena s cvičením.[38] Novější studie však uvádí, že ačkoli orální arginin zvyšuje plazmatické hladiny L-arginin nezpůsobil zvýšení růstového hormonu.[39]
Vysoký krevní tlak
Metaanalýza to ukázala L-arginin snižuje krevní tlak se sdruženými odhady 5,4 mmHg pro systolický krevní tlak a 2,7 mmHg pro diastolický krevní tlak.[31]
Doplněk s l-arginin snižuje diastolický krevní tlak a prodlužuje těhotenství u žen s gestační hypertenze, včetně žen s vysokým krevním tlakem jako součást preeklampsie. Nesnížil systolický krevní tlak ani se nezlepšil váha při narození.[40]
Schizofrenie
Jak kapalinová chromatografie, tak kapalinová chromatografie / hmotnostní spektrometrické testy zjistily, že mozková tkáň zemřelého schizofrenici ukazuje změněný metabolismus argininu. Testy také potvrdily významně snížené hladiny kyseliny y-aminomáselné (GABA), ale zvýšily se agmatin koncentrace a poměr glutamát / GABA v případech schizofrenie. Regresní analýza ukázala pozitivní korelace mezi aktivitou arginázy a věkem nástupu onemocnění a mezi hladinou L-ornithinu a dobou trvání nemoci. Klastrové analýzy navíc odhalily, že L-arginin a jeho hlavní metabolity L-citrulin, L-ornithin a agmatin tvořily odlišné skupiny, které byly ve skupině schizofrenie pozměněny. Navzdory tomu je biologický základ schizofrenie stále nedostatečně pochopen, řada faktorů, jako je hyperfunkce dopaminu, glutamátergická hypofunkce, deficity GABAergic, dysfunkce cholinergního systému, citlivost na stres a narušení neurového vývoje, byla spojena s etiologií a / nebo patofyziologií nemoc.[41]
Viz také
- Arginin glutamát
- AAKG
- Kanavanin a canaline jsou toxické analogy argininu a ornithinu.
Bezpečnost
L-arginin je uznáván jako bezpečný (stav GRAS) při příjmu až 20 gramů denně.[42]
Reference
- ^ „Nomenklatura a symbolika pro aminokyseliny a peptidy“. Smíšená komise IUPAC-IUB pro biochemickou nomenklaturu. 1983. Archivovány od originál dne 9. října 2008. Citováno 5. března 2018.
- ^ Smíšená komise IUPAC-IUBMB pro biochemickou nomenklaturu. „Nomenklatura a symbolika pro aminokyseliny a peptidy“. Doporučení pro organickou a biochemickou nomenklaturu, symboly a terminologii atd. Archivováno z původního dne 29. května 2007. Citováno 2007-05-17.
- ^ Glasel JA, Deutscher MP (1995-11-20). Úvod do biofyzikálních metod pro výzkum proteinů a nukleových kyselin. Akademický tisk. p. 456. ISBN 978-0-08-053498-5.
- ^ A b Tapiero H, Mathé G, Couvreur P, Tew KD (listopad 2002). „L-arginin“. (Posouzení). Biomedicína a farmakoterapie. 56 (9): 439–445. doi:10.1016 / s0753-3322 (02) 00284-6. PMID 12481980.
- ^ Wu G, Jaeger LA, Bazer FW, Rhoads JM (srpen 2004). „Nedostatek argininu u předčasně narozených dětí: biochemické mechanismy a důsledky výživy“. (Posouzení). The Journal of Nutritional Biochemistry. 15 (8): 442–51. doi:10.1016 / j.jnutbio.2003.11.010. PMID 15302078.
- ^ "Léky a doplňky argininu". Citováno 15. ledna 2015.
- ^ Skipper, Annalynn (1998). Příručka dietetika pro enterální a parenterální výživu. Jones & Bartlett Learning. p. 76. ISBN 978-0-8342-0920-6.
- ^ Apel F (červenec 2015). „Biographie von Ernst Schulze“ (PDF). Citováno 2017-11-06.
- ^ Schulze E, Steiger E (1887). „Ueber das Arginin“ [Na argininu]. Zeitschrift für Physiologische Chemie. 11 (1–2): 43–65.
- ^ „BIOETYMOLOGIE: PŮVOD V BIO-ZDRAVOTNÍCH PODMÍNKÁCH: arginin (Arg R)“. Citováno 25. července 2019.
- ^ Schulze E, Winterstein E (září 1897). „Ueber ein Spaltungs-product des Arginins“ [Na štěpném produktu argininu]. Berichte der Deutschen Chemischen Gesellschaft (v němčině). 30 (3): 2879–2882. doi:10,1002 / cber.18970300389. Struktura argininu je uvedena na str. 2882.
- ^ Schulze E, Winterstein E (říjen 1899). „Ueber die Constitution des Arginins“ [O složení argininu]. Berichte der Deutschen Chemischen Gesellschaft (v němčině). 32 (3): 3191–3194. doi:10,1002 / cber.18990320385.
- ^ Cohen JB (1919). Organická chemie pro pokročilé, 3. část (2. vyd.). New York, New York, USA: Longmans, Green & Co. str. 140.
- ^ Sölrensen SP (leden 1910). „Über die Synthese des dl-Argininy (α-amino-δ-guanido-n-valeriansäure) und der isomeren α-Guanido-δ-amino-n-valeriansäure " [O syntéze racemického argininu (α-amino-δ-guanido-n-valerová kyselina) a izomerního a-guanido-δ-amino-n-valerová kyselina]. Berichte der Deutschen Chemischen Gesellschaft (v němčině). 43 (1): 643–651. doi:10.1002 / cber.191004301109.
- ^ Brand, E .; Sandberg, M. (1932). „Hydrochlorid d-argininu“. Org. Synth. 12: 4. doi:10.15227 / orgsyn.012.0004.
- ^ Drauz, Karlheinz; Grayson, Ian; Kleemann, Axel; Krimmer, Hans-Peter; Leuchtenberger, Wolfgang; Weckbecker, Christoph (2006). "Aminokyseliny". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a02_057.pub2.
- ^ A b C Ignarro LJ (2000-09-13). Oxid dusnatý: biologie a patobiologie. Akademický tisk. p. 189. ISBN 978-0-08-052503-7.
- ^ A b Borlase BC (1994). Enterální výživa. Jones & Bartlett Learning. p. 48. ISBN 978-0-412-98471-6.
- ^ Freedland RA, Briggs S (06.12.2012). Biochemický přístup k výživě. Springer Science & Business Media. p. 45. ISBN 9789400957329.
- ^ Nutriční požadavky psů. Národní akademie Press. 1985. s. 65. ISBN 978-0-309-03496-8.
- ^ A b Wortinger A, Burns K (06.06.2015). Řízení výživy a nemocí pro veterinární techniky a zdravotní sestry. John Wiley & Sons. p. 232. ISBN 978-1-118-81108-5.
- ^ Spano MA, Kruskall LJ, Thomas DT (2017-08-30). Výživa pro sport, cvičení a zdraví. Lidská kinetika. p. 240. ISBN 978-1-4504-1487-6.
- ^ A b Watson RR, Zibadi S (2012-11-28). Bioaktivní dietní faktory a rostlinné extrakty v dermatologii. Springer Science & Business Media. p. 75. ISBN 978-1-62703-167-7.
- ^ Morris SM (říjen 2004). "Enzymy metabolismu argininu". (Posouzení). The Journal of Nutrition. 134 (10 Suppl): 2743S – 2747S, diskuze 2765S – 2767S. doi:10.1093 / jn / 134.10.2743S. PMID 15465778.
- ^ Mauro C, Frezza C (2015-07-13). Metabolické výzvy imunitních buněk ve zdraví a nemoci. Frontiers Media SA. p. 17. ISBN 9782889196227.
- ^ Stechmiller JK, Childress B, Cowan L (únor 2005). "Doplnění argininu a hojení ran". (Posouzení). Výživa v klinické praxi. 20 (1): 52–61. doi:10.1177/011542650502000152. PMID 16207646.
- ^ Witte MB, Barbul A (2003). "Fyziologie argininu a její důsledky pro hojení ran". (Posouzení). Oprava a regenerace ran. 11 (6): 419–23. doi:10.1046 / j.1524-475X.2003.11605.x. PMID 14617280. S2CID 21239136.
- ^ Andrew PJ, Mayer B (srpen 1999). "Enzymatická funkce syntáz oxidu dusnatého". (Posouzení). Kardiovaskulární výzkum. 43 (3): 521–31. doi:10.1016 / S0008-6363 (99) 00115-7. PMID 10690324.
- ^ Gokce N (říjen 2004). "L-arginin a hypertenze". The Journal of Nutrition. 134 (10 doplňků): 2807S – 2811S, diskuse 2818S – 2819S. doi:10.1093 / jn / 134.10.2807S. PMID 15465790.
- ^ Rajapakse NW, De Miguel C, Das S, Mattson DL (prosinec 2008). „Exogenní L-arginin zlepšuje hypertenzi a poškození ledvin u potkanů vyvolanou angiotensinem II“. (hlavní). Hypertenze. 52 (6): 1084–90. doi:10.1161 / HYPERTENSIONAHA.108.114298. PMC 2680209. PMID 18981330.
- ^ A b Dong JY, Qin LQ, Zhang Z, Zhao Y, Wang J, Arigoni F, Zhang W (prosinec 2011). „Efekt orálního doplňování L-argininu na krevní tlak: metaanalýza randomizovaných, dvojitě zaslepených, placebem kontrolovaných studií“. Posouzení. American Heart Journal. 162 (6): 959–65. doi:10.1016 / j.ahj.2011.09.012. PMID 22137067.
- ^ Mathews CK, Van Holde KE, Ahern KG (2000). Biochemie (3. vyd.). San Francisco, Kalifornie: Benjamin Cummings. str.180. ISBN 978-0805330663. OCLC 42290721.
- ^ A b Barnes MR (2007-04-16). Bioinformatika pro genetiky: Bioinformatický základ pro analýzu genetických dat. John Wiley & Sons. p. 326. ISBN 9780470026199.
- ^ Kleanthous C (2000). Rozpoznávání proteinů a proteinů. Oxford University Press. p. 13. ISBN 9780199637607.
- ^ A b Griffiths JR, Unwin RD (2016-10-12). Analýza posttranslačních modifikací proteinů hmotnostní spektrometrií. John Wiley & Sons. ISBN 9781119250883.
- ^ Americká národní lékařská knihovna (září 2009 Test stimulace růstového hormonu
- ^ Alba-Roth J, Müller OA, Schopohl J, von Werder K (prosinec 1988). „Arginin stimuluje sekreci růstového hormonu potlačením sekrece endogenního somatostatinu“. The Journal of Clinical Endocrinology and Metabolism. 67 (6): 1186–9. doi:10.1210 / jcem-67-6-1186. PMID 2903866. S2CID 7488757.
- ^ Kanaley JA (leden 2008). "Růstový hormon, arginin a cvičení". Aktuální názor na klinickou výživu a metabolickou péči. 11 (1): 50–4. doi:10.1097 / MCO.0b013e3282f2b0ad. PMID 18090659. S2CID 22842434.
- ^ Forbes SC, Bell GJ (červen 2011). „Akutní účinky nízké a vysoké dávky orálního doplňování L-argininu u mladých aktivních mužů v klidu“. Aplikovaná fyziologie, výživa a metabolismus. 36 (3): 405–11. doi:10.1139 / h11-035. PMID 21574873.
- ^ Gui S, Jia J, Niu X, Bai Y, Zou H, Deng J, Zhou R (březen 2014). „Suplementace argininu pro zlepšení výsledků u matek a novorozenců u hypertenzní poruchy těhotenství: systematický přehled“. (Posouzení). Journal of the Renin-Angiotensin-Aldosterone System. 15 (1): 88–96. doi:10.1177/1470320313475910. PMID 23435582.
- ^ Liu, P; Jing, Y; Collie, ND; Dean, B; Bilkey, DK; Zhang, H (16. srpna 2016). „Změněný metabolismus argininu v mozku u schizofrenie“. Translační psychiatrie. 6 (8): e871. doi:10.1038 / tp.2016.144. PMC 5022089. PMID 27529679.
- ^ Shao A, Hathcock JN (duben 2008). "Hodnocení rizik pro aminokyseliny taurin, L-glutamin a L-arginin". Regulační toxikologie a farmakologie. 50 (3): 376–99. doi:10.1016 / j.yrtph.2008.01.004. PMID 18325648.

