MAPK fosfatáza - MAPK phosphatase
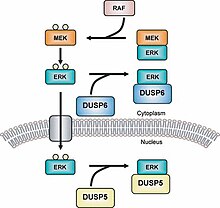
MAPK fosfatázy (MKP) jsou největší třídou fosfatázy podílí se na regulaci dolů Mitogenem aktivované proteinové kinázy (MAPK) signalizace.[1][2] MAPK signální dráhy regulovat více funkcí rozvoj a homeostáza.[3][4] To může zahrnovat regulaci genů, buněčnou proliferaci, programovanou buněčnou smrt a stresové reakce.[5] Fosfatázy MAPK jsou proto důležitými regulačními složkami těchto cest.
Funkce

Fosfatázy MAPK se nacházejí pouze v eukaryoty a negativně regulovat MAP kinázy působit jako negativní zpětná vazba.[5] MKP jsou také známé jako fosfatázy s dvojí specificitou (DUSP)[6] protože deaktivují MAPK o defosforylační the Threonin a Tyrosin zbytky nacházející se v aktivačním místě MAPK.[7] MKP mají katalytická oblast na jejich C-konec a a regulační oblast na jejich N-konec.[8] Poloha, kde se MAPK váže na MKP, se nachází poblíž N-konce MKP. Vazba je způsobena elektrostatické interakce pozitivně nabitých zbytků na vazebné části MKP se záporně nabitými zbytky na vazebném místě MAPK.[9]
Klasifikace
Je jich 10[10] hlavní MKP, které lze dále rozdělit do tří podtříd, které jsou reprezentativní buď pro jejich genomová struktura nebo typ Podklad (MAPK), na které se vážou.[11] Patří mezi ně DUSP1, DUSP2, DUSP4 a DUSP5, které patří do podskupiny 1. DUSP6, DUSP7, DUSP9 a DUSP10 patří do podskupiny 2. DUSP8 a DUSP16 patří do podskupiny 3, tyto podskupiny jsou založeny na genomické struktuře MKP.[12] Nejnovější MKP-8 přináší celkový počet MKP na 11, MKP-8 hraje roli při inhibici kinázy p38.[13]
Fosfatázy s dvojí specificitou (DUSP) také patří do rodiny proteinové tyrosin fosfatázy.[14] MKP jsou seskupeny do typu I, II a III; ve kterém jsou MKP typu I umístěny v jaderná oblast, typu II jsou umístěny v cytoplazmatický region a typ III jsou lokalizovány v jaderné i cytoplazmatické oblasti.[15] Různá umístění těchto tří typů MKP umožňují, aby způsobovaly různé typy signalizace. Například MKP-1 (typ I MKP) řídí genovou expresi inaktivací subcelulární skupiny MAPK.[16] Všimněte si, že bez motivu LXXLL (GFP-MKP-147-367) MKP-1 se nemůže lokalizovat uvnitř jádra a je před doménou CH2A.[17] Nejnovější MKP, MKP-8, patří do skupiny I, protože se nachází v jaderné oblasti buňky[18] Nedávná studie ukazuje, že izoformy histon-deacetylázy (HDAC1, -2 a -3) deacetylát MKP-1 a že tohle posttranslační modifikace zvyšuje signalizaci MAPK a vrozená imunita signalizace.[19]
Ačkoli N-koncová oblast je zcela odlišná mezi každým MKP, všechny normálně obsahují CH2 domény.[20] V MKP-1 se MAPK váže na aktivní místo, které je mezi doménami CH2A a CHB umístěnými na N-konci.[21][22]
Příkladem MKP typu II je MKP-3 , který reguluje činnost ERK2 podle deforylovat a drží ji v cytoplazmatické oblasti.[23] MKP-3 se také váže na ERK2 bez ohledu na to, zda je fosforylován nebo ne.[24] MKP-4 je další MKP, který patří k typu I a je odlišný od ostatních MKP v této podskupině, protože se nachází pouze v placentě, ledvinách a embryonálních jaterních buňkách.[25] MKP-5 je MKP typu III, který se specificky váže na str a SPK /JNK a nachází se v cytoplazmatické i jaderné oblasti buňky.[26] MKP-5 se nachází pouze v buňkách srdce, plic, jater, ledvin a kosterního svalstva.[27]Existují také MKP, které patří do skupiny zvané Atypické MKP. Například vakcína související s vakcínou H1 (VHR) je atypický MKP, protože má pouze oblast DUSP.[28] VHR se nachází pouze v lymfoidní a krvetvorné buňky a deaktivuje ERK1 /2 a JNK v Receptory T-buněk.[29] VHR také indukuje buněčný cyklus zatknout.[30][31]
| název | Alt. název | Podskupina |
|---|---|---|
| DUSP1 | MKP-1 | Já |
| DUSP2 | Já | |
| DUSP4 | MKP-2 | Já |
| DUSP5 | Já | |
| DUSP6 | MKP-3 | II |
| DUSP7 | II | |
| DUSP8 | III | |
| DUSP9 | MKP-4 | II |
| DUSP10 | MKP-5 | ? |
| DUSP14 | MKP-6 | ? |
| DUSP16 | MKP-7 | III |
| DUSP26 | MKP-8 | Já |
Reference
- ^ MAPK + fosfatázy v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- ^ Dickinson, Robin J .; Keyse, Stephen M. (15. listopadu 2006). „Různé fyziologické funkce pro dvojí specificitu MAP kinázových fosfatáz“. J Cell Sci. 119 (22): 4607–4615. doi:10.1242 / jcs.03266. PMID 17093265.
- ^ Caunt, Christopher J .; Keyse, Stephen M. (leden 2013). „Dual-specificity MAP kinase phosphatase (MKPs)“. FEBS Journal. 280 (2): 489–504. doi:10.1111 / j.1742-4658.2012.08716.x. PMC 3594966. PMID 22812510.
- ^ Nízká, Heng Boon; Zhang, Yongliang (2016). „Regulační role fosfatáz MAPK v rakovině“. Imunitní síť. 16 (2): 85–98. doi:10.4110 / v 2016.16.2.85. PMC 4853501. PMID 27162525.
- ^ A b Chang, Lufen; Karin, Michael (1. března 2001). "Savčí signalizační kaskády MAP kinázy". Příroda. 410 (6824): 37–40. doi:10.1038/35065000. PMID 11242034.
- ^ Comalada, Mònica; Lloberas, Jorge; Celada, Antonio (1. srpna 2012). „MKP-1: Kritická fosfatáza v biologii makrofágů kontrolujících přechod mezi proliferací a aktivací“. European Journal of Immunology. 42 (8): 1938–1948. doi:10.1002 / eji.201242441. PMID 22865045.
- ^ Kondoh, Kunio; Nishida, Eisuke (1. srpna 2007). "Regulace MAP kináz pomocí MAP kinázových fosfatáz". Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1773 (8): 1227–1237. doi:10.1016 / j.bbamcr.2006.12.002. PMID 17208316.
- ^ Dickinson, Robin J .; Keyse, Stephen M. (15. listopadu 2006). „Různé fyziologické funkce pro dvojí specificitu MAP kinázových fosfatáz“. J Cell Sci. 119 (22): 4607–4615. doi:10.1242 / jcs.03266. PMID 17093265.
- ^ Theodosiou, Aspasia; Ashworth, Alan (1. ledna 2002). "MAP kinázové fosfatázy". Genome Biology. 3 (7): reviews3009.1 – reviews3009.10. doi:10.1186 / gb-2002-3-7-reviews3009. ISSN 1465-6906. PMC 139386. PMID 12184814.
- ^ Caunt, Christopher J; Keyse, Stephen M. (7. listopadu 2016). „Dual-specificity MAP kinase fosfatázy (MKP)“. Časopis FEBS. 280 (2): 489–504. doi:10.1111 / j.1742-4658.2012.08716.x. ISSN 1742-464X. PMC 3594966. PMID 22812510.
- ^ Theodosiou, Aspasia; Ashworth, Alan (1. ledna 2002). "MAP kinázové fosfatázy". Genome Biology. 3 (7): reviews3009.1 – reviews3009.10. doi:10.1186 / gb-2002-3-7-reviews3009. PMC 139386. PMID 12184814.
- ^ Theodosiou, Aspasia; Ashworth, Alan (1. ledna 2002). "MAP kinázové fosfatázy". Genome Biology. 3 (7): reviews3009.1 – reviews3009.10. doi:10.1186 / gb-2002-3-7-reviews3009. PMC 139386. PMID 12184814.
- ^ Vasudevan, Sanjeev A .; Skoko, John; Wang, Kuan; Burlingame, Susan M .; Patel, Parul N .; Lazo, John S .; Nuchtern, Jed G .; Yang, Jianhua (6. května 2005). „MKP-8, nová MAPK fosfatáza, která inhibuje kinázu p38“. Sdělení o biochemickém a biofyzikálním výzkumu. 330 (2): 511–518. doi:10.1016 / j.bbrc.2005.03.028. PMID 15796912.
- ^ Jeffrey, Kate L .; Kempy, Montserrat; Rommel, Christian; Mackay, Charles R. (květen 2007). "Cílení na dvojí specificitu fosfatáz: manipulace signalizace MAP kinázy a imunitní reakce". Recenze přírody Objev drog. 6 (5): 391–403. doi:10.1038 / nrd2289. PMID 17473844.
- ^ Kondoh, Kunio; Nishida, Eisuke (1. srpna 2007). "Regulace MAP kináz pomocí MAP kinázových fosfatáz". Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1773 (8): 1227–1237. doi:10.1016 / j.bbamcr.2006.12.002. PMID 17208316.
- ^ Wu, J. J .; Zhang, L .; Bennett, A. M. (16. května 2005). „Nekatalytický aminokyselinový konec mitogenem aktivované proteinkinázy fosfatázy 1 řídí nukleární cílení a regulaci transkripce prvku sérových reakcí“. Molekulární a buněčná biologie. 25 (11): 4792–4803. doi:10.1128 / MCB.25.11.4792-4803.2005. PMC 1140620. PMID 15899879.-
- ^ Wu, J. J .; Zhang, L .; Bennett, A. M. (16. května 2005). „Nekatalytický aminokyselinový konec mitogenem aktivované proteinkinázy fosfatázy 1 řídí nukleární cílení a regulaci transkripce prvku sérových reakcí“. Molekulární a buněčná biologie. 25 (11): 4792–4803. doi:10.1128 / MCB.25.11.4792-4803.2005. PMC 1140620. PMID 15899879.
- ^ Vasudevan, Sanjeev A .; Skoko, John; Wang, Kuan; Burlingame, Susan M .; Patel, Parul N .; Lazo, John S .; Nuchtern, Jed G .; Yang, Jianhua (6. května 2005). „MKP-8, nová MAPK fosfatáza, která inhibuje kinázu p38“. Sdělení o biochemickém a biofyzikálním výzkumu. 330 (2): 511–518. doi:10.1016 / j.bbrc.2005.03.028. PMID 15796912.
- ^ Jeong, Y; Du, R; Zhu, X (2014). „Izoformy histon-deacetylázy regulují vrozené imunitní odpovědi deacetylací mitogenem aktivované protein kinázy fosfatázy-1“. J. Leukoc Biol. 95 (4): 651–9. doi:10.1189 / jlb.1013565. PMID 24374966.
- ^ Wu, JJ; Zhang, L; Bennett, AM (2005). „Nekatalytický aminokyselinový terminál mitogenem aktivované proteinkinázy fosfatázy 1 řídí nukleární cílení a regulaci transkripce prvkem odezvy na sérum“. Molekulární a buněčná biologie. 25 (11): 4792–4803. doi:10.1128 / MCB.25.11.4792-4803.2005. PMC 1140620. PMID 15899879.
- ^ Wu, J. J .; Zhang, L .; Bennett, A. M. (16. května 2005). „Nekatalytický aminokyselinový terminál mitogenem aktivované proteinkinázy fosfatázy 1 řídí nukleární cílení a regulaci transkripce prvkem odezvy na sérum“. Molekulární a buněčná biologie. 25 (11): 4792–4803. doi:10.1128 / MCB.25.11.4792-4803.2005. PMC 1140620. PMID 15899879.
- ^ BARDWELL, A. Jane; ABDOLLAHI, Mahsa; BARDWELL, Lee (15. března 2003). „Dokovací místa na mitogenem aktivovaných protein kinázách (MAPK), MAPK fosfatázách a transkripčním faktoru Elk-1 soutěží o vazbu MAPK a jsou zásadní pro enzymatickou aktivitu“. Biochemical Journal. 370 (3): 1077–1085. doi:10.1042 / BJ20021806. PMC 1223246. PMID 12529172.
- ^ Karlsson, Maria; Mathers, Joanne; Dickinson, Robin J .; Mandl, Margret; Keyse, Stephen M. (1. října 2004). „Jaderná cytoplazmatická shoda fosfatázy MKP-3 s dvojí specificitou i její schopnost ukotvit MAP kinázu v cytoplazmě jsou zprostředkovány konzervovaným jaderným exportním signálem“. Journal of Biological Chemistry. 279 (40): 41882–41891. doi:10,1074 / jbc.M406720200. ISSN 0021-9258. PMID 15269220.
- ^ Camps, M. (22. května 1998). "Katalytická aktivace fosfatázy MKP-3 pomocí ERK2 mitogenem aktivované protein kinázy". Věda. 280 (5367): 1262–1265. doi:10.1126 / science.280.5367.1262. PMID 9596579.
- ^ Muda, M .; Boschert, U .; Smith, A .; Antonsson, B .; Gillieron, C .; Chabert, C .; Camps, M .; Martinou, I .; Ashworth, A .; Arkinstall, S. (21. února 1997). "Molekulární klonování a funkční charakterizace nové mitogenem aktivované proteinkinázové fosfatázy, MKP-4". Journal of Biological Chemistry. 272 (8): 5141–5151. doi:10.1074 / jbc.272.8.5141. PMID 9030581.
- ^ Tanoue, T. (9. července 1999). „Molekulární klonování a charakterizace nové fosfatázy s dvojí specificitou, MKP-5“. Journal of Biological Chemistry. 274 (28): 19949–19956. doi:10.1074 / jbc.274.28.19949. PMID 10391943.
- ^ Kondoh, Kunio; Nishida, Eisuke (1. srpna 2007). "Regulace MAP kináz pomocí MAP kinázových fosfatáz". Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1773 (8): 1227–1237. doi:10.1016 / j.bbamcr.2006.12.002. PMID 17208316.
- ^ Kondoh, Kunio; Nishida, Eisuke (1. srpna 2007). "Regulace MAP kináz pomocí MAP kinázových fosfatáz". Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1773 (8): 1227–1237. doi:10.1016 / j.bbamcr.2006.12.002. PMID 17208316.
- ^ Alonso, A .; Saxena, M .; Williams, S .; Mustelin, T. (20. listopadu 2000). „Inhibiční role pro dvojí specificitu fosfatázy VHR v receptoru antigenu T buněk a aktivaci Erk a Jnk vyvolanou CD28“. Journal of Biological Chemistry. 276 (7): 4766–4771. doi:10,1074 / jbc.M006497200. PMID 11085983.
- ^ Rahmouni, Souad; Cerignoli, Fabio; Alonso, Andres; Tsutji, Toshiya; Henkens, Rachel; Zhu, Changjun; Louis-dit-Sully, Christine; Moutschen, Michel; Jiang, Wei; Mustelin, Tomas (9. dubna 2006). „Ztráta VHR s dvojí specifickou fosfatázou způsobuje zastavení cyklu buněk a stárnutí“. Přírodní buněčná biologie. 8 (5): 524–531. doi:10.1038 / ncb1398. PMID 16604064.
- ^ Rahmouni, Souad; Cerignoli, Fabio; Alonso, Andres; Tsutji, Toshiya; Henkens, Rachel; Zhu, Changjun; Louis-dit-Sully, Christine; Moutschen, Michel; Jiang, Wei; Mustelin, Tomas (1. května 2006). „Ztráta VHR duální specifické fosfatázy způsobuje zastavení buněčného cyklu a stárnutí“. Přírodní buněčná biologie. 8 (5): 524–531. doi:10.1038 / ncb1398. ISSN 1465-7392. PMID 16604064.
