Pyruvátkarboxyláza - Pyruvate carboxylase
| Pyruvátkarboxyláza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
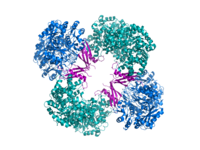
 Krystalografická struktura pyruvátkarboxylázy z Rhizobium etli: doména biotin karboxylázy (modrá); alosterická spojovací doména (zelená); doména vázající biotin (červená); a doména karboxyltransferázy (oranžová)[1] | |||||||||
| Identifikátory | |||||||||
| EC číslo | 6.4.1.1 | ||||||||
| Číslo CAS | 9014-19-1 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Pyruvátkarboxyltransferáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | PYR_CT | ||||||||
| Pfam | PF00682 | ||||||||
| InterPro | IPR000891 | ||||||||
| STRÁNKA | PDOC50991 | ||||||||
| |||||||||
| Pyruvátkarboxyláza | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | PC | ||||||
| Gen NCBI | 5091 | ||||||
| HGNC | 8636 | ||||||
| OMIM | 608786 | ||||||
| RefSeq | NM_000920 | ||||||
| UniProt | P11498 | ||||||
| Další údaje | |||||||
| EC číslo | 6.4.1.1 | ||||||
| Místo | Chr. 11 q11-q13.1 | ||||||
| |||||||
Pyruvátkarboxyláza (PC) kódovaný genem PC je enzym z ligáza třída, že katalyzuje (v závislosti na druhu) fyziologicky nevratný[Citace je zapotřebí ] karboxylace z pyruvát tvořit oxaloacetát (OAA).
Reakce, kterou katalyzuje, je:
- pyruvát + HCO−
3 + ATP → oxaloacetát + ADP + P
Je to důležité anaplerotická reakce který vytváří oxaloacetát z pyruvátu. Enzym je mitochondriální protein obsahující a biotin protetická skupina,[1] vyžadující hořčík nebo mangan a acetyl CoA.
Pyruvátkarboxyláza byla poprvé objevena v roce 1959 v Case Western Reserve University M. F. Utter a D. B. Keech.[6][7] Od té doby byl nalezen v široké škále prokaryot a eukaryot, včetně hub, bakterií, rostlin a zvířat.[8] U savců hraje PC zásadní roli v glukoneogenezi a lipogenezi, v biosyntéze neurotransmitery a v sekreci inzulínu indukované glukózou pankreatickými ostrůvky. Oxaloacetát produkovaný PC je důležitým meziproduktem, který se používá v těchto biosyntetických drahách.[9] U savců je PC exprimován tkáňově specifickým způsobem, přičemž jeho aktivita je nejvyšší v játrech a ledvinách (glukoneogenní tkáně), v tukové tkáni a kojící mléčné žláze (lipogenní tkáně) a na pankreatických ostrůvcích. Aktivita je v mozku, srdci a nadledvinách mírná, nejméně v bílých krvinkách a kožních fibroblastech.[10]
Struktura
Strukturální studie PC byly provedeny elektronová mikroskopie omezeně proteolýza a klonováním a sekvenováním genů a cDNA kódujících enzym. Nejvíce dobře charakterizované formy aktivního PC se skládají ze čtyř identických podjednotek uspořádaných do čtyřstěnné struktury. Každá podjednotka obsahuje jednu biotin skupina fungující jako kyvné rameno k přepravě oxid uhličitý na katalytické místo, které se tvoří na rozhraní mezi sousedními monomery. Každá podjednotka funkčního tetrameru obsahuje čtyři domény: doménu biotin karboxylace (BC), doménu transkarboxylace (CT), doménu biotin karboxylového nosiče (BCCP) a nedávno označenou doménu PC tetramerizace (PT).[11][12] Ze dvou nejkompletnějších dostupných krystalických struktur byla vizualizována asymetrická a symetrická forma proteinu.[13] The Zlatý stafylokok tetramer v komplexu s aktivátorovým koenzymem A je vysoce symetrický, má 222 symetrii a byl potvrzen studiemi kryo-EM.[12] Naproti tomu Rhizobium etli tetramer v komplexu s ethyl-CoA, nehydrolyzovatelným analogem acetyl-CoA, má pouze jednu linii symetrie.[13]
Pyruvátkarboxyláza používá kovalentně vázané biotin kofaktor, který se používá ke katalýze ATP - závislá karboxylace pyruvátu na oxaloacetát ve dvou krocích. Biotin je zpočátku karboxylován na aktivním místě BC pomocí ATP a hydrogenuhličitanu. Karboxylová skupina je následně přenesena karboxybiotinem na druhé aktivní místo v doméně CT, kde je pyruvát karboxylován za vzniku oxaloacetátu. Doména BCCP přenáší uvázaný kofaktor mezi dvěma vzdálenými aktivními místy. Alosterické vazebné místo v PC nabízí cíl pro modifikátory aktivity, které mohou být užitečné při léčbě obezity nebo cukrovky typu II, a mechanistické poznatky získané z úplného strukturálního popisu RePC (R. etli) umožňují podrobné vyšetřování jednotlivce katalytická a regulační místa enzymu.[13]
Reakční mechanismus

(A) ATP závislá karboxylace biotinu (BC doména);
(B) Transkarboxylace pyruvátu (doména CT).
Reakční mechanismus lze rozdělit na dvě dílčí reakce (viz obrázek vpravo). V první reakci ATP je karboxylován za vzniku anhydridu kyseliny fosforečné uhličité [−Ó(−O) P (= O) O – C (= O) O−] který zase karboxyláty a biotin kofaktor, který je kovalentně připojen k lysinovému zbytku domény BCCP.[8] Anhydrid kyseliny fosforečné se rozkládá na oxid uhličitý a fosforečnan před útokem molekuly biotinu vázaného na enzym. U většiny druhů tato reakce vyžaduje acetyl-CoA jako alosterický aktivátor vázající se na doménu PT.[12] Ve druhé reakci, ke které dochází v doméně CT sousedního monomeru, je oxid uhličitý přenesen do akceptorové molekuly, pyruvátu, za vzniku oxaloacetátu. Reakce probíhá odstraněním protonu z pyruvátu, dosud neidentifikovaným zbytkem aktivního místa, za vzniku izolovat středně pokročilí. Enolátový meziprodukt poté zaútočí na CO2 přechodně uvolněné z molekuly biotinu vázaného na enzym. Výsledek oxaloacetát je vydáno. Molekula biotinu je protonována výše uvedeným zbytkem aktivního místa a uvolněna z aktivního místa domény CT, která má být rekarboxylována.[12][13] Hlavní regulátor aktivity enzymu, acetyl-CoA, stimuluje štěpení ATP v první částečné reakci a také se ukázalo, že indukuje konformační změnu tetramerní struktury enzymu.[9]
Funkce
V době glukoneogeneze pyruvátkarboxyláza se podílí na syntéze fosfoenolpyruvát (PEP) z pyruvát. Pyruvát se nejprve převede pyruvátkarboxylázou na oxaloacetát (OAA) v mitochondrii vyžadující hydrolýza jedné molekuly ATP. OAA je poté dekarboxylován a současně fosforylován, což je katalyzováno jednou ze dvou izoforem fosfoenolpyruvátkarboxykináza (PEPCK) buď v cytosol nebo v mitochondrie vyrábět PEP. Za běžných glukoneogenních podmínek se OAA převádí na PEP mitochondriálním PEPCK; výsledný PEP je poté transportován z mitochondriální matrice systémem transportéru aniontů,[14] a přeměněny na glukózu cytosolickými glukoneogenními enzymy. Během hladovění, kdy je koncentrace cytosolického NADH nízká a mitochrondriální hladiny NADH jsou vysoké, lze použít oxaloacetát jako kyvadlovou redukci ekvivalentů. Jako takový se OAA převádí na malát mitochondriální malát dehydrogenáza (MDH). Po exportu do cytosolu se malát převede zpět na OAA se současným snížením NAD+; OAA se následně převádí na PEP, který je k dispozici pro glukoneogenezi v cytosolu spolu s transportovaným redukčním ekvivalentem NADH.[1]
Velmi vysoká úroveň aktivity PC, spolu s vysokou aktivitou dalších glukoneogenních enzymů včetně PEPCK, fruktóza-1,6-bisfosfatáza a glukóza-6-fosfatáza v kůře jater a ledvin naznačují, že primární rolí PC je účast na glukoneogenezi v těchto orgánech. Během hladovění nebo hladovění, kdy je pro určité tkáně (mozek, bílé krvinky a dřeně ledvin) vyžadována endogenní glukóza, je zvýšena exprese PC a dalších glukoneogenních enzymů.[15] U potkanů a myší bylo prokázáno, že změna stavu výživy ovlivňuje jaterní aktivitu PC.[16] Půst podporuje produkci glukózy v játrech udržovanou zvýšeným tokem pyruvátu a zvýšením aktivity PC a koncentrace proteinů; diabetes podobně zvyšuje glukoneogenezi zvýšeným příjmem substrátu a zvýšeným tokem jaterním PC u myší a potkanů.[17][18] Podobně jako u jiných glukoneogenních enzymů je PC pozitivně regulován glukagon a glukokortikoidy zatímco je negativně regulován inzulín.[8] Dále podporuje klíčovou roli PC v glukoneogenezi u dojnic, které mají hexóza absorpční schopnost při odpovídajících úrovních výživy, PC a související glukoneogenní enzym PEPCK jsou výrazně zvýšeny během přechodu na laktaci při navrhované podpoře syntézy laktózy pro produkci mléka.[19]
Kromě role PC v glukoneogenezi slouží PC anaplerotický role (reakce katalyzovaná enzymy, která může doplnit přísun meziproduktů v cyklu kyseliny citronové) pro cyklus trikarboxylové kyseliny (nezbytné pro poskytnutí oxaloacetátu), pokud jsou meziprodukty odstraněny pro různé účely biosyntézy.
Kliknutím na geny, bílkoviny a metabolity níže zobrazíte odkazy na příslušné články.[§ 1]
- ^ Interaktivní mapu cest lze upravit na WikiPathways: „GlycolysisGluconeogenesis_WP534“.
Klinický význam
Jako křižovatka mezi uhlohydrát a lipid metabolismus, exprese pyruvátkarboxylázy v glukoneogenních tkáních, tukových tkáních a ostrůvcích pankreatu musí být koordinovány. V podmínkách nadměrné výživy se zvyšují hladiny PC v β-buňkách pankreatu cyklování pyruvátem v reakci na chronicky zvýšené hladiny glukóza.[20] Naproti tomu jsou hladiny PC enzymů v játrech sníženy o inzulín;[21] během období nadvýživy se tkáň adipocytů rozšiřuje s extrémní expresí PC a dalších lipogenních enzymů.[10][22] Kontrola nad hladinou glukózy v játrech je stále regulována v případě nadměrné výživy, ale u cukrovky typu 2 vyvolané obezitou již regulace periferních hladin glukózy není pod regulací inzulínu. diabetik typu 2 krysy, chronická expozice β-buňky na glukózu v důsledku periferní inzulínové rezistence vede ke snížení aktivity PC enzymů a ke snížení pyruvát cyklistika[23][24] Pokračující nadprodukce glukózy o hepatocyty způsobí dramatickou změnu genová exprese v β-buňky s velkým zvýšením normálně potlačených genů a ekvivalentním snížením exprese mRNA pro inzulín, iontové pumpy nezbytné pro sekreci inzulínu a metabolických enzymů souvisejících se sekrecí inzulínu, včetně pyruvátkarboxylázy[25][26] Současně se v tukové tkáni vyvíjí inzulínová rezistence, která způsobuje akumulaci triaglycerolů a neesterifikovaných látek mastné kyseliny v oběhu; tyto nejen dále zhoršují funkci β-buněk,[26][27] ale také další snížení PC exprese.[28][29] Tyto změny mají za následek pokles β-buňka fenotyp u dekompenzovaného diabetu.
A nedostatek pyruvátkarboxylázy může způsobit laktátová acidóza jako výsledek laktát vybudovat.[30] Normálně přebytek pyruvát je posunut do glukoneogeneze přeměnou pyruvátu na oxaloacetát, ale kvůli nedostatku enzymu se přebytečný pyruvát přeměňuje na laktát namísto. Jako klíčová role glukoneogeneze je v udržování krevní cukr může také vést k deficitu pyruvátkarboxylázy hypoglykémie.
Viz také
Reference
- ^ A b C PDB: 2QF7; Jitrapakdee S, St Maurice M, Rayment I, Cleland WW, Wallace JC, Attwood PV (srpen 2008). "Struktura, mechanismus a regulace pyruvátkarboxylázy". Biochem. J. 413 (3): 369–87. doi:10.1042 / BJ20080709. PMC 2859305. PMID 18613815.
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000173599 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000024892 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Utter MF, Keech DB (květen 1960). "Tvorba oxaloacetátu z pyruvátu a oxidu uhličitého". J. Biol. Chem. 235: PC17–8. PMID 13840551.
- ^ Cohen ND, Beegen H, Utter MF, Wrigley NG (březen 1979). „Opětovné vyšetření elektronového mikroskopu vzhledu pyruvátkarboxylázy z kuřecích jater“. J. Biol. Chem. 254 (5): 1740–7. PMID 762171.
- ^ A b C Jitrapakdee S, Vidal-Puig A, Wallace JC (duben 2006). "Anaplerotické role pyruvátkarboxylázy v savčích tkáních". Buňka. Mol. Life Sci. 63 (7–8): 843–54. doi:10.1007 / s00018-005-5410-r. PMID 16505973. S2CID 850667.
- ^ A b Jitrapakdee S, Nezic MG, Cassady AI, Khew-Goodall Y, Wallace JC (červenec 2002). "Molekulární klonování a doménová struktura kuřecí pyruvátkarboxylázy". Biochem. Biophys. Res. Commun. 295 (2): 387–93. doi:10.1016 / S0006-291X (02) 00651-4. PMID 12150961.
- ^ A b Jitrapakdee S, Walker ME, Wallace JC (červen 1996). „Identifikace nových alternativně sestřižených mRNA pyruvátkarboxylázy s divergentními 5'-nepřekládanými oblastmi, které jsou exprimovány tkáňově specifickým způsobem“. Biochem. Biophys. Res. Commun. 223 (3): 695–700. doi:10.1006 / bbrc.1996.0958. PMID 8687459.
- ^ Kondo S, Nakajima Y, Sugio S, Yong-Biao J, Sueda S, Kondo H (březen 2004). "Struktura podjednotky biotinkarboxylázy pyruvátkarboxylázy z Aquifex aeolicus při rozlišení 2,2". Acta Crystallogr. D. 60 (Pt 3): 486–92. doi:10.1107 / S0907444904000423. PMID 14993673.
- ^ A b C d Yu LP, Xiang S, Lasso G, Gil D, Valle M, Tong L (červen 2009). "Symetrický tetramer pro S. aureus pyruvátkarboxylázu v komplexu s koenzymem A". Struktura. 17 (6): 823–32. doi:10.1016 / j.str.2009.04.008. PMC 2731552. PMID 19523900.
- ^ A b C d St Maurice M, Reinhardt L, Surinya KH, Attwood PV, Wallace JC, Cleland WW, Rayment I (srpen 2007). "Doménová architektura pyruvátkarboxylázy, biotin-dependentního multifunkčního enzymu". Věda. 317 (5841): 1076–9. doi:10.1126 / science.1144504. PMID 17717183. S2CID 34738991.
- ^ Stark R, Pasquel F, Turcu A a kol. (2009). „Cyklus fosfoenolpyruvátu prostřednictvím mitochondriální fosfoenolpyruvátkarboxykinázy spojuje anaplerózu a mitochondriální GTP se sekrecí inzulínu“. Journal of Biological Chemistry. 284 (39): 26578–26590. doi:10.1074 / jbc.M109.011775. PMC 2785346. PMID 19635791.
- ^ Rothman DL, Magnusson I, Katz LD, Shulman RG, Shulman GI (říjen 1991). "Kvantifikace jaterní glykogenolýzy a glukoneogeneze u lidí nalačno s 13C NMR". Věda. 254 (5031): 573–6. doi:10.1126 / science.1948033. PMID 1948033.
- ^ Bizeau ME, Short C, Thresher JS, Commerford SR, Willis WT, Pagliassotti MJ (2001). „Zvýšená kapacita toku pyruvátu odpovídá za zvýšení glukoneogeneze vyvolané dietou in vitro". Dopoledne. J. Physiol. Regul. Integr. Comp. Physiol. 281 (2): R427 – R433. doi:10.1152 / ajpregu.2001.281.2.R427. PMID 11448844.
- ^ Salto R, Sola M, Olicer FJ, Vargas AM (prosinec 1996). "Účinky hladovění, cukrovky a intoxikace tetrachlormethanem na krysí ledvinovou kůru a jaterní pyruvátkarboxylázu". Oblouk. Physiol. Biochem. 104 (7): 845–850. CiteSeerX 10.1.1.378.3073. doi:10.1076 / apab.104.7.845.13111. PMID 9127680.
- ^ Large V, Beylot M (červen 1999). "Modifikace aktivity cyklu kyseliny citronové a glukoneogeneze u strepozotocinu vyvolaného diabetu a účinků metforminu". Cukrovka. 48 (6): 1251–1257. doi:10.2337 / diabetes.48.6.1251. PMID 10342812.
- ^ Greenfield RB, Cecava MJ, Donkin SS (2002). „Změny v expresi mRNA pro glukoneogenní enzymy v játrech skotu během přechodu na laktaci“. Journal of Dairy Science. 83 (6): 1228–1236. doi:10.3168 / jds.S0022-0302 (00) 74989-7. PMID 10877388.
- ^ Liu YQ, Han J, Epstein PN, Long YS (prosinec 2005). „Enhanced rat β-cell proliferation in 60% pancreatectomized ostrůvků zvýšeným metabolickým tokem glukózy cestou pyruvátkarboxylázy“. Dopoledne. J. Physiol. Endokrinol. Metab. 288 (3): E471 – E478. doi:10.1152 / ajpendo.00427.2004. PMID 15507531.
- ^ Desvergne B, Michalik L, Wahli W (duben 2006). "Transkripční regulace metabolismu". Physiol. Rev. 86 (2): 465–514. doi:10.1152 / physrev.00025.2005. PMID 16601267.
- ^ Lynch CJ, McCall KM, Billingsley ML, Bohlen LM, Hreniuk SP, Martin LF, Witters LA, Vannucci SJ (květen 1992). "Pyruvátkarboxyláza v genetické obezitě". Dopoledne. J. Physiol. 262 (5 Pt 1): E608 – E618. doi:10.1152 / ajpendo.1992.262.5.E608. PMID 1375435.
- ^ MacDonald MJ, Tang J, Polonsky KS (listopad 1996). „Nízko mitochondriální glycerolfosfátdehydrogenáza a pyruvátkarboxyláza v pankreatických ostrůvcích diabetických mastných potkanů Zucker“. Cukrovka. 45 (11): 1626–1630. doi:10.2337 / diabetes.45.11.1626. PMID 8866570.
- ^ McDonald MJ, Efendic S, Ostenson CG (červenec 1996). „Normalizace inzulinem s nízkou mitochondriální glycerolfosfátdehydrogenázou a pyruvátkarboxylázou v pankreatických ostrůvcích krysy GK“. Cukrovka. 45 (7): 886–890. doi:10 2337 / cukrovka. 45,7 886. PMID 8666138.
- ^ Laybutt DR, Glandt M, Xu G, Ahn YB, Trivedi N, Bonner-Weir S, Weir GC (leden 2003). „Kritické snížení hmotnosti β-buněk má v průběhu času za následek dva odlišné výsledky. Přizpůsobení se sníženou tolerancí glukózy nebo dekompenzovaným diabetem“. J. Biol. Chem. 278 (5): 2997–3005. doi:10,1074 / jbc.M210581200. PMID 12438314.
- ^ A b Poitout V, Robertson RP (únor 2002). „Selhání sekundárních β-buněk u diabetu typu 2 - konvergence glukotoxicity a lipotoxicity“. Endokrinologie. 143 (2): 339–342. doi:10.1210 / en.143.2.339. PMID 11796484.
- ^ Boucher A, Lu D, Burgess SC, Telamaque-Potts S, Jensen MV, Mulder H, Wang MY, Unger RH, Sherry AD, Newgard CB (2004). „Biochemický mechanismus lipidem indukovaného poškození glukózou stimulované sekrece inzulínu a reverze malátovým analogem“. J. Biol. Chem. 279 (26): 27263–27271. doi:10,1074 / jbc.M401167200. PMID 15073188.
- ^ Busch AK, Cordery D, Denyer GS, Biden TJ (duben 2002). „Profily exprese genů regulovaných palmitátem a oleátem poskytují nové poznatky o účincích chronické expozice na funkci β-buněk pankreatu“. Cukrovka. 51 (4): 977–987. doi:10 2337 / cukrovka. 51.4 977. PMID 11916915.
- ^ Iizuka K, Nakajima H, Namba M, Miyagawa J, Mijazaki J, Hanafusa T, Matsuzawa Y (leden 2002). "Metabolické důsledky dlouhodobého vystavení β-buněk pankreatu volným mastným kyselinám se zvláštním zřetelem na necitlivost na glukózu". Biochim. Biophys. Acta. 1586 (1): 23–31. doi:10.1016 / s0925-4439 (01) 00082-5. PMID 11781146.
- ^ García-Cazorla A, Rabier D, Touati G, Chadefaux-Vekemans B, Marsac C, de Lonlay P, Saudubray JM (leden 2006). „Nedostatek pyruvátkarboxylázy: metabolické vlastnosti a nové neurologické aspekty“. Ann. Neurol. 59 (1): 121–7. doi:10.1002 / ana.20709. PMID 16278852. S2CID 21367897.