Mechanosenzitivní kanály - Mechanosensitive channels - Wikipedia
Mechanosenzitivní kanály, mechanosenzitivní iontové kanály nebo roztažené iontové kanály[1][2][3][4][5][6] (nezaměňovat s mechanoreceptory ). Jsou přítomny v membránách organismů ze tří domén života: bakterie, archaea a eukarya.[7] Jsou to senzory pro řadu systémů, včetně smyslů dotyku, sluchu a rovnováhy, stejně jako účasti na kardiovaskulární regulaci a osmotické homeostáze (např. Žízeň). Kanály se liší v selektivitě pro prostupující ionty od neselektivního mezi anionty a kationty v bakterie, na kation selektivní umožňující průchod Ca2+, K.+ a Na+ v eukaryotech a vysoce selektivní K.+ kanály v bakteriích a eukaryoty.
Všechny organismy a zjevně všechny typy buněk vnímají mechanické podněty a reagují na ně.[8] MSC fungují jako mechanotransduktory schopné generovat signály elektrického i iontového toku jako reakci na vnější nebo vnitřní[9] podněty.[10] Pod extrémem turgor v bakteriích neselektivní MSC jako MSCL a MSCS slouží jako bezpečnostní ventily zabraňující lýze. Ve specializovaných buňkách vyšších organismů jsou jiné typy MSC pravděpodobně základem smyslů sluchu a dotyku a vnímají stres potřebný pro svalovou koordinaci. Žádný z těchto kanálů však nebyl klonován. MSC také umožňují rostlinám rozlišovat nahoru a dolů snímáním gravitační síly. MSC nejsou citlivé na tlak, ale citlivé na místní stres, nejpravděpodobnější napětí v okolní lipidové dvojvrstvě.[11]
Dějiny
Mechanosenzitivní kanály byly objeveny v roce 1983 v kosterním svalu kuřat[12] Falguni Guharay a Frederick Sachs.[13] Byly také pozorovány (pub. 1986) v oocytech Xenopus,[14] a od té doby často studoval.[15][16][17][18][19][20][21][22][23][24][25] Od té doby byly MS kanály nalezeny v buňkách od bakterií po člověka:[26] nyní je známo, že jsou přítomny ve všech třech doménách života (Archaea, Bacteria a Eukarya, vč. rostlin a hub).[27] V desetiletích od objevu MS se pochopení jejich struktury a funkce značně zvýšilo a některé byly klonovány. Konkrétně klonované eukaryotické mechanosenzitivní kanály zahrnují K.+ selektivní kanály 2P domény[28][29][30][31][32][33][34][35][36][37][38][39][40][41] a nedávno selektovaná rodina klonovaných kationtů PIEZO.[42][43][44][45][46][47]
Klasifikace
MS lze klasifikovat na základě typu iontu, pro který jsou propustné.
Kationově selektivní MSC: Jak název napovídá, vykazují selektivní permeabilitu pro pozitivní ionty, přičemž nejselektivnějšími kanály jsou kanály pro K+. Nejběžnější eukaryotické MSC jsou kationově selektivní procházející Na+, K.+ a Ca2+ ale ne Mg2+. Mají jednokanálový rozsah vodivosti (25-35 pS) a jsou blokovány trojmocným iontem Gadoliniem. K+ selektivní MSC jako TREK-1 nejsou blokovány Gd3+.[48]
Anionové kanály: vykazují významnou permeabilitu pro záporné ionty a nepřevládají jako kationtová MS. Mají velký rozsah vodivosti (> 300 pS).
Neselektivní iontové kanály: Jak název napovídá, nerozlišují mezi pozitivními a negativními kanály, ty jsou častější pro Archea a bakterie, ale zřídka se vyskytují v Eukarya.[49]
Obecně lze většinu členských států klasifikovat jako lipidově řízené kanály
Funkce
Aby byl protein považován za mechanicky citlivý, musí reagovat na mechanickou deformaci membrány. Mechanické deformace mohou zahrnovat změny napětí, tloušťky nebo zakřivení membrány. Mechanosenzitivní kanály reagují na napětí membrány změnou jejich konformace mezi otevřeným stavem a uzavřeným stavem.[50][51] Jeden typ mechanicky citlivého iontového kanálu aktivuje specializované senzorické buňky, například kochleární vláskové buňky a nějaký dotek smyslové neurony, v reakci na síly aplikované na proteiny.[52][53]
Stretch aktivované iontové kanály jsou užitečné při počáteční tvorbě akční potenciál z mechanického podnětu, například mechanoreceptory ve zvířeti vibrissae (vousky).
Další citlivost, kterou drží mechanosenzitivní iontové kanály, je magnetismus.[54] Magnetismus funguje jako mechanická stimulace k vyvolání funkce v kanálu. Příkladem toho je řízení přílivu vápníku axonů a boutonů v neuronových sítích.
Aferentní nervová vlákna odpovědná za detekci a zpětnou vazbu smyslových orgánů jsou obzvláště citlivá na stimulaci. To je výsledkem specializovaných mechanoreceptorových buněk, které jsou superponovány na aferentní nervová vlákna. Stretch aktivované iontové kanály jsou umístěny na těchto mechanoreceptorových buňkách a slouží ke snížení prahu akčního potenciálu, čímž jsou aferentní nervy citlivější na stimulaci. Aferentní nervová zakončení bez mechanoreceptorových buněk se nazývají volná nervová zakončení. Jsou méně citlivé než zapouzdřená aferentní vlákna a obecně fungují při vnímání bolesti.[55]
Stretch aktivované iontové kanály jsou zodpovědné za mnoho tělesných funkcí u savců. V pokožce jsou odpovědné za snímání vibrací, vnímání tlaku, roztažení, dotyku a lehkého dotyku.[56][57] Jsou vyjádřeny v senzorických modalitách včetně chuti, sluchu, čichu, vnímání tepla, ovládání hlasitosti a vidění.[58][59][60] Mohou také regulovat vnitřní funkce našeho těla, mimo jiné včetně osmotický tlak v buňkách, krevní tlak v žilách a tepnách, močení a srdeční elektrofyziologie [61] a kontraktilita.[58][60] Kromě těchto funkcí bylo také zjištěno, že iontové kanály aktivované napínáním jsou zapojeny do rovnováhy a proprioceptivní vjem.[58]
Bylo také zjištěno, že kanály, které byly tradičně známé jako „napěťové“ nebo „ligandové“, jsou také mechanicky citlivé. Kanály vykazují mechanickou citlivost jako obecnou vlastnost. Mechanické napětí však ovlivňuje různé typy kanálů různými způsoby. Kanály s napětím a ligandem lze mírně upravit mechanickou stimulací, což může změnit jejich odezvu nebo propustnost mírně, ale stále reagují primárně na napětí nebo ligandy.[62]
Příklady
Různé rodiny roztažných iontových kanálů jsou zodpovědné za různé funkce v těle. Rodina DEG / ENaC se skládá ze dvou podskupin: ENaC podčeleď reguluje reabsorpci Na + v epitelu ledvin a plic; the ASIC podrodina je zapojena do podmiňování strachu, formování paměti a pocit bolesti.[63] The TRP nadrodina kanálů se nachází v buňkách senzorických receptorů, které se podílejí na vnímání tepla, chuti, čichu, dotyku a osmotické a objemové regulaci.[59] Kanály MscM, MscS a MscL (mechanosenzitivní kanály mini, malé a velké vodivosti) regulují osmotický tlak v buňkách uvolňováním intracelulární tekutiny, když se příliš protáhnou.[58] V těle možná role v myoblast byl popsán vývoj.[64] Kromě toho se mechanicky řízené iontové kanály nacházejí také ve stereocilii vnitřního ucha. Zvukové vlny jsou schopné ohýbat stereocilia a otevřít iontové kanály vedoucí k tvorbě nervových impulsů.[65] Tyto kanály také hrají roli při snímání vibrací a tlaku prostřednictvím aktivace Pacinianské krvinky v kůži.[66]
Transdukční mechanismy
Existují dva různé typy kanálů aktivovaných roztažením, mezi nimiž je důležité rozlišovat: mechanicky ovládané kanály, které jsou přímo ovlivněny mechanickými deformacemi membrány, a mechanicky citlivé kanály, které jsou otevřeny druhými posly uvolněnými ze skutečného mechanicky ovládaného kanál.[56]
Bylo zjištěno, že dva různé mechanismy otevírají roztažené iontové kanály: Mechanické deformace v buněčné membráně mohou zvýšit pravděpodobnost otevření kanálů. Bílkoviny extracelulární matrix a cytoskelet jsou upoutány na extra - a intra-cytoplazmatické domény respektive roztažně aktivovaných iontových kanálů. Napětí na těchto mechanosenzorických proteinech způsobuje, že tyto proteiny fungují jako signální meziprodukt, což vede k otevření iontového kanálu.[56] Všechny známé napínací aktivované iontové kanály v prokaryotické buňky bylo zjištěno, že byly otevřeny přímou deformací lipidová dvojvrstva membrána.[58] Kanály, u nichž se ukázalo, že výhradně používají tento mechanismus hradlování, jsou TREK-1 a TRAAK kanály. Ve studiích s použitím savců vláskové buňky, mechanismus, který táhne proteiny upoutané z intra- a extra-cytoplazmatické domény kanálu na cytoskelet a respektive extracelulární matrici, je nejpravděpodobnějším modelem pro otevření iontového kanálu.[58]
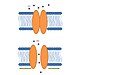
Prokaryotický model. Kanál se otevírá v reakci na deformaci membrány (zelené šipky). Převzato z Lumpkin et al.[67]
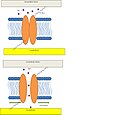
Model buněčných buněk savců. Kanál se otevírá přes postroje v reakci na narušení extracelulární matrice nebo cytoskeletu. Obrázek převzatý z Lumpkin et al.[67]
Vratový mechanismus
Ačkoli se MS liší v mnoha aspektech, strukturách a funkcích, všechny dosud studované MS sdílejí důležitou vlastnost: v procesu zvaném vrata, všechny se otevírají pórovitým způsobem, když jsou proteinové kanály aktivovány mechanickým stimulem. V současné době existují dva modely procesu hradlování, které vysvětlují, jak se otvírají membránově aktivované iontové kanály.

Lipidová dvojvrstva Napínací nebo napínací model:[69] V tomto modelu spouští napětí v lipidové dvojvrstvě konformační změny, což vede k otevření kanálů. Napětí vnímané proteinem pochází z lipidů. Bylo prokázáno, že profil napětí / roztažení v lipidové dvojvrstvě je způsoben zakřivením membrány a hydrofobním nesouladem dvouvrstvý protein.[70]

Jarní model Tether: V tomto modelu je pružinový svazek připojen přímo k MS kanálu a může být přítomen buď v cytoskeletu nebo v extracelulární matici spojující tyto prvky dohromady. Když vnější podněty odkloní svazek, posunutí otevře kanál.[68] Ukázalo se, že tento konkrétní mechanismus je odpovědný za stavbu vlasových buněk, které jsou odpovědné za sluch obratlovců.[71]
Bakteriální MS
Bakteriální MS kanály byly poprvé objeveny experimenty patch-clamp v E. coli.[72] Byly klasifikovány na základě jejich vodivosti jako mini (MscM), malé (MscS) a velké (MscL ). Tyto kanály fungují v tandemovém režimu a jsou odpovědné za regulaci turgoru v bakteriích; při aktivaci změnami osmotického tlaku. MscM se aktivuje nejprve při opravdu nízkých tlacích, poté MscS, a nakonec MscL je poslední šance na přežití během osmotického šoku. Jejich úkol byl prokázán, když byly bakterie postrádající MscS i MscL lyžovány po expozici osmotickým nárazům.[73]
MscS: Malý vodivostní mechanicky citlivý kanál.

Hlavní vodivost je 1 nS v pufrovaném roztoku. Channel-proteiny byly nalezeny v grampozitivních a gramnegativních bakteriích, archaeách a rostlinách. Kanál MscS byl nalezen po studiích v E-coli sféroplasty.[70] Identifikace genové rodiny vyžadované pro MS malé vodivosti byla jako dva různé kanály. YggB kódující MscS a KefA kódující MscK ve Windows E-coli dále potvrdit svou roli osmotické regulace. Studie mutageneze ukázaly, že když byly odstraněny oba geny YggB a KefA, MscS ztratil svou funkci, ale udržoval MscL a MscM, ale mutanty s nedostatkem YggB a MscL ukázaly, že funkcí těchto kanálů je otevření v reakci na rozsah tlaku těsně před prasknutím buňky.[74]
3D struktura tohoto kanálu v uzavřeném stavu byla objasněna po krystalografické studii Bass et al.[75] který ukázal, že při rozlišení 3,9 Á je tento protein 31 kDa homoheptamer tvořící kanál o průměru 80 Á a délce 120 Á, každá podjednotka obsahuje tři transmembránové domény (TM1, TM2 a TM3) s N-koncem směřujícím k periplazma a C-terminál zabudovaný do cytoplazma. TM3 je vysoce konzervovaný v rodině MscS a má se za to, že hraje důležitou roli v prokaryotickém hradlování MS.[76] MscS je malý protein složený z 286 aminokyselinových zbytků aktivovaných jak napětím v lipidové dvojvrstvě, tak napětím; v roce 2002 Vasquez a kol.[77] podrobně popsal tento proces a ukázal, že během změny z uzavřeného stavu do otevřeného stavu se TM1 naklání a otáčí, čímž je TM2 vystaven membráně a šroubovice TM3 se rozpínají, naklánějí a otáčejí. Během přesmyku byla uzavřená část pórů měřena jako 11 Á a molekuly vody byly přístupnější pro TM3. Dvě transmembránové domény jsou v nepřetržitém kontaktu s lipidovou dvojvrstvou a jsou považovány za senzor napětí v lipidové dvojvrstvě, stejně jako senzor napětí kvůli třem zbytkům argininu přítomným v těchto doménách.[78]
Přestože je MscS aktivován napětím, bylo prokázáno, že samotné napětí je nedostatečné k otevření kanálu, takže funguje s kanálem v kooperaci. Čím kladnější napětí, tím vyšší je pravděpodobnost otevření kanálu, pokud je v systému stále vyvíjen tlak nad prahovou hodnotou; výkon tohoto kanálu při vyšším napětí nebyl zcela pochopen. MscS má malou afinitu k negativním iontům včetně Cl- a glutamátu.[79]
MscL: Velký vodivostní mechanosenzitivní kanál.
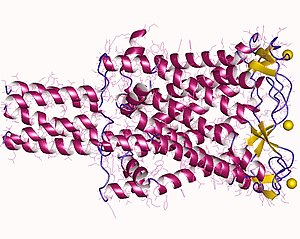
V bakteriích byl MscL první MS kanály klonované a sekvenované a je zdaleka jedním z nejvíce studovaných kanálů. Gen kódující protein MscL je trkA a je umístěn ve vnitřní membráně MscL E-coli. Protein má 17 KDa a skládá se ze 136 aminokyselin; většinou hydrofobní zbytky vedoucí ke dvěma hydrofobním segmentům, ale z experimentů s gelovou filtrací se předpokládá, že molekulová hmotnost funkčního kanálu bude 60-70 KDa, což naznačuje oligomerizaci. Jako společný rys nejsou v tomto kanálu přítomny žádné cysteinové zbytky.[80]
V roce 1998 byl homolog MscL z Mycobacterium tuberculosis Tb-MscL objasněn v uzavřeném stavu rentgenovou krystalografií v rozlišení 3,5 Á. Protein je homopentamer složený převážně ze spirálních oblastí trans orientace spirál vzhledem k dvojvrstvě, se dvěma doménami: cytoplazmatickou a transmembránovou. Kanál má délku 85 Å, 35 Å a 50 Å pro cytoplazmatickou transmembránovou doménu a 50 Å v průměru. Spirály procházejí dvakrát membránou jak s C-koncem, tak s N-koncem, takže mají dvě transmembránové domény TM1 a TM2, které jsou TM1 nejkonzervovanější oblastí mezi MscL proteiny, zejména v N-koncové oblasti.[81] Nachází se v cytoplazmě a tvoří α-hydrofobní šroubovici zvanou S1; oblast mezi transmembránovými doménami tvoří smyčku, která je rozdělena do dvou oblastí: S2 oblast bohatá na glycin-prolin a S3 krátká šroubovicová část.[82] Sekundární struktura proteinu je rezistentní na tepelnou denaturaci stále v přítomnosti SDS.[83]
Během aktivace prokaryotického MscL napětím v lipidové dvojvrstvě byl stanoven střední stav. Segmenty S1 tvoří svazek, když je struktura v uzavřeném stavu, a zesíťování segmentů S1 brání otevření kanálu. Když je na membránu aplikováno napětí, transmembránová hlaveň podobná struktura se roztáhne a roztáhne od sebe oblast S1-TM1, což umožní otevření kanálu.[84] Velikost póru v otevřeném stavu je přibližně 25 Á. Přechod z uzavřeného do přechodného stavu je doprovázen malými pohyby TM1; další přechody do otevřené polohy jsou charakterizovány velkými přesmyky v TM1 i TM2.[85]
Role lipidové dvojvrstvy v MS
Lipidová dvojvrstva je důležitou strukturou ve všech živých buňkách; má mnoho funkcí, jako je oddělení oddílů a mimo jiné signalizace. V případě prokaryotických proteinových kanálů jsou MscS a MscL bráněny napětím v lipidové dvojvrstvě, což naznačuje důležitou roli v takových komplexních strukturách.
Napětí v membránové dvojvrstvě bylo rozsáhle studováno, jednoduché vnitřní vlastnosti lipidů mohou odpovídat za příspěvky ve volné energii otevřeného, středního a uzavřeného stavu MS kanálů. Dvojvrstva má různé vlastnosti, které jí umožňují přenášet napětí a zabránit vyčerpávajícím deformacím, první je „v rovinné tekutosti lipidové dvojvrstvy“, což znamená, že jakékoli rovinné napětí v lipidové dvojvrstvě je pociťováno homogenně při absenci cytoskeletových interakcí. Molekuly lipidů mají specifické prostory, které brání změně dvojvrstvy.[86]
Podíl membránové deformace v hradle MS kanálů lze rozdělit do dvou typů: deformace roviny dvojvrstvy a deformace tloušťky dvojvrstvy. Také během jakéhokoli procesu zahrnujícího změny ve struktuře je důležitým faktorem také volná energie samotného procesu. Během hradlování jsou hlavními procesy, které tvoří tuto událost, hydrofobní nesoulad a zakřivení membrány. Bylo vypočítáno, že volná energie napětí v lipidové dvojvrstvě je podobná energii potřebné k uzavření kanálů.[87]
Jiná studie ukázala, že délka hydrofobního ocasu ovlivňuje jeho fungování a podporuje různé stavy, fosfatidylcholin (PC) 18 stabilizuje lépe otevřený stav kanálu MscL, PC 14 stabilizuje střední stav a směs PC 18 a lysofosfatidylcholin (LPC) stabilizuje uzavřený stav,[85] což naznačuje, že tloušťka dvojvrstvy (pro délky uhlíkových ocasů 16, 18 a 20) ovlivňuje funkci kanálu. Závěrem lze říci, že energie z prostředí membrány hraje důležitou roli v celkové energii hradlování kanálu.
Eukaryoty
U eukaryot jsou dva z nejznámějších iontových kanálů citlivé na mechanosenzit draslíkové kanály TREK-1 a TRAAK, oba se vyskytují u savců neurony.
Nedávno byla klonována nová rodina mechanosenzitivních iontových kanálů se dvěma členy savců, PIEZO1 a PIEZO2.[88] Oba tyto kanály jsou exprimovány v plicích a močovém měchýři, což jsou orgány s důležitými mechanosenzorickými funkcemi. Piezo1 je také exprimován v kůži a v červených krvinkách a jeho zisk funkčních mutací způsobuje dědičnou xerocytózu.[89] Piezo2 je exprimován v senzorických neuronech dorzálního kořene a trigeminálních gangliích, což naznačuje, že může hrát roli při hmatovém vjemu. Mutace v piezo2 jsou spojeny s lidským onemocněním s názvem Distal Arthrogryposis.[90]
Fyziologická role MS
MS kanály jsou všudypřítomně exprimovány v membráně prokaryot, což naznačuje jejich význam. U bakterií a archaeí je funkce těchto kanálů zachována a bylo prokázáno, že hrají roli v regulaci turgoru. V Eukaryi jsou MS kanály zapojeny do všech pěti smyslů. Hlavní rodinou je TRP a dobrým příkladem jsou vláskové buňky zapojené do procesu sluchu. Když vlna zvuku odkloní stereocilii, kanál se otevře. Toto je příklad pružinového vratového mechanismu Tether. Nedávné studie odhalily novou roli mechanosenzitivních drah, ve kterých se naivní mezenchymální kmenové buňky zavázaly ke konkrétní linii založené na pružnosti okolní matrice.[91]
| Kanál | Zdroj | Vratový mechanismus | Fyziologická role |
|---|---|---|---|
| MscL | Bakterie | Lipidová dvojvrstva | Regulace turgoru a růst buněk |
| MscS | Bakterie | Lipidová dvojvrstva | Regulace turgoru a růst buněk |
| MscMJ | Archaea | Lipidová dvojvrstva | Regulace turgoru |
| MEC4 | C. elegans | Tether | Dotek |
| TRPY | Houby | Bilayer | Regulace turgoru |
| TRACK-1 | Savčí | Bilayer | Klidový membránový potenciál |
MS byly také navrženy jako potenciální cíl pro antibiotika, důvodem této myšlenky je, že McsS i MscL jsou mezi prokaryoty vysoce konzervativní, ale jejich homology nebyly u zvířat nalezeny[93] což z nich činí výjimečný potenciál pro další studium.
U savčích neuronů otevření iontových kanálů depolarizuje aferentní neuron produkující akční potenciál s dostatečnou depolarizací.[55] Kanály se otevírají v reakci na dva různé mechanismy: prokaryotický model a model vlasových buněk savců.[58][59] Ukázalo se, že iontové kanály aktivované roztažením detekují vibrace, tlak, roztažení, dotek, zvuky, chutě, vůni, teplo, objem a vidění.[56][57][60] Stretch aktivované iontové kanály byly rozděleny do tří odlišných „superrodin“: rodina ENaC / DEG, rodina TRP a selektivní rodina K1. Tyto kanály jsou zapojeny do tělesných funkcí, jako je regulace krevního tlaku.[62] Je prokázáno, že jsou spojeny s mnoha kardiovaskulárními chorobami.[59] Protahovací kanály byly poprvé pozorovány v kosterních svalech kuřat Falguni Guharay a Frederick Sachs v roce 1983 a výsledky byly publikovány v roce 1984.[94] Od té doby byly v buňkách nalezeny kanály aktivované napínáním od bakterií po člověka i rostliny.
Otevření těchto kanálů je ústřední pro reakci neuronu na tlak, často osmotický tlak a krevní tlak, k regulaci iontového toku ve vnitřním prostředí.[58]
Techniky používané ke studiu MS
Toto je krátký seznam nejčastěji používaných technik ke studiu vlastností, funkcí, mechanismů a dalších funkcí těchto kanálů:
- Patch-clamp: Záznam jedné buňky.
- EPR
- Simulace molekulární dynamiky: stanovení atomové fluktuace systému.
- Mikroskopie atomové síly: mechanické síly membrány.
- Aspirace mikropipety: Tlak do buněk.
- 3D simulace

- Mutageneze
Prostřednictvím experimentů prováděných na cytoskeletu a extracytoplazmatické matrici roztažených iontových kanálů bylo prokázáno, že tyto struktury hrají významnou roli v mechanotransdukci.[56] V jednom takovém experimentu na dospělých srdečních buňkách byly zaznamenány záznamy celých buněk na buňkách vymačkávaných dvěma pipetami při 1 Hz / 1 um. Toto stlačení neprodukovalo žádný proud až do pěti minut, kdy byla pozorována velká depolarizace. Poté se buňka stala extrémně citlivou na každou kompresi a během následujících několika minut postupně snižovala citlivost.[62] Vědci předpokládali, že cytoskelet zpočátku tlumil mechanickou deformaci vytlačování z kanálu. Depolarizací po pěti minutách došlo k prasknutí cytoskeletu, které následně způsobilo, že kanál cítil mechanické deformace, a tím reagoval na podněty. Vědci se domnívají, že během několika minut, kdy se kanál sám opravil, se cytoskelet musí opravit sám a nově se přizpůsobit vymačkávacím podnětům.[62]
Struktura
Nadrodina ENaC / DEG
ASIC
Existuje šest známých podjednotek ASIC, ASIC1a, ASIC1b, ASIC2a, ASIC2b, ASIC3 a ASIC4, které mají dvě transmembránové domény, extracelulární a intracelulární smyčky a C a N konce. Tyto ASIC podjednotky se pravděpodobně tvoří tetramery s různou kinetikou, citlivostí na pH, distribucí v tkáních a farmakologickými vlastnostmi.[56]
Nadrodina TRP
Uvnitř je sedm podskupin TRP nadčeleď: TRPC (kanonický), TRPV (vaniloidní), TRPM (melastatin), TRPP (polycystin), TRPML (mukolipin), TRPA (ankyrin) a TRPN (Jako NOMPC).[56] TRP proteiny typicky sestávají ze šesti transmembránových domén, S1, S2, S3, S4, S5 a S6, s póry mezi S5 a S6. Ty obsahují intracelulární konce N a C, které tvoří tetramery[63] a liší se délkou a doménou.[56] V kanálu jsou ankyriny, což jsou strukturní proteiny, které zprostředkovávají interakce protein-protein, a předpokládá se, že přispívají k tetherovému modelu otevírání kanálu aktivovaného napínáním. NOMPC, identifikovaný v mechanotransdukci D. melanogaster a člen podrodiny TRPN, obsahuje relativně vysoký počet ankyrinů.[58]
Selektivní nadrodina K1
K2P kanály se skládají ze šesti podskupin a obsahují čtyři transmembránové domény, které tvoří každý dva póry mezi doménami 1–2 a 3–4. K2P kanály také obsahují krátkou N koncovou doménu a C koncovku, která se liší délkou. Mezi doménou 1 a prvním pórem vytvořeným mezi doménami 1–2 je také velká extracelulární spojovací oblast.[56]
Příklady
Kanály TRP jsou obvykle neselektivní, i když některé jsou selektivní pro ionty vápníku nebo hydratovaného hořčíku a jsou složeny z integrální membránové proteiny. Ačkoli je mnoho kanálů TRP aktivováno změnou napětí, vazbou ligandu nebo změnou teploty,[56] u některých kanálů TRP se předpokládá, že se účastní mechanotransdukce.[59] Některé příklady jsou TRPV4, který zprostředkovává mechanické zatížení v různých tkáních, včetně jater, srdce, plic, průdušnice, varlat, sleziny, slinných žláz, kochley a vaskulárních endoteliálních buněk,[59] stejně jako TRPC1 a TRPC6, které se podílejí na svalové mechanosenzaci. TRPC1 je exprimován v myocytech srdce, tepen a kosterního svalu. TRPC1 je široce považován za neselektivní „iontový kanál provozovaný v obchodě“ (SOC), který se podílí na přílivu vápníku po vyčerpání vápníku v endoplazmatickém retikulu buňky.[96] TRPC6 je pro vápník propustný neselektivní kationtový kanál exprimovaný v kardiovaskulárním systému. TRPC6 je potenciálně senzorem mechanicky a osmoticky indukovaného roztažení membrány a je možná přímo bránou napětím membrány.[96] Mezi další příklady patří TREK-1 a TRAAK které se nacházejí v savčích neuronech a jsou klasifikovány jako draslíkové kanály v třída domény tandemových pórů[97][98] a „MID-1“ (také známý jako „MCLC“ nebo CLCC1.)[99][100]
Šest podrodin kanálů K2P je regulováno různými fyzikálními, buněčnými a farmakologickými stimulanty, včetně roztažení membrány, tepla, změny pH, toku vápníku a proteinových kináz.[56]
Klinický význam
Stretch aktivované iontové kanály plní důležité funkce v mnoha různých oblastech našeho těla. Na tlaku závislé tepny s myogenní konstrikcí vyžadující tyto kanály pro regulaci v hladkém svalu tepen.[57] Bylo zjištěno, že se používají pro snímání objemu u zvířat a regulace krevního tlaku.[62] Bylo prokázáno, že bakterie ulevují hydrostatický tlak prostřednictvím kanálů MscL a MscS.[62]
Patologie spojené s iontovými kanály aktivovanými napínáním
Stretch aktivované iontové kanály byly korelovány s hlavními patologiemi. Některé z těchto patologií zahrnují srdeční arytmie (jako fibrilace síní ),[62] srdeční hypertrofie, Duchennova svalová dystrofie,[57] a další kardiovaskulární choroby.[59]
Blokování roztažných iontových kanálů
Gadolinium (Gd3+) a další lanthanoidy Bylo prokázáno, že blokují funkci iontového kanálu aktivovaného roztažením. Ukázalo se, že peptidový toxin izolovaný z chilské růžové tarantule (Grammostola spatulata), mechanotoxin 4 (GsMTx4), inhibuje tyto kanály z extracelulární strany, ale neinhibuje všechny roztažně aktivované iontové kanály a zejména nemá žádný účinek na 2p kanály .[62]
Seznam nemocí spojených s mechanosenzitivními kanály
- Polycystické onemocnění ledvin.
- Fibrilace síní
Abnormality ve funkci kanálů MS mohou způsobit:[27]
- Neuronální onemocnění
- Svalová degenerace.
- Srdeční arytmie
- Hypertenze.
Viz také
- Mechanosensace
- Kanál s velkou vodivostí mechanicky citlivý
- Kanál s malou vodivostí mechanicky citlivý
- Napěťově řízené iontové kanály
- Ligandové iontové kanály
- Lipidové iontové kanály
- Rošt NYU webové stránky
Reference
- ^ Sukharev, S .; Sachs, F. (2012). „Molekulární přenos síly iontovými kanály: rozmanitost a sjednocující principy“. J. Cell Sci. 125 (13): 1–9. doi:10.1242 / jcs.092353. PMC 3434843. PMID 22797911.
- ^ Gottlieb, P .; Sachs, F (2012). „Pocit roztažení“. Příroda. 483 (7388): 163–164. Bibcode:2012Natur.483..163G. doi:10.1038 / 483163a. PMC 4090763. PMID 22398551.
- ^ Sachs, F. (2010). „Roztažené aktivované iontové kanály; co jsou zač?“. Fyziologie. 25 (1): 50–56. doi:10.1152 / fyziol. 00042.2009. PMC 2924431. PMID 20134028.
- ^ Bowman, Charles L .; Gottlieb, P. A .; Suchyna, T. M .; Murphy, Y. K .; Sachs, F. (2007). „Mechanosenzitivní iontové kanály a peptidový inhibitor GsMTx-4: historie, vlastnosti, mechanismy a farmakologie“. Toxicon. 49 (2): 249–270. doi:10.1016 / j.toxicon.2006.09.030. PMC 1852511. PMID 17157345.
- ^ Suchyna, T. M .; Sachs, F. (2007). "Mechanosenzitivní vlastnosti kanálu a membránová mechanika v myších dystrofických myotubách". J. Physiol. 581 (Pt 1): 369–387. doi:10.1113 / jphysiol.2006.125021. PMC 2075208. PMID 17255168.
- ^ Markin, V. S .; Sachs, F. (2006). "Termodynamika mechanosenzitivity". Aktuální témata v oblasti membrán a dopravy. 1 (2): 110–124. Bibcode:2004PhBio ... 1..110M. doi:10.1088/1478-3967/1/2/007. PMID 16204828.
- ^ Pivetti CD, Yen MR, Miller S, Busch W, Tseng YH, Booth IR, Saier MH (březen 2003). „Dvě rodiny mechanosenzitivních proteinů kanálu“. Microbiol. Mol. Biol. Rev. 67 (1): 66–85, obsah. doi:10.1128 / MMBR.67.1.66-85.2003. PMC 150521. PMID 12626684.
- ^ Kung, C. (2005). "Možný sjednocující princip pro mechanosensaci". Příroda. 436 (7051): 647–54. Bibcode:2005 Natur.436..647K. doi:10.1038 / nature03896. PMID 16079835.
- ^ Suchyna, T .; Sachs, F. (2007). "Mechanické a elektrické vlastnosti membrán z dystrofického a normálního myšího svalu". J. Physiol. 581 (Pt 1): 369–387. doi:10.1113 / jphysiol.2006.125021. PMC 2075208. PMID 17255168.
- ^ Hackney, CM; Furness, DN (1995). "Mechanotransdukce ve vlasových buňkách obratlovců: struktura a funkce stereociliárního svazku". Am J Physiol. 268 (1 Pt 1): C1–138. doi:10.1152 / ajpcell.1995.268.1.C1. PMID 7840137.
- ^ Markin, V. S .; Sachs, F. (2004). "Termodynamika mechanosenzitivity". Fyzikální biologie. 1 (2): 110–124. Bibcode:2004PhBio ... 1..110M. doi:10.1088/1478-3967/1/2/007. PMID 16204828.
- ^ Guharay, F .; Sachs, F. (červenec 1984). "Stretch aktivované proudy jednoho iontového kanálu v tkáňově kultivovaném embryonálním kuřecím kosterním svalu". J. Physiol. 352: 685–701. doi:10.1113 / jphysiol.1984.sp015317. PMC 1193237. PMID 6086918.
- ^ Guharay, F .; Sachs, F. (1985). „Mechanotransdukční iontové kanály v kosterním svalu kuřat: účinky extracelulárního pH“. Fyziologický časopis. 353: 119–134. doi:10.1113 / jphysiol.1985.sp015699. PMC 1192918. PMID 2410605.
- ^ Methfessel, C .; et al. (1986). „Patch clamp measurement na Xenopus laevis oocytech: proudy endogenními kanály a implantované acetylcholinové receptory a sodíkové kanály“. Archiv Pflügers: European Journal of Physiology. 407 (6): 577–588. doi:10.1007 / BF00582635. PMID 2432468.
- ^ Zhang, Y .; Gao, F .; Popov, V. L .; Wen, J. W .; Hamill, O. P. (2000). „Mechanicky řízená aktivita kanálu v cytoskeletu s defekty plazmatické membrány a vezikulách z oocytů Xenopus“. Fyziologický časopis. Pt 1. 523 (Pt 1): 117–130. doi:10.1111 / j.1469-7793.2000.t01-1-00117.x. PMC 2269789. PMID 10673548.
- ^ Zhang, Y .; Hamill, O. P. (2000). „Proudy citlivé na vápník, napětí a osmotický stres v oocytech Xenopus a jejich vztah k jednotlivým mechanicky uzavřeným kanálům“. Fyziologický časopis. 523 (Pt 1): 83–99. doi:10.1111 / j.1469-7793.2000.t01-2-00083.x. PMC 2269778. PMID 10673546.
- ^ Zhang, Y .; Hamill, O. P. (2000). „O rozdílu mezi mechanosenzitivitou celobuněčné a membránové náplasti v oocytech Xenopus“. Fyziologický časopis. 523 (Pt 1): 101–115. doi:10.1111 / j.1469-7793.2000.00101.x. PMC 2269787. PMID 10673547.
- ^ Hamill OP, McBride DW (1997). „Mechanogated channels in Xenopus oocytes: different gating modes allow a channel to switch from the phasic to the tonic mechanotransducer“. Biologický bulletin. 192 (1): 121–122. doi:10.2307/1542583. JSTOR 1542583. PMID 9057280.
- ^ Hamill, O. P .; McBride, D. W. J. (1996). „Interakce napětí a napětí membrány v bráně kationtového kanálu s mechanickými hradly v oocytech xenopus“. Biofyzikální deník. 70 (2): A339 – A359. Bibcode:1996 BpJ .... 70..339.. doi:10.1016 / S0006-3495 (96) 79669-8. PMC 1225030.
- ^ Wilkinson, N. C .; McBride, D. W .; Hamill, O. P. (1996). „Testování domnělé úlohy mechanicky řízeného kanálu při testování zrání, oplodnění a vývoje pulce Xenopus oocytů“. Biofyzikální deník. 70 (1): 349–357. Bibcode:1996 BpJ .... 70..349Z. doi:10.1016 / S0006-3495 (96) 79576-0. PMC 1224933. PMID 8770211.
- ^ Lane, J. W .; McBride, D. W., Jr.; Hamill, O. P. (1993). „Iontové účinky na amiloridový blok mechanosenzitivního kanálu v oocytech Xenopus“. British Journal of Pharmacology. 108 (1): 116–119. doi:10.1111 / j.1476-5381.1993.tb13449.x. PMC 1907719. PMID 7679024.
- ^ Hamill, O. P .; McBride, D. W., Jr. (1992). „Rychlá adaptace jednotlivých mechanosenzitivních kanálů v oocytech Xenopus“. Sborník Národní akademie věd Spojených států amerických. 89 (16): 7462–7466. Bibcode:1992PNAS ... 89,7462H. doi:10.1073 / pnas.89.16.7462. PMC 49730. PMID 1380158.
- ^ Lane, J. W .; McBride, D. W., Jr.; Hamill, O. P. (1992). „Vztahy mezi strukturou a aktivitou amiloridu a jeho analogů při blokování mechanosenzitivního kanálu v oocytech Xenopus“. British Journal of Pharmacology. 106 (2): 283–286. doi:10.1111 / j.1476-5381.1992.tb14329.x. PMC 1907505. PMID 1382778.
- ^ McBride, D. W., Jr.; Hamill, O. P. (1992). „Pressure-clamp: a method for rapid step perturbation of mechanosensitive channels. Pflügers Archiv“. European Journal of Physiology. 421 (6): 606–612. doi:10.1007 / BF00375058. PMID 1279516.
- ^ Lane, J. W .; McBride, D .; Hamill, O. P. (1991). „Amiloridový blok mechanosenzitivního kationtového kanálu v oocytech Xenopus“. Fyziologický časopis. 441: 347–366. doi:10.1113 / jphysiol.1991.sp018755. PMC 1180202. PMID 1816379.
- ^ Sachs, F; Morris, C.E (1998). "Mechanosenzitivní iontové kanály v nespecializovaných buňkách". Recenze fyziologie, biochemie a farmakologie. 132: 1–77. doi:10.1007 / BFb0004985. ISBN 978-3-540-63492-8. PMID 9558913.
- ^ A b http://langevin.anu.edu.au/publications/chapter10_martinac_correted.pdf
- ^ Peyronnet, R. a kol. Mechanoprotekce polycystiny proti apoptóze je zprostředkována otevřením roztažně aktivovaných kanálů K2P. Cell Reports 1 (v tisku), 241-250 (2012)
- ^ Chemin, J .; Patel, AJ; Duprat, F; Sachs, F; Lazdunski, M; Honore, E (2007). "Regulace nahoru a dolů mechanicky řízeného kanálu K-2P TREK-1 pomocí PIP2 a dalších membránových fosfolipidů". Archiv Pflügers: European Journal of Physiology. 455 (1): 97–103. doi:10.1007 / s00424-007-0250-2. PMID 17384962.
- ^ Honore, E. (2007). "Neuronální pozadí K2P kanálů: zaměření na TREK1". Recenze přírody Neurovědy. 8 (4): 251–261. doi:10.1038 / nrn2117. PMID 17375039.
- ^ Chemin, J. a kol. v mechanosenzitivních iontových kanálech, Pt B sv. 59 Aktuální témata v membránách (ed. O. Hamill) Ch. 7, 155-170 (Academic Press, 2007).>
- ^ Honore, E .; Patel, A. J .; Chemin, J .; Suchyna, T .; Sachs, F. (2006). "Desenzibilizace mechanicky řízených kanálů K-2P". Sborník Národní akademie věd Spojených států amerických. 103 (18): 6859–6864. Bibcode:2006PNAS..103,6859H. doi:10.1073 / pnas.0600463103. PMC 1458984. PMID 16636285.
- ^ Chemin, J .; Patel, A; Duprat, F; Zanzouri, M; Lazdunski, M; Honoré, E (2005). "Lysophosphatidic acid-operated K+ channels". Journal of Biological Chemistry. 280 (6): 4415–4421. doi:10.1074/jbc.M408246200. PMID 15572365.
- ^ Lauritzen, I.; Chemin, J; Honoré, E; Jodar, M; Guy, N; Lazdunski, M; Jane Patel, A (2005). "Cross-talk between the mechano-gated K-2P channel TREK-1 and the actin cytoskeleton". Zprávy EMBO. 6 (7): 642–648. doi:10.1038/sj.embor.7400449. PMC 1369110. PMID 15976821.
- ^ Honore, E., Patel, A. A., Kohl, P., Franz, M. R. & Sachs, F. in Cardiac Mechano-Electric Feedback and Arrhythmias: From Pipette to Patient (Elsevier 2004)
- ^ Maingret F, Honoré E, Lazdunski M, Patel AJ (March 2002). "Molecular basis of the voltage-dependent gating of TREK-1, a mechano-sensitive K(+) channel". Biochem. Biophys. Res. Commun. 292 (2): 339–46. doi:10.1006/bbrc.2002.6674. PMID 11906167.
- ^ Patel, A. J.; Lazdunski, M.; Honore, E. (2001). "Lipid and mechano-gated 2P domain K(+) channels". Současný názor na buněčnou biologii. 13 (4): 422–428. doi:10.1016/S0955-0674(00)00231-3. PMID 11454447.
- ^ Patel, A. J.; Honore, E. (2001). "Properties and modulation of mammalian 2P domain K+ channels". Trends Neurosci. 24 (6): 339–346. doi:10.1016/S0166-2236(00)01810-5. PMID 11356506.
- ^ Maingret, F.; Patel, A. J.; Lesage, F.; Lazdunski, M.; Honore, E. (2000). "Lysophospholipids open the two-pore domain mechano-gated K(+) channels TREK-1 and TRAAK". Journal of Biological Chemistry. 275 (14): 10128–10133. doi:10.1074/jbc.275.14.10128. PMID 10744694.
- ^ Patel, A. J.; Honoré, E; Lesage, F; Fink, M; Romey, G; Lazdunski, M (1999). "Inhalational anesthetics activate two-pore-domain background K+ channels". Nat. Neurosci. 2 (5): 422–426. doi:10.1038/8084. PMID 10321245.
- ^ Patel, A. J.; Honoré, E; Maingret, F; Lesage, F; Fink, M; Duprat, F; Lazdunski, M (1998). "A mammalian two pore domain mechano-gated S-like K+ channel". Časopis EMBO. 17 (15): 4283–4290. doi:10.1093/emboj/17.15.4283. PMC 1170762. PMID 9687497.
- ^ Coste, Bertrand; Xiao, Bailong; Santos, Jose S.; Syeda, Ruhma; Grandl, Jörg; Spencer, Kathryn S.; Kim, Sung Eun; Schmidt, Manuela; et al. (2012). "Piezo proteins are pore-forming subunits of mechanically activated channels". Příroda. 483 (7388): 176–81. Bibcode:2012Natur.483..176C. doi:10.1038/nature10812. PMC 3297710. PMID 22343900.
- ^ Kim, Sung Eun; Coste, Bertrand; Chadha, Abhishek; Cook, Boaz; Patapoutian, Ardem (2012). "The role of Drosophila Piezo in mechanical nociception". Příroda. 483 (7388): 209–12. Bibcode:2012Natur.483..209K. doi:10.1038/nature10801. PMC 3297676. PMID 22343891.
- ^ Coste, B.; Mathur, J.; Schmidt, M .; Earley, T. J.; Ranade, S.; Petrus, M. J.; Dubin, A. E.; Patapoutian, A. (2010). "Are Essential Components of Distinct Mechanically Activated Cation Channels". Věda. 330 (6000): 55–60. Bibcode:2010Sci...330...55C. doi:10.1126/science.1193270. PMC 3062430. PMID 20813920.
- ^ Gottlieb, P.; Sachs, F. Piezo (2012). "Properties of a cation selective mechanical channel". Kanály. 6 (4): 1–6. doi:10.4161/chan.21050. PMC 3508900. PMID 22790400.
- ^ Gottlieb, P. A.; Sachs, F. (2012). "CELL BIOLOGY The sensation of stretch". Příroda. 483 (7388): 163–164. Bibcode:2012Natur.483..163G. doi:10.1038/483163a. PMC 4090763. PMID 22398551.
- ^ Bae, Chilman; Sachs, Frederick; Gottlieb, Philip A. (2011). "The Mechanosensitive Ion Channel Piezo1 Is Inhibited by the Peptide GsMTx4". Biochemie. 50 (29): 6295–300. doi:10.1021/bi200770q. PMC 3169095. PMID 21696149.
- ^ Dedman, Alexandra; Sharif-Naeini, Reza; Folgering, Joost H. A.; Duprat, Fabrice; Patel, Amanda; Honoré, Eric (2008). "The mechano-gated K2P channel TREK-1". European Biophysics Journal. 38 (3): 293–303. doi:10.1007/s00249-008-0318-8. PMID 18369610.
- ^ Sackin, H. (1995). "Mechanosensitive channels". Annu. Physiol. 57: 333–53. doi:10.1146/annurev.ph.57.030195.002001. PMID 7539988.
- ^ Sukharev SI, Martinac B, Arshavsky VY, Kung C (July 1993). "Two types of mechanosensitive channels in the Escherichia coli cell envelope: solubilization and functional reconstitution". Biophys. J. 65 (1): 177–83. Bibcode:1993BpJ....65..177S. doi:10.1016/S0006-3495(93)81044-0. PMC 1225713. PMID 7690260.
- ^ Haswell ES, Phillips R, Rees DC (říjen 2011). „Mechanosenzitivní kanály: co mohou dělat a jak to dělají?“. Struktura. 19 (10): 1356–69. doi:10.1016 / j.str.2011.09.005. PMC 3203646. PMID 22000509.
- ^ Ernstrom GG, Chalfie M (2002). "Genetics of sensory mechanotransduction". Annu. Rev. Genet. 36: 411–53. doi:10.1146/annurev.genet.36.061802.101708. PMID 12429699.
- ^ García-Añoveros J, Corey DP (May 1996). "Touch at the molecular level. Mechanosensation". Curr. Biol. 6 (5): 541–3. doi:10.1016/S0960-9822(02)00537-7. PMID 8805263.
- ^ {cite journal |vauthors=Tay A, Dino DC | title = Magnetic Nanoparticle-Based Mechanical Stimulation for Restoration of Mechano-Sensitive Ion Channel Equilibrium in Neural Networks | journal = Nano Letters | volume = 17 | vydání = 2 | pages = 886-892 | date = January 17 2017 | doi = 10.1021/acs.nanolett.6b04200 }}.
- ^ A b Purves, Dale. (2004). Neurovědy. Sunderland, Massachusetts: Sinauer Associates. 207–209. ISBN 978-0-87893-725-7.
- ^ A b C d E F G h i j k Del Valle ME, Cobo T, Cobo JL, Vega JA (August 2012). "Mechanosensory neurons, cutaneous mechanoreceptors, and putative mechanoproteins". Microsc. Res. Tech. 75 (8): 1033–43. doi:10.1002/jemt.22028. PMID 22461425.
- ^ A b C d Patel A, Sharif-Naeini R, Folgering JR, Bichet D, Duprat F, Honoré E (August 2010). "Canonical TRP channels and mechanotransduction: from physiology to disease states". Pflügers Arch. 460 (3): 571–81. doi:10.1007/s00424-010-0847-8. PMID 20490539.
- ^ A b C d E F G h i López-Larrea, Carlos (2011). Sensing in Nature. New York: Springer Science + Business Media. ISBN 978-1-4614-1703-3.
- ^ A b C d E F G Yin J, Kuebler WM (2010). "Mechanotransduction by TRP channels: general concepts and specific role in the vasculature". Cell Biochem Biophys. 56 (1): 1–18. doi:10.1007/s12013-009-9067-2. PMID 19842065.
- ^ A b C Martinac B (2011). "Bacterial mechanosensitive channels as a paradigm for mechanosensory transduction". Buňka. Physiol. Biochem. 28 (6): 1051–60. doi:10.1159/000335842. PMID 22178995.
- ^ Peyronnet R, Nerbonne JM, Kohl P (2016). "Cardiac mechano-gated ion channels and arrhythmias". Circ. Res. 118 (2): 311–29. doi:10.1161/CIRCRESAHA.115.305043. PMC 4742365. PMID 26838316.
- ^ A b C d E F G h Sachs F (2010). "Stretch-activated ion channels: what are they?". Fyziologie. 25 (1): 50–6. doi:10.1152/physiol.00042.2009. PMC 2924431. PMID 20134028.
- ^ A b Bianchi L (December 2007). "Mechanotransduction: touch and feel at the molecular level as modeled in Caenorhabditis elegans". Mol. Neurobiol. 36 (3): 254–71. doi:10.1007/s12035-007-8009-5. PMID 17955200.
- ^ Formigli L, Meacci E, Sassoli C, Squecco R, Nosi D, Chellini F, Naro F, Francini F, Zecchi-Orlandini S (May 2007). "Cytoskeleton/stretch-activated ion channel interaction regulates myogenic differentiation of skeletal myoblasts". J. Cell. Physiol. 211 (2): 296–306. doi:10.1002/jcp.20936. PMID 17295211.
- ^ Zhao Y, Yamoah EN, Gillespie PG (December 1996). "Regeneration of broken tip links and restoration of mechanical transduction in hair cells". Proc. Natl. Acad. Sci. USA. 93 (26): 15469–74. Bibcode:1996PNAS...9315469Z. doi:10.1073/pnas.93.26.15469. PMC 26428. PMID 8986835.
- ^ Bell J, Bolanowski S, Holmes MH (January 1994). "The structure and function of Pacinian corpuscles: a review". Prog. Neurobiol. 42 (1): 79–128. doi:10.1016/0301-0082(94)90022-1. PMID 7480788.
- ^ A b Lumpkin EA, Caterina MJ (February 2007). "Mechanisms of sensory transduction in the skin". Příroda. 445 (7130): 858–65. Bibcode:2007Natur.445..858L. doi:10.1038/nature05662. PMID 17314972.
- ^ A b C Lumpkin, Ellen A.; Caterina, Michael J. (2006). "Mechanisms of sensory transduction in the skin". Příroda. 445 (7130): 858–865. Bibcode:2007Natur.445..858L. doi:10.1038/nature05662. PMID 17314972.
- ^ Markin, V.S.; Martinac, B. (1991). "Mechanosensitive ion channels as reporters of bilayer expansion. A theoretical model". Biophys. J. 60 (5): 1120–1127. Bibcode:1991BpJ....60.1120M. doi:10.1016/S0006-3495(91)82147-6. PMC 1260167. PMID 1722115.
- ^ A b Perozo, E.; Cortes, D. M.; Sompornpisut, P.; Kloda, A.; Martinac, B. (2002). "Structure of MscL and the gating mechanism of mechanosensitive channels". Příroda. 418 (6901): 942–8. Bibcode:2002Natur.418..942P. doi:10.1038/nature00992. PMID 12198539.
- ^ Hamill, O.P.; McBride, Jr (1997). "Induced membrane hypo /hyper mechanosensitivity A limitation of patch-clamp recording". Annu. Physiol. 59: 621–631. doi:10.1146/annurev.physiol.59.1.621. PMID 9074780.
- ^ Martinac B, Buechner M, Delcour AH, Adler J, Kung C (duben 1987). "Iontový kanál citlivý na tlak v Escherichia coli". Proc. Natl. Acad. Sci. USA. 84 (8): 2297–301. Bibcode:1987PNAS ... 84.2297M. doi:10.1073 / pnas.84.8.2297. PMC 304637. PMID 2436228.
- ^ Perozo, E.; Rees, D.C. (2003). "Structure and mechanism in prokaryotic mecahnosensitive channels". Aktuální názor na strukturní biologii. 13 (4): 432–442. doi:10.1016/S0959-440X(03)00106-4. PMID 12948773.
- ^ Levina, N.; Totemeyer, S.; Stokes, N. R.; Louis, P .; Jones, M. A .; Booth, I. R. (1999). "Protection of Escherichia coli cells against extreme turgor by activation of MscS and MscL mechanosensitivechannels: Identification of genes required for MscS activity". Časopis EMBO. 18 (7): 1730–1737. doi:10.1093/emboj/18.7.1730. PMC 1171259. PMID 10202137.
- ^ Bass, R. B.; Strop, P.; Barclay, M.; Rees, D. (2002). "Crystal structure of Escherichia coli MscS, a voltage-modulated and mechanosensitive channel" (PDF). Věda. 298 (5598): 1582–1587. Bibcode:2002Sci...298.1582B. doi:10.1126/science.1077945. PMID 12446901.
- ^ Pivetti, C. D.; Yen, M. R.; Miller, S .; Busch, W.; Tseng, Y.; Booth, I. R.; Saier, MH (2003). "Two families of mechanosensitive channel proteins". Microbiol. Mol. Biol. Rev. 67 (1): 66–85. doi:10.1128/MMBR.67.1.66-85.2003. PMC 150521. PMID 12626684.
- ^ Vasquez, V.; Sotomayor, M.; Cordero-Morales, J.; Shulten, K.; Perozo, E. (2008). "A Structural mechanism for MscS gating lipid channels in bilayer". Věda. 321 (5893): 1210–14. Bibcode:2008Sci...321.1210V. doi:10.1126/science.1159674. PMC 2897165. PMID 18755978.
- ^ Bezanilla, F.; Perozo, E. (2002). "Force and voltage sensors in one structure". Věda. 298 (5598): 1562–1563. doi:10.1126/science.1079369. PMID 12446894.
- ^ Sukharev, S. I.; Blount, P.; Martinac, B.; Kung, C. (1997). "MECHANOSENSITIVE CHANNELS OF ESCHERICHIA COLI: The MscL Gene, Protein, and Activities". Annu. Physiol. 59: 633–57. doi:10.1146/annurev.physiol.59.1.633. PMID 9074781.
- ^ Sukharev, S. I.; Blount, P.; Martinac, B.; Blattner, F. R .; Kung, C. (1994). "A large mechanosensitive channel in E-coli encoded by MscL alone". Příroda. 368 (6468): 265–268. Bibcode:1994 Natur.368..265S. doi:10.1038 / 368265a0. PMID 7511799.
- ^ Chang, G .; Spencer, R .; Barclay, R.; Lee, A .; Barclay, M.; Rees, C. (1998). "Structure of the MscL homologue from Mycobacterium tuberculosis: a gated mechanosensitive ion channel". Věda. 282 (5397): 2220–2226. Bibcode:1998Sci ... 282.2220C. doi:10.1126 / science.282.5397.2220. PMID 9856938.
- ^ Blount, P; Sukharev, SI; Moe, PC; Schroeder, MJ; Guy, HR; Kung, C. (1996). "Membrane topology and multimeric structure of a mechanosensitive channel protein". Časopis EMBO. 15 (18): 4798–4805. doi:10.1002/j.1460-2075.1996.tb00860.x. PMC 452216. PMID 8890153.
- ^ Arkin IT, Sukharev SI, Blount P, Kung C, Brünger AT (February 1998). "Helicity, membrane incorporation, orientation and thermal stability of the large conductance mechanosensitive ion channel from E-coli". Biochim. Biophys. Acta. 1369 (1): 131–40. doi:10.1016/S0005-2736(97)00219-8. PMID 9528681.
- ^ Sukharev, S.; Betanzos, M.; Chiang, C.S.; Guy, H.R. (2001). "Vratový mechanismus velkého mechanosenzitivního kanálu MscL". Příroda. 409 (6821): 720–724. Bibcode:2001 Natur.409..720S. doi:10.1038/35055559. PMID 11217861.
- ^ A b Perozo, E.; Cortes, D. M.; Sompornpisut, P.; Kloda, A.; Martinac, B. (2002). "Open channel structure of MscL and the gating mechanism of mechanosensitive channels". Příroda. 418 (6901): 942–948. Bibcode:2002Natur.418..942P. doi:10.1038/nature00992. PMID 12198539.
- ^ Wiggins, P; Phillips, R (2004). "Analytic models for mechanotransduction: Gating a mechanosensitive channel". Proc Natl Acad Sci U S A. 101 (12): 4071–6. arXiv:q-bio/0311010. Bibcode:2004PNAS..101.4071W. doi:10.1073/pnas.0307804101. PMC 384697. PMID 15024097.
- ^ Wiggins, P; Phillips, R (2005). "Membrane-protein interactions in mechanosensitivechannels". Biophys J.. 88 (2): 880–902. arXiv:q-bio/0406021. Bibcode:2005BpJ....88..880W. doi:10.1529/biophysj.104.047431. PMC 1305162. PMID 15542561.
- ^ Coste B, Mathur J, Schmidt M, Earley TJ, Ranade S, Petrus MJ, Dubin AE, Patapoutian A (October 2010). "Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels". Věda. 330 (6000): 55–60. Bibcode:2010Sci...330...55C. doi:10.1126/science.1193270. PMC 3062430. PMID 20813920.
- ^ Zarychanski R, Schulz VP, Houston BL, Maksimova Y, Houston DS, Smith B, Rinehart J, Gallagher PG (August 2012). "Mutations in the mechanotransduction protein PIEZO1 are associated with hereditary xerocytosis". Krev. 120 (9): 1908–15. doi:10.1182/blood-2012-04-422253. PMC 3448561. PMID 22529292.
- ^ Coste B, Houge G, Murray MF, Stitziel N, Bandell M, Giovanni MA, Philippakis A, Hoischen A, Riemer G, Steen U, Steen VM, Mathur J, Cox J, Lebo M, Rehm H, Weiss ST, Wood JN, Maas RL, Sunyaev SR, Patapoutian A (March 2013). "Gain-of-function mutations in the mechanically activated ion channel PIEZO2 cause a subtype of Distal Arthrogryposis". Proc. Natl. Acad. Sci. USA. 110 (12): 4667–72. Bibcode:2013PNAS..110.4667C. doi:10.1073/pnas.1221400110. PMC 3607045. PMID 23487782.
- ^ Engler, A.; Shamik, S.; Sweeney, L.; Disher, D. (2006). "Matrix Elasticity Directs Stem Cell Lineage Specification". Buňka. 126 (4): 677–689. doi:10.1016/j.cell.2006.06.044. PMID 16923388.
- ^ Hamill, O.P.; Martinac, B. (2001). "Molecular basis of mechanotransduction in living cells". Physiol. Rev. 81 (2): 685–740. doi:10.1152/physrev.2001.81.2.685. PMID 11274342.
- ^ Nguyen, T .; Clare, B.; Martinac, B.; Martinac, Boris (2005). "The effects of parabens on the mechanosensitive channels". Eur. Biophys. J. 34 (5): 389–396. doi:10.1007/s00249-005-0468-x. PMID 15770478.
- ^ Guharay F, Sachs F (July 1984). "Stretch-activated single ion channel currents in tissue-cultured embryonic chick skeletal muscle". J. Physiol. 352: 685–701. doi:10.1113/jphysiol.1984.sp015317. PMC 1193237. PMID 6086918.
- ^ Tang, Y .; Cao, G.; Chen, X .; et al. (2006). "A finite element framework for studying the mechanical response of macromolecules: application to the gating of the mechanosensitive channel MscL". Biophys J.. 91 (4): 1248–63. Bibcode:2006BpJ....91.1248T. doi:10.1529/biophysj.106.085985. PMC 1518658. PMID 16731564.
- ^ A b Patel A, Sharif-Naeini R, Folgering JR, Bichet D, Duprat F, Honoré E (2010). "Canonical TRP channels and mechanotransduction: from physiology to disease states". Pflügers Arch. 460 (3): 571–81. doi:10.1007/s00424-010-0847-8. PMID 20490539.
- ^ Maingret F, Fosset M, Lesage F, Lazdunski M, Honoré E (January 1999). "TRAAK is a mammalian neuronal mechano-gated K+ channel". J. Biol. Chem. 274 (3): 1381–7. doi:10.1074/jbc.274.3.1381. PMID 9880510.
- ^ Patel AJ, Honoré E, Maingret F, Lesage F, Fink M, Duprat F, Lazdunski M (August 1998). "A mammalian two pore domain mechano-gated S-like K+ channel". EMBO J.. 17 (15): 4283–90. doi:10.1093/emboj/17.15.4283. PMC 1170762. PMID 9687497.
- ^ Nagasawa M, Kanzaki M, Iino Y, Morishita Y, Kojima I (2001). "Identification of a novel chloride channel expressed in the endoplasmic reticulum, golgi apparatus, and nucleus". J. Biol. Chem. 276 (23): 20413–20418. doi:10.1074/jbc.M100366200. PMID 11279057.
- ^ Ozeki-Miyawaki C, Moriya Y, Tatsumi H, Iida H, Sokabe M (2005). "Identification of functional domains of Mid1, a stretch-activated channel component, necessary for localization to the plasma membrane and Ca2+ permeation". Exp. Cell Res. 311 (1): 84–95. doi:10.1016/j.yexcr.2005.08.014. PMID 16202999.
The following is not referenced in the article, and/or is in conflict with Engler, A. et al., 2006:
- Perozo, E; Kloda, A; Cortes, DM; et al. (2002). "Fyzikální principy, které jsou základem transdukce dvouvrstvých deformačních sil během mechanosenzitivního hradlování". Přírodní strukturní a molekulární biologie. 9 (9): 696–703. doi:10.1038 / nsb827. PMID 12172537.


