Tetrafluorid titaničitý - Titanium tetrafluoride
 | |
| Jména | |
|---|---|
| Název IUPAC Fluorid titaničitý | |
| Ostatní jména Tetrafluorid titaničitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.029.106 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| TiF4 | |
| Molární hmotnost | 123,861 g / mol |
| Vzhled | bílý prášek hygroskopický |
| Hustota | 2,798 g / cm3 |
| Bod tání | 377 ° C (711 ° F; 650 K) |
| Bod varu | vznešené |
| Nebezpečí | |
Klasifikace EU (DSD) (zastaralý) | nezapsáno |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
jiný anionty | Bromid titaničitý Chlorid titaničitý Jodid titaničitý |
Související sloučeniny | Fluorid titaničitý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
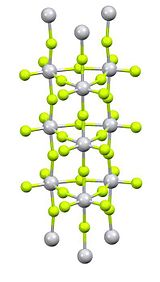
Fluorid titaničitý je anorganická sloučenina s vzorec TiF4. Je to bílá hygroskopický pevný. Na rozdíl od ostatních tetrahalogenidů titanu přijímá polymerní strukturu.[1] Stejně jako ostatní tetrahalogenidy, TiF4 je silný Lewisova kyselina.
Příprava, struktura, reakce
Tradiční metoda zahrnuje zpracování chloridu titaničitého přebytkem fluorovodík:
- TiCl4 + 4 HF → TiF4 + 4 HCl
Čištění probíhá sublimací, která zahrnuje reverzibilní praskání polymerní struktury.[2]Rentgenová krystalografie ukazuje, že centra Ti jsou oktaedrická, ale spojená v neobvyklé sloupové struktuře.[3]
TiF4 tvoří adukty s mnoha ligandy. Jedním z příkladů je cis-TiF4(MeCN)2, který je tvořen působením acetonitril.[4]
Reference
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. Sv. 1. str. 200.
- ^ Bialowons, H .; Mueller, M .; Mueller, B.G. (1995). „Titantetrafluorid - Eine Überraschend einfache Kolumnarstruktur“. Zeitschrift für Anorganische und Allgemeine Chemie. 621: 1227–1231. doi:10.1002 / zaac.19956210720.
- ^ Nikiforov, Grigory B .; Roesky, Herbert W .; Koley, Debasis (2014). "Průzkum komplexů fluoridu titaničitého, jejich příprava, reaktivita a aplikace". Recenze koordinační chemie. 258-259: 16–57. doi:10.1016 / j.ccr.2013.09.002.
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |

