Dusičnan titaničitý - Titanium nitrate - Wikipedia
 | |
| Jména | |
|---|---|
| Ostatní jména tetranitrát titaničitý, tetranitratotitan | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.222.601 |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Ti (č3)4 | |
| Molární hmotnost | 295,8866 g / mol |
| Vzhled | bílá těkavá pevná látka |
| Hustota | 2.192[1] |
| Bod tání | 58,5 ° C (137,3 ° F; 331,6 K) |
| Bod varu | rozložit |
| Rozpustný | |
| Struktura[2] | |
| monoklinický | |
| P21/C | |
A = 7.80, b = 13.57, C = 10,34 Å a = 90 °, β = 125,0 °, γ = 90 ° | |
Objem mřížky (PROTI) | 896,52 Å3 |
Jednotky vzorce (Z) | 4 |
| 8 | |
| zploštělý čtyřboký | |
| Související sloučeniny | |
Související sloučeniny | dusičnan hafnia, dusičnan zirkoničitý, fosforečnan titaničitý, chloristan titaničitý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Dusičnan titaničitý je anorganická sloučenina se vzorcem Ti (NO3)4. Je to bezbarvá diamagnetická pevná látka, která snadno sublimuje. Je to neobvyklý příklad těkavého binárního dusičnanu přechodného kovu. Nejasně definované druhy zvané dusičnan titaničitý se vyrábějí rozpuštěním titanu nebo jeho oxidů v kyselině dusičné.
Příprava
Podobně jako jeho původní metoda,[3][4] Ti (č3)4 se připravuje nitrací sloučeniny chlorid titaničitý použitím oxid dusný:[5]
- TiCl4 + 4 N.2Ó5 → Ti (č3)4 + 4 ClNO2
Hydratovaný dusičnan titaničitý se vyrábí rozpuštěním sloučenin titanu v kyselině dusičné.[6]
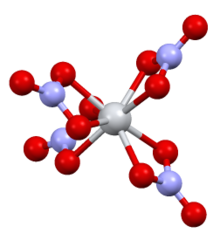
Struktura
Komplex má D.2d symetrie se čtyřmi bidentátovými dusičnanovými ligandy. Vzdálenosti N-O jsou 1,29 Å a 1,185 Å (nekoordinované).[2]
Fyzikální vlastnosti
V infračerveném spektru absorbuje silně na 1635 cm−1, přiřazený vibračnímu režimu N-O.[7]
Je rozpustný v nepolárních rozpouštědlech chlorid křemičitý a chlorid uhličitý.[8][4]
Reakce
Dusičnan titaničitý je hygroskopický a převádí se na špatně definované hydráty.[9] Bezvodý materiál je vysoce reaktivní, dokonce i vůči uhlovodíkům.[9] Dusičnan titaničitý také reaguje s n-dodekan,[10] p-dichlorbenzen, anisol, bifenyl,[10][11]
Tepelně se rozkládá na oxid titaničitý.[12]
Reference
- ^ „Dusičnan titaničitý (Ti (NO3) 4)“. Citováno 27. září 2014.
- ^ A b Garner, C. David; Ian H. Hillier; Martyn F. Guest (1975). „Ab initio samo-konzistentní polní molekulárně-orbitální výpočet základního stavu tetranitratotitanu (IV); komentáře k reaktivitě dusičnanů bezvodého kovu“. Journal of the Chemical Society, Dalton Transactions (19): 1934. doi:10.1039 / DT9750001934. ISSN 0300-9246.
- ^ Reihlen, Hans; Andreas Hake (1927). „Über die Konstitution des N2O4 und N2O3 und die Addsverbindungen von Nitro- und Nitrosokörpern an Zinn- und Titantetrachlorid“. Justnal Liebig's Annalen der Chemie (v němčině). 452 (1): 47–67. doi:10.1002 / jlac.19274520104. ISSN 0075-4617.
- ^ A b Schmeisser, Martin (1955). „Die Chemie der anorganischen Acylnitrate (ein Problem des Nitrylchlorids) und Acylperchlorate (ein Problem des Dichlorhexoxyds)“. Angewandte Chemie (v němčině). 67 (17–18): 493–501. doi:10,1002 / ange.19550671708. ISSN 0044-8249.
- ^ P. Ehrlich „Tetranitrát titaničitý“ v Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. Sv. 1. str. 1237.
- ^ Wiberg, Egon; Wiberg, Nils (2001). Anorganická chemie. Akademický tisk. str. 1331. ISBN 9780123526519. Citováno 28. září 2014.
- ^ C. C. Addison, N. Logan, S. C. Wallwork a C. D. Garner, „Structural Aspects of Coordinated Nitrate Groups“ Quart. Rev., Chem. Soc., 1971, svazek 25, 289-322. doi:10.1039 / qr9712500289.
- ^ Amos, D.W .; G.W. Flewett (1974). "Ramanova spektra dusičnanů titanu (IV) a cínu (IV)". Spectrochimica Acta Část A: Molekulární spektroskopie. 30 (2): 453–461. Bibcode:1974AcSpA..30..453A. doi:10.1016/0584-8539(74)80085-1. ISSN 0584-8539.
- ^ A b Amos, D.W .; D.A. Baines, G.W. Flewett (1973). "Nitrace dusičnanem titaničitým". Čtyřstěn dopisy. 14 (34): 3191–3194. doi:10.1016 / S0040-4039 (00) 79808-X. ISSN 0040-4039.
- ^ A b Coombes, Robert G .; Leslie W. Russell (1974). "Nitrace aromatických sloučenin tetranitratotitanem (IV) v roztoku tetrachlormethanu". Journal of the Chemical Society, Perkin Transactions 2 (7): 830. doi:10.1039 / P29740000830. ISSN 0300-9580.
- ^ Schofield, Kenneth (1980). Aromatická nitrace. Archiv CUP. 97–98. ISBN 9780521233620. Citováno 27. září 2014.
- ^ Allendorf, Mark Donald (01.01.1999). "Oxid titaničitý CVD z dusičnanu titaničitého ...". Sborník ze sympozia o základní syntéze materiálů v plynné fázi v plynné fázi a na povrchu. Elektrochemická společnost. 395–397. ISBN 9781566772174. Citováno 27. září 2014.
Jiné čtení
- Partington, J. R .; A. L. Whynes (1949). „660. Reakce nitrosylchloridu. Část II“. Journal of the Chemical Society (obnoveno): 3135. doi:10.1039 / JR9490003135. ISSN 0368-1769.
- Dauerman, L .; G.E. Salser (1973). "Hmotnostní spektra kovalentních anorganických dusičnanů: dusičnan měďnatý a dusičnan titaničitý". Journal of Anorganic and Nuclear Chemistry. 35 (1): 304–306. doi:10.1016/0022-1902(73)80643-8. ISSN 0022-1902.
