Tetrabromid titaničitý - Titanium tetrabromide
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Bromid titaničitý | |
| Ostatní jména Tetrabromid titaničitý | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.029.259 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| TiBr4 | |
| Molární hmotnost | 367,483 g / mol |
| Vzhled | hnědé krystaly hygroskopický |
| Hustota | 3,25 g / cm3 |
| Bod tání | 39 ° C (102 ° F; 312 K) |
| Bod varu | 230 ° C (446 ° F; 503 K) |
| hydrolyzuje | |
| Rozpustnost v jiných rozpouštědlech | chlorované uhlovodíky, benzen |
| Struktura | |
| krychlový, Pa3, Z = 8 | |
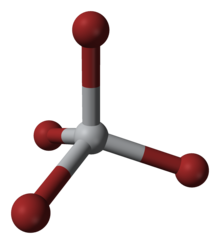
| Čtyřboká | |
| 0 D | |
| Nebezpečí | |
| Hlavní nebezpečí | korozívní |
| R-věty (zastaralý) | 14-34 |
| S-věty (zastaralý) | 26-36/37/39-45 |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavé |
| Související sloučeniny | |
jiný anionty | Chlorid titaničitý Fluorid titaničitý Jodid titaničitý |
Související sloučeniny | Bromid titaničitý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Tetrabromid titaničitý je chemická sloučenina s vzorec TiBr4. Je to nejvíce těkavý bromid přechodného kovu. Vlastnosti TiBr4 jsou průměrem TiCl4 a TiI4. Některé klíčové vlastnosti těchto čtyř koordinovaných druhů Ti (IV) jsou jejich vysoká Lewisova kyselost a vysoká rozpustnost v nepolárních organických rozpouštědlech. TiBr4 je diamagnetický, odrážející d0 konfigurace kovového středu.[1]
Příprava a struktura
Tento čtyřkoordinovaný komplex přijímá čtyřbokou geometrii. Může být připraven několika způsoby: (i) z prvků, (ii) reakcí TiO2 s uhlíkem a bromem (viz Krollov proces ) a (iii) zpracováním TiCl4 s HBr.
Reakce
Tetrabromid titaničitý tvoří adukty, jako je TiBr4(THF )2 a [TiBr5]−.[2] S objemnými dárcovskými ligandy, jako je např 2-methylpyridin (2-Mepy), tvoří se pět koordinované adukty. TiBr4(2-MePy) je trigonální bipyramidový s pyridinem v rovníkové rovině.[3]
TiBr4 byl použit jako Lewisova kyselina katalyzátor v organická syntéza.[4]
Tetrabromid a tetrachloridy titanu reagují za vzniku statistické směsi směsných tetrahalogenidů, TiBr4 − xClX (x = 0-4). Mechanismus toho redistribuční reakce je nejistý. Jedna navrhovaná cesta vyvolává intermediacu dimery.[5]
Bezpečnost
TiBr4 rychle hydrolyzuje, potenciálně nebezpečně, aby se uvolnil bromovodík, jinak známá jako kyselina bromovodíková.
Reference
- ^ Holleman, A. F .; Wiberg, E. "Anorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Colin S. Creaser a J. Alan Creighton (1975). „Pentachlor- a pentabrom-titanát (IV) ionty“. J. Chem. Soc., Dalton Trans. (14): 1402–1405. doi:10.1039 / DT9750001402.
- ^ Hensen, K .; Lemke, A .; Bolte, M. (2000). „Tetrabrom (2-methylpyridin-N) -titanát (IV)“. Acta Crystallographica. C56 (12): e565 – e566. doi:10.1107 / S0108270100015407.
- ^ B. Patterson, S. Marumoto a S. D. Rychnovsky (2003). „Titan (IV) propagované cyklizace Mukaiyama Aldol-Prins“. Org. Lett. 5 (17): 3163–3166. doi:10.1021 / ol035303n. PMID 12917007.
- ^ S. P. Webb a M. S. Gordon (1999). „Intermolekulární sebeinterakce tetrahalogenidů titanu TiX4 (X = F, Cl, Br)“. J. Am. Chem. Soc. 121 (11): 2552–2560. doi:10.1021 / ja983339i.

