Oxid dusný - Dinitrogen tetroxide
| |||
 Oxid dusičitý při -196 ° C, 0 ° C, 23 ° C, 35 ° C a 50 ° C. (NE 2) převádí na bezbarvý oxid dusný (N 2Ó 4) při nízkých teplotách a vrátí se na NE 2 při vyšších teplotách. | |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Oxid dusný | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.031.012 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 1067 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| N2Ó4 | |||
| Molární hmotnost | 92.011 g / mol | ||
| Vzhled | Bezbarvá kapalina, oranžový plyn | ||
| Hustota | 1.44246 g / cm3 (kapalina, 21 ° C) | ||
| Bod tání | -11,2 ° C (11,8 ° F; 261,9 K) a rozkládá se na NO2 | ||
| Bod varu | 21,69 ° C (71,04 ° F; 294,84 K) | ||
| Reaguje za vzniku kyseliny dusité a dusičné | |||
| Tlak páry | 96 kPa (20 ° C)[1] | ||
| −23.0·10−6 cm3/ mol | |||
Index lomu (nD) | 1.00112 | ||
| Struktura | |||
| Rovinný, D2h | |||
| malý, nenulový | |||
| Termochemie | |||
Std molární entropie (S | 304.29 J / K⋅mol[2] | ||
Std entalpie of formace (ΔFH⦵298) | +9.16 kJ / mol[2] | ||
| Nebezpečí | |||
| Bezpečnostní list | Externí bezpečnostní list | ||
Klasifikace EU (DSD) (zastaralý) | |||
| R-věty (zastaralý) | R26, R34 | ||
| S-věty (zastaralý) | (S1 / 2), S9, S26, S28, S36 / 37/39, S45 | ||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | Nehořlavé | ||
| Související sloučeniny | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Oxid dusný, běžně označované jako oxid dusičitý, a někdy, obvykle mezi raketovými inženýry bývalého SSSR / Ruska, jako amyl, je chemická sloučenina N2Ó4. Je to užitečné činidlo v chemické syntéze. Tvoří rovnovážná směs s oxid dusičitý.
Oxid dusný je silný okysličovadlo to je hypergolický (spontánně reaguje) při kontaktu s různými formami hydrazin, což učinilo pár běžným bipropellant pro rakety.
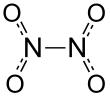
Struktura a vlastnosti
Dinitrogen tetroxid lze považovat za dva nitroskupiny (-NE2) spojené dohromady. Tvoří rovnovážná směs s oxid dusičitý.[5] Molekula je rovinná se vzdáleností vazby N-N 1,78 Vzdálenosti Å a N-O 1,19 A. Vzdálenost N-N odpovídá slabé vazbě, protože je výrazně delší než průměrná délka jednoduché vazby N-N 1,45 A.[6]
Na rozdíl od NE2, N2Ó4 je diamagnetický protože nemá nepárové elektrony.[7] Kapalina je také bezbarvá, ale může se jevit jako hnědavě žlutá kapalina kvůli přítomnosti NO2 podle následující rovnováhy:
- N2Ó4 ⇌ 2 NE2
Vyšší teploty tlačí rovnováhu směrem k oxidu dusičitému. Nevyhnutelně je součástí oxidu dusného smog obsahující oxid dusičitý.
Výroba
Oxid dusný se vyrábí katalytické oxidace z amoniak: pára se používá jako a ředící ke snížení teploty spalování. V prvním kroku se amoniak oxiduje na oxid dusnatý:
- 4 NH3 + 5 O.2 → 4 NO + 6 H2Ó
Většina vody kondenzuje a plyny se dále ochlazují; vyrobený oxid dusnatý se oxiduje na oxid dusičitý, který se poté dimerizuje na oxid dusičitý:
- 2 NO + O2 → 2 NO2
- 2 NE2 ⇌ N2Ó4
a zbytek vody se odstraní jako kyselina dusičná. Plyn je v podstatě čistý oxid dusičitý, který se kondenzuje na oxid dusný v zkapalněném roztoku chlazeném solankou.[Citace je zapotřebí ]
Oxid dusný může být také vyroben reakcí koncentrované kyseliny dusičné a kovové mědi. Tato syntéza je praktičtější v laboratorním prostředí a běžně se používá jako demonstrace nebo experiment v laboratořích vysokoškolské chemie. Oxidace mědi kyselinou dusičnou je komplexní reakce, při které se tvoří různé oxidy dusíku s různou stabilitou, která závisí na koncentraci kyseliny dusičné, přítomnosti kyslíku a dalších faktorech. Nestabilní látky dále reagují za vzniku oxidu dusičitého, který se poté čistí a kondenzuje za vzniku oxidu dusného.
Používejte jako raketový pohon
Oxid dusičitý se používá jako okysličovadlo v jednom z nejdůležitějších raketových pohonných hmot, protože může být skladován jako kapalina při pokojové teplotě. Na začátku roku 1944 provedli němečtí vědci výzkum použitelnosti oxidu dusného jako oxidačního činidla pro raketové palivo, ačkoli jej Němci používali jen ve velmi omezené míře jako přísadu pro S-Stoff (dýmavá kyselina dusičná). Stalo se skladovatelným oxidačním činidlem volby pro mnoho raket ve Spojených státech i USA SSSR koncem 50. let. Je to hypergolická pohonná látka v kombinaci s a hydrazin -na základě raketové palivo. Jedno z prvních použití této kombinace bylo na Rodina raket Titan původně používán jako ICBM a pak jako nosná vozidla pro mnoho kosmických lodí. Používá se na amerických kosmických lodích Gemini a Apollo a také na raketoplánu a nadále se používá jako pohonná látka pro udržování stanic na většině geostacionárních satelitů a mnoha sondách v hlubokém vesmíru. Je také primárním oxidačním činidlem pro Rusko Protonová raketa.
Když se používá jako hnací plyn, oxid dusný se obvykle označuje jednoduše jako oxid dusičitý a zkratka NTO je široce používán. Navíc se NTO často používá s přidáním malého procenta oxid dusnatý, který inhibuje korozní praskání slitin titanu napětím, a v této formě se NTO pro hnací plyn označuje jako směsné oxidy dusíku (PO). Většina kosmických lodí nyní používá MON místo NTO; například systém řízení reakce raketoplánu používal MON3 (NTO obsahující 3% hmotnostní NO).[8]
Nehoda Apollo-Sojuz
Dne 24. července 1975 ovlivnila otrava NTO tři USA astronauti na posledním sestupu na Zemi po Zkušební projekt Apollo-Sojuz let. To bylo způsobeno přepínačem, který byl omylem ponechán ve špatné poloze, což umožnilo aktivaci ovládacích trysek polohy po otevření přívodu čerstvého vzduchu do kabiny, což umožnilo výparům NTO vstoupit do kabiny. Jeden člen posádky během sestupu ztratil vědomí. Po přistání byla posádka hospitalizována po dobu pěti dnů pro chemickou indukci zápal plic a otok.[9][10]
Výroba energie pomocí N2Ó4
Tendence N2Ó4 reverzibilně rozbít na NO2 vedl k výzkumu jeho použití v pokročilých systémech výroby energie jako takzvaného disociačního plynu.[11] „Chladný“ oxid dusný je stlačen a zahříván, což způsobí jeho disociaci na oxid dusičitý při poloviční molekulové hmotnosti. Tento horký oxid dusičitý se expanduje turbínou, ochlazuje ji a snižuje tlak a poté se dále ochladí v chladiči, což způsobí její rekombinaci na oxid dusičitý při původní molekulové hmotnosti. Pak je mnohem snazší komprimovat a znovu spustit celý cyklus. Takový disociační plyn Braytonovy cykly mají potenciál značně zvýšit účinnost zařízení pro přeměnu energie.[12]
Chemické reakce
Meziprodukt při výrobě kyseliny dusičné
Kyselina dusičná se vyrábí ve velkém měřítku prostřednictvím N2Ó4. Tento druh reaguje s vodou a poskytuje obojí kyselina dusitá a kyselina dusičná:
- N2Ó4 + H2O → HNO2 + HNO3
Koprodukt HNO2 při zahřátí nepřiměřené na NE a více kyseliny dusičné. Při vystavení kyslíku se NO přeměňuje zpět na oxid dusičitý:
- 2 NO + O2 → 2 NO2
Výsledné NO2 a N2Ó4 lze vrátit do cyklu, aby se znovu získala směs kyseliny dusité a dusičné.
Syntéza dusičnanů kovů
N2Ó4 chová se jako sůl [NO+] [NE3−], první je silný oxidant:
- 2 N2Ó4 + M → 2 NO + M (NO3)2
Pokud se dusičnany kovů připravují z N2Ó4 ve zcela bezvodých podmínkách může být s mnoha přechodnými kovy vytvořena řada kovalentních dusičnanů kovů. Je to proto, že existuje termodynamická preference, aby se dusičnanový ion navázal kovalentně s takovými kovy, než aby vytvořil iontovou strukturu. Takové sloučeniny musí být připraveny v bezvodých podmínkách, protože dusičnanový iont je mnohem slabší ligand než voda, a pokud je voda přítomna, vytvoří se jednoduchý hydratovaný dusičnan. Dotyčné bezvodé dusičnany jsou samy kovalentní a mnoho z nich, např. bezvodý dusičnan měďnatý, jsou těkavé při pokojové teplotě. Bezvodý dusičnan titaničitý sublimuje ve vakuu pouze při 40 ° C. Mnoho z bezvodých dusičnanů přechodných kovů má nápadné barvy. Tuto oblast chemie vyvinul Cliff Addison a Norman Logan na University of Nottingham ve Velké Británii během 60. a 70. let, kdy byly používány vysoce účinné vysoušedla a suché krabice začal být k dispozici.
Reference
- ^ Mezinárodní karta chemické bezpečnosti https://www.ilo.org/dyn/icsc/showcard.display?p_lang=cs&p_card_id=0930&p_version=2
- ^ A b P.W. Atkins a J. de Paula, Fyzikální chemie (8. vydání, W.H. Freeman, 2006) str. 999
- ^ "Chemický datový list: oxid dusičitý". CAMEO Chemicals NOAA. Citováno 8. září 2020.
- ^ "Shrnutí sloučeniny: oxid dusičitý". PubChem. Citováno 8. září 2020.
- ^ Bent, Henry A. (1963). "Dimery oxidu dusičitého. II. Struktura a lepení". Anorganická chemie. 2 (4): 747–752. doi:10.1021 / ic50008a020.
- ^ Petrucci, Ralph H .; Harwood, William S .; Herring, F. Geoffrey (2002). Obecná chemie: principy a moderní aplikace (8. vydání). Horní sedlo, NJ: Prentice Hall. str.420. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.CS1 maint: ref = harv (odkaz)
- ^ Holleman, A. F .; Wiberg, E. "Anorganic Chemistry" Academic Press: San Diego, 2001. ISBN 978-0-12-352651-9.
- ^ „Rocket Propellant Index“. Archivovány od originál dne 2008-05-11. Citováno 2005-03-01.
- ^ „Značka nese vinu za únik plynu Apollo“, Florence, AL - Times Daily newspaper, 10. srpna 1975
- ^ Sotos, John G., MD. „Lékařské historie astronautů a kosmonautů“, 12. května 2008, přístup k 1. dubnu 2011.
- ^ Stochl, Robert J. (1979). Zvýšení potenciálního výkonu použitím reakčního plynu (oxidu dusičitého) jako pracovní tekutiny v uzavřeném Braytonově cyklu (PDF) (Technická zpráva). NASA. TM-79322.
- ^ Ragheb, R. „Koncepty jaderných reaktorů a termodynamické cykly“ (PDF). Citováno 1. května 2013.
externí odkazy
- Mezinárodní karta chemické bezpečnosti 0930
- Národní seznam znečišťujících látek - přehled oxidů dusíku
- NIOSH Kapesní průvodce chemickými nebezpečími: Oxid dusičitý
- Encyklopedie plynných kapalin: NO2 / N2Ó4
- Poliakoff, Martyn (2009). „The Chemistry of Lunar Lift-Off: Our Apollo 11 40th Anniversary Special“. Periodická tabulka videí. University of Nottingham.