Oxid boritý - Boron trioxide
![Krystalová struktura B2O3 [1]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/B2O3powder.JPG/220px-B2O3powder.JPG) | |
 | |
| Jména | |
|---|---|
| Ostatní jména oxid boritý, oxid diboritý, oxid boritý, oxid boritý, boria Anhydrid kyseliny borité | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.013.751 |
| Číslo ES |
|
| 11108 | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| B2Ó3 | |
| Molární hmotnost | 69,6182 g / mol |
| Vzhled | bílá, sklovitá pevná látka |
| Hustota | 2,460 g / cm3, kapalný; 2,55 g / cm3trigonální; |
| Bod tání | 450 ° C (842 ° F; 723 K) (trigonální) 510 ° C (čtyřboká) |
| Bod varu | 1860 ° C (3380 ° F; 2130 K),[2] sublimuje při 1500 ° C[3] |
| 1,1 g / 100 ml (10 ° C) 3,3 g / 100 ml (20 ° C) 15,7 g / 100 ml (100 ° C) | |
| Rozpustnost | částečně rozpustný v methanolu |
| Kyselost (strK.A) | ~ 4 |
| -39.0·10−6 cm3/ mol | |
| Termochemie | |
Tepelná kapacita (C) | 66,9 J / mol K. |
Std molární entropie (S | 80,8 J / mol K. |
Std entalpie of formace (ΔFH⦵298) | -1254 kJ / mol |
Gibbsova volná energie (ΔFG˚) | -832 kJ / mol |
| Nebezpečí | |
| Hlavní nebezpečí | Dráždivý[4] |
| Bezpečnostní list | Vidět: datová stránka |
| Piktogramy GHS |  |
| Signální slovo GHS | Nebezpečí |
| H360FD | |
| P201, P202, P281, P308 + 313, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | nehořlavý |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 3163 mg / kg (orální, myš)[5] |
| NIOSH (Limity expozice USA zdraví): | |
PEL (Dovolený) | TWA 15 mg / m3[4] |
REL (Doporučeno) | TWA 10 mg / m3[4] |
IDLH (Okamžité nebezpečí) | 2000 mg / m3[4] |
| Stránka s doplňkovými údaji | |
| Index lomu (n), Dielektrická konstanta (εr), atd. | |
Termodynamické data | Fázové chování pevná látka - kapalina - plyn |
| UV, IR, NMR, SLEČNA | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Oxid boritý (nebo oxid diboritý) jeden z oxidy boru. Je to bílá, sklovitá pevná látka se vzorcem B.2Ó3. Téměř vždy se vyskytuje jako skelná (amorfní) forma; nicméně, to může být krystalizováno po rozsáhlé žíhání (to znamená za delšího tepla).
Sklovitý oxid boritý (g-B2Ó3) je považován za složený z boroxolové kruhy což jsou šestičlenné kruhy složené ze střídavého 3-souřadnicového boru a 2-souřadnicového kyslíku. Kvůli obtížnosti vytváření neuspořádaných modelů se správnou hustotou u mnoha boroxolové kruhy, tento pohled byl zpočátku kontroverzní, ale takové modely byly nedávno postaveny a vykazují vlastnosti ve vynikající shodě s experimentem.[6] Nyní je známo, z experimentálních a teoretických studií,[7][8][9][10][11] že podíl atomů boru patřících k boroxolovým prstencům ve sklovině B2Ó3 je někde mezi 0,73 a 0,83, s 0,75 (3⁄4) odpovídající poměru 1: 1 mezi kruhovými a nekruhovými jednotkami. Počet boroxolových kruhů se v kapalném stavu s rostoucí teplotou snižuje.[12]
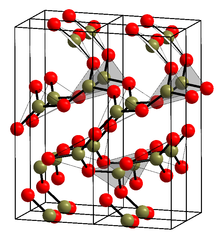
Krystalická forma (α-B2Ó3) (viz struktura v infoboxu[1]) se skládá výhradně z BO3 trojúhelníky. Tato trigonální, křemenný síť prochází a coesite - jako transformace na monoklinický β-B2Ó3 na několika gigapascalech (9,5 GPa).[13]
Příprava
Oxid boritý se vyrábí zpracováním borax s kyselina sírová v fúzní pec. Při teplotách nad 750 ° C se vrstva roztaveného oxidu boritého odděluje od síran sodný. Poté se dekantuje, ochladí a získá se v čistotě 96–97%.[3]
Další metodou je vytápění kyselina boritá nad ~ 300 ° C. Kyselina boritá se zpočátku rozloží na páru (H2Ó(G)) a kyselina metaboritá (HBO2) při teplotě kolem 170 ° C a dalším zahřátím nad 300 ° C se vyprodukuje více páry a oxidu diboronitého. Reakce jsou:
- H3BO3 → HBO2 + H2Ó
- 2 HBO2 → B2Ó3 + H2Ó
Kyselina boritá přechází na bezvodý mikrokrystalický B2Ó3 ve vyhřívané fluidní vrstvě.[14] Pečlivě řízená rychlost ohřevu zamezuje lepení při vývoji vody. Roztavený oxid boritý napadá silikáty. Vnitřně grafitizované zkumavky pomocí acetylenového tepelného rozkladu jsou pasivovány.[15]
Krystalizace roztaveného α-B2Ó3 při okolním tlaku je silně kineticky znevýhodněn (porovnejte hustoty kapalin a krystalů). Prahové podmínky pro krystalizaci amorfní pevné látky jsou 10 kbar a ~ 200 ° C.[16] Navrhovaná krystalová struktura v enantiomorfních prostorových skupinách P31(# 144); P32(#145)[17][18] (např. y-glycin) byl revidován na enantiomorfní prostorové skupiny P3121 (# 152); P3221(#154)[19](např. a-křemen).
Oxid boritý se také vytvoří, když diboran (B2H6) reaguje s kyslíkem ve vzduchu nebo stopovými množstvími vlhkosti:
- 2B2H6(g) +302(g) → 2B2Ó3s) + 6H2(G)
- B2H6(g) + 3H2O (g) → B2Ó3s) + 6H2(G)[20]
Aplikace
- Tavidlo pro sklenka a emaily
- Výchozí materiál pro syntézu jiných bór sloučeniny jako karbid boru
- Přísada používaná ve skleněných vláknech (optická vlákna )
- Složka použitá při výrobě borosilikátové sklo
- Inertní krycí vrstva v procesu kapalné enkapsulace Czochralski pro výrobu galium arsenid monokrystal
- Jako kyselina katalyzátor v organická syntéza
Viz také
Reference
- ^ A b Gurr, G. E .; Montgomery, P. W .; Knutson, C. D .; Gorres, B. T. (1970). "Krystalová struktura trigonálního oxidu diboronového". Acta Crystallographica B. 26 (7): 906–915. doi:10.1107 / S0567740870003369.
- ^ Vysokoteplotní koroze a chemie materiálů: sborník z Per Kofstad Memorial Symposium. Sborník elektrochemické společnosti. Elektrochemická společnost. 2000. str. 496. ISBN 978-1-56677-261-7.
- ^ A b Patnaik, P. (2003). Příručka anorganických chemických sloučenin. McGraw-Hill. p. 119. ISBN 978-0-07-049439-8. Citováno 2009-06-06.
- ^ A b C d NIOSH Kapesní průvodce chemickými nebezpečími. "#0060". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ "Oxid boritý". Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Ferlat, G .; Charpentier, T .; Seitsonen, A. P .; Takada, A .; Lazzeri, M .; Cormier, L .; Calas, G .; Mauri. F. (2008). "Boroxolové kroužky v tekutém a sklivcovém B2Ó3 z prvních principů “. Phys. Rev. Lett. 101 (6): 065504. Bibcode:2008PhRvL.101f5504F. doi:10.1103 / PhysRevLett.101.065504. PMID 18764473.; Ferlat, G .; Seitsonen, A. P .; Lazzeri, M .; Mauri, F. (2012). „Skryté polymorfy řídí vitrifikaci v B2Ó3". Přírodní materiály Dopisy. 11 (11): 925–929. arXiv:1209.3482. Bibcode:2012NatMa..11..925F. doi:10,1038 / NMAT3416. PMID 22941329.
- ^ Hung, I .; et al. (2009). "Stanovení rozložení vazebného úhlu ve sklivci B2Ó3 rotační (DOR) NMR spektroskopií ". Journal of Solid State Chemistry. 182 (9): 2402–2408. Bibcode:2009JSSCh.182.2402H. doi:10.1016 / j.jssc.2009.06.025.
- ^ Soper, A. K. (2011). „Boroxolové kruhy z difrakčních údajů o sklovitém oxidu boritém“. J. Phys .: Condens. Hmota. 23 (36): 365402. Bibcode:2011JPCM ... 23.5402S. doi:10.1088/0953-8984/23/36/365402. PMID 21865633.
- ^ Joo, C .; et al. (2000). "Kruhová struktura skla z oxidu boritého". Časopis nekrystalických pevných látek. 261 (1–3): 282–286. Bibcode:2000JNCS..261..282J. doi:10.1016 / s0022-3093 (99) 00609-2.
- ^ Zwanziger, J. W. (2005). „NMR reakce boroxolových kruhů: studie funkční teorie hustoty“. Jaderná magnetická rezonance v pevné fázi. 27 (1–2): 5–9. doi:10.1016 / j.ssnmr.2004.08.004. PMID 15589722.
- ^ Micoulaut, M. (1997). "Struktura sklivce B.2Ó3 získané z termostatistického modelu aglomerace ". Journal of Molecular Liquids. 71 (2–3): 107–114. doi:10.1016 / s0167-7322 (97) 00003-2.
- ^ Alderman, O. L. G. Ferlat, G. Baroni, A. Salanne, M. Micoulaut, M. Benmore, C. J. Lin, A. Tamalonis, A. Weber, J. K. R. (2015). „Kapalný B2O3 až 1700 K: rentgenová difrakce a rozpouštění boroxolového kruhu“ (PDF). Journal of Physics: Condensed Matter. 27 (45): 455104. doi:10.1088/0953-8984/27/45/455104. PMID 26499978.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Brazhkin, V. V .; Katayama, Y .; Inamura, Y .; Kondrin, M. V .; Lyapin, A. G .; Popova, S. V .; Voloshin, R. N. (2003). "Strukturální transformace v kapalné, krystalické a skelné B2Ó3 pod vysokým tlakem ". Dopisy JETP. 78 (6): 393–397. Bibcode:2003JETPL..78..393B. doi:10.1134/1.1630134.
- ^ Kocakuşak, S .; Akçay, K .; Ayok, T .; Koöroğlu, H. J .; Koral, M .; Savaşçi, Ö. T .; Tolun, R. (1996). "Výroba bezvodého krystalického oxidu boritého v reaktoru s fluidním ložem". Chemické inženýrství a zpracování. 35 (4): 311–317. doi:10.1016/0255-2701(95)04142-7.
- ^ Morelock, C. R. (1961). „Research Laboratory Report # 61-RL-2672M“. General Electric. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Aziz, M. J .; Nygren, E .; Hays, J. F .; Turnbull, D. (1985). „Kinetika růstu krystalů oxidu boritého pod tlakem“. Journal of Applied Physics. 57 (6): 2233. Bibcode:1985JAP .... 57.2233A. doi:10.1063/1.334368.
- ^ Gurr, G. E .; Montgomery, P. W .; Knutson, C. D .; Gorres, B. T. (1970). "Krystalová struktura trigonálního oxidu diboronového". Acta Crystallographica B. 26 (7): 906–915. doi:10.1107 / S0567740870003369.
- ^ Strong, S.L .; Wells, A. F .; Kaplow, R. (1971). „Na krystalové struktuře B2Ó3". Acta Crystallographica B. 27 (8): 1662–1663. doi:10.1107 / S0567740871004515.
- ^ Effenberger, H .; Lengauer, C. L .; Parthé, E. (2001). "Trigonální B2Ó3 s vyšší symetrií vesmírných skupin: výsledky přehodnocení ". Monatshefte für Chemie. 132 (12): 1515–1517. doi:10,1007 / s007060170008.
- ^ AirProducts (2011). „Diboranové skladování a dodávka“ (PDF). Archivovány od originál (PDF) dne 04.02.2015. Citováno 2013-08-21. Citovat deník vyžaduje
| deník =(Pomoc)

