Ribóza-fosfátdifosfokináza - Ribose-phosphate diphosphokinase
| Ribóza-fosfátdifosfokináza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Fosforibosylpyrofosfát syntáza 1, hexamer, člověk | |||||||||
| Identifikátory | |||||||||
| EC číslo | 2.7.6.1 | ||||||||
| Číslo CAS | 9031-46-3 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| fosforibosylpyrofosfát syntetáza 1 | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | PRPS1 | ||||||
| Gen NCBI | 5631 | ||||||
| HGNC | 9462 | ||||||
| OMIM | 311850 | ||||||
| RefSeq | NM_002764 | ||||||
| UniProt | P60891 | ||||||
| Další údaje | |||||||
| EC číslo | 2.7.6.1 | ||||||
| Místo | Chr. X q21-q27 | ||||||
| |||||||
| fosforibosylpyrofosfát syntetáza 2 | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | PRPS2 | ||||||
| Gen NCBI | 5634 | ||||||
| HGNC | 9465 | ||||||
| OMIM | 311860 | ||||||
| RefSeq | NM_002765 | ||||||
| UniProt | P11908 | ||||||
| Další údaje | |||||||
| EC číslo | 2.7.6.1 | ||||||
| Místo | Chr. X pter-q21 | ||||||
| |||||||
Ribóza-fosfátdifosfokináza (nebo fosforibosylpyrofosfát syntetáza nebo ribóza-fosfát pyrofosfokináza) je enzym který převádí ribóza-5-fosfát do fosforibosylpyrofosfát (PRPP).[1][2] Je zařazen pod ES 2.7.6.1.
Enzym se účastní syntézy nukleotidy (puriny a pyrimidiny ), kofaktory NAD a NADP, a aminokyseliny histidin a tryptofan,[1][2][3] spojením těchto biosyntetických procesů s pentózo-fosfátovou cestou, ze které je odvozen substrát ribózo-5-fosfát. Ribose 5-fosfát je produkován HMP Shunt Pathway z Glukóza-6-fosfát. Produkt fosforibosylpyrofosfát působí jako základní složka produktu purinová záchranná cesta a de novo syntéza purinů. Dysfunkce enzymu by tím podkopala metabolismus purinů. Ribosa-fosfát pyrofosfokináza existuje v bakteriích, rostlinách a zvířatech a existují tři izoformy lidské ribóza-fosfát pyrofosfokinázy.[2] U lidí jsou geny kódující enzym umístěny na X chromozom.[2]
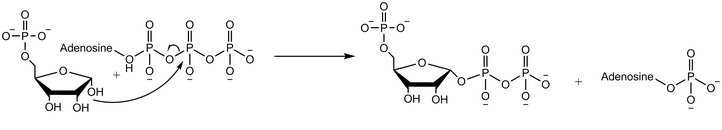
Reakční mechanismus

Ribose-fosfátdifosfokináza přenáší difosforylovou skupinu z Mg-ATP (Mg2 + koordinovaný na ATP) na ribóza-5-fosfát.[2] Enzymatická reakce začíná vazbou ribóza-5-fosfátu, následovanou vazbou Mg-ATP na enzym. V přechodovém stavu po navázání obou substrátů se přenáší difosfát. Enzym nejprve uvolní AMP před uvolněním produktu fosforibosylpyrofosfátu.[4]Pokusy s použitím vody značené kyslíkem 18 ukazují, že reakční mechanismus pokračuje nukleofilním atakem anomerní hydroxylové skupiny ribózo-5-fosfátu na beta-fosfor ATP v SN2 reakce.[5]
Struktura

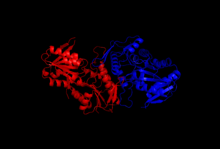
Krystalizační a rentgenové difrakční studie objasnily strukturu enzymu, který byl izolován klonováním, expresí proteinu a purifikačními technikami. Jedna podjednotka ribóza-fosfátdifosfokinázy se skládá z 318 aminokyselin; aktivní enzymový komplex se skládá ze tří homodimerů (nebo šesti podjednotek, hexameru). Struktura jedné podjednotky je pětivláknová paralelka beta list (centrální jádro) obklopeno čtyřmi alfa helixy na N-terminální doména a pět alfa šroubovic na C-koncová doména, se dvěma krátkými antiparalelními beta listy vyčnívajícími z jádra.[2]Katalytické místo enzymu váže ATP a ribóza-5-fosfát. Flexibilní smyčka (Phe92 – Ser108), smyčka vázající pyrofosfát (Asp171 – Gly174) a oblast vlajky (Val30 – Ile44 ze sousední podjednotky) obsahují vazebné místo ATP, které se nachází na rozhraní mezi dvěma doménami jedné podjednotky. Flexibilní smyčka je pojmenována kvůli své velké variabilitě v konformaci.[6] Vazebné místo pro ribosu-5-fosfát se skládá ze zbytků Asp220 – Thr228, umístěných v C-terminální doméně jedné podjednotky.[2][6]Alosterické místo, které váže ADP, sestává z aminokyselinových zbytků ze tří podjednotek.[2]
Funkce
Produkt této reakce, fosforibosylpyrofosfát (PRPP), se používá v mnoha biosyntéze (de novo a zachránit ) cesty. PRPP poskytuje ribózový cukr při de novo syntéze purinů a pyrimidinů, používaných v nukleotidových bázích, které tvoří RNA a DNA. PRPP reaguje s orotovat za vzniku orotidylátu, na který lze převést uridylát (UMP). UMP lze poté převést na nukleotid cytidin trifosfát (CTP). Reakce PRPP, glutaminu a amoniaku tvoří 5-fosforibosyl-1-amin, prekurzor inosinát (IMP), který lze nakonec převést na adenosintrifosfát (ATP) nebo guanosintrifosfát (GTP). PRPP hraje roli v purinových záchranných drahách reakcí s volnými purinovými bázemi za vzniku adenylátu, guanylátu a inosinátu.[7][8] PRPP se také používá při syntéze NAD: reakcí PRPP s kyselinou nikotinovou se získá intermediární mononukleotid kyseliny nikotinové.[9]
Nařízení
Ribosa-fosfátdifosfokináza vyžaduje pro aktivitu Mg2 +; enzym působí pouze na ATP koordinováno s Mg2 +. Ribose-fosfátdifosfokináza je regulována fosforylací a allostery. Aktivuje se pomocí fosfát a inhibuje ADP; navrhuje se, aby fosfát a ADP soutěžily o stejné regulační místo. Při normálních koncentracích fosfát aktivuje enzym vazbou na své alosterické regulační místo. Je však prokázáno, že při vysokých koncentracích má fosfát inhibiční účinek tím, že soutěží se substrátem ribóza-5-fosfátem o vazbu v aktivním místě. ADP je klíčový alosterický inhibitor ribosa-fosfátdifosfokinázy. Bylo prokázáno, že při nižších koncentracích substrátu ribóza-5-fosfátu může ADP kompetitivně inhibovat enzym. Ribóza-fosfát pyrofosfokináza je také inhibována některými z jejích navazujících biosyntetických produktů.[2][6]
Role v nemoci
Protože je jeho produkt klíčovou sloučeninou v mnoha biosyntetických drahách, je ribóza-fosfátdifosfokináza zapojena do některých vzácných poruch a X-vázané recesivní nemoci. Mutace, které vedou k superaktivitě (zvýšená aktivita enzymu nebo de-regulace enzymu), vedou k nadprodukci purinu a kyseliny močové. Mezi příznaky superaktivity patří dna, senzorineurální ztráta sluchu,[10] slabý svalový tonus (hypotonie), zhoršená svalová koordinace (ataxie), dědičná periferní neuropatie,[11] a neurovývojová porucha.[12][13][14] Výsledkem jsou mutace, které vedou ke ztrátě funkce ribosa-fosfátdifosfokinázy Charcot-Marie-Tooth nemoc a ARTS syndrom.[15]
Reference
- ^ A b Visentin LP, Hasnain S, Gallin W (červenec 1977). "Ribozomální protein S1 / S1A v bakteriích". FEBS Lett. 79 (2): 258–63. doi:10.1016/0014-5793(77)80799-0. PMID 330231.
- ^ A b C d E F G h i Li S, Lu Y, Peng B, Ding J (leden 2007). „Krystalová struktura lidské fosforibosylpyrofosfát syntetázy 1 odhaluje nové alosterické místo“. Biochem. J. 401 (1): 39–47. doi:10.1042 / BJ20061066. PMC 1698673. PMID 16939420.
- ^ Tang W, Li X, Zhu Z, Tong S, Li X, Zhang X, Teng M, Niu L (květen 2006). „Exprese, čištění, krystalizace a předběžná rentgenová difrakční analýza lidské fosforibosylpyrofosfát syntetázy 1 (PRS1)“. Acta Crystallographica oddíl F. 62 (Pt 5): 432–4. doi:10.1107 / S1744309106009067. PMC 2219982. PMID 16682768.
- ^ Fox IH, Kelley WN (duben 1972). "Lidská fosforibosylpyrofosfát syntetáza. Kinetický mechanismus a inhibice konečného produktu". J. Biol. Chem. 247 (7): 2126–31. PMID 4335863.
- ^ Miller GA, Rosenzweig S, Switzer RL (prosinec 1975). "Oxygen-18 studie mechanismu přenosu pyrofosforylových skupin katalyzovaných fosforibosylpyrofosfát syntetázou". Oblouk. Biochem. Biophys. 171 (2): 732–6. doi:10.1016/0003-9861(75)90086-7. PMID 173242.
- ^ A b C Eriksen TA, Kadziola A, Bentsen AK, Harlow KW, Larsen S (duben 2000). "Strukturální základ pro funkci Bacillus subtilis fosforibosyl-pyrofosfát syntetázy". Nat. Struct. Biol. 7 (4): 303–8. doi:10.1038/74069. PMID 10742175.
- ^ Fox IH, Kelley WN (březen 1971). "Fosforibosylpyrofosfát u člověka: biochemický a klinický význam". Ann. Internovat. Med. 74 (3): 424–33. doi:10.7326/0003-4819-74-3-424. PMID 4324023.
- ^ Jeremy M. Berg; John L. Tymoczko; Lubert Stryer; Gregory J. Gatto Jr. (2012). Biochemie (7. vydání). New York: W.H. Freemane. ISBN 1429229365.
- ^ Rongvaux A, Andris F, Van Gool F, Leo O (červenec 2003). "Rekonstrukce eukaryotického metabolismu NAD". BioEssays. 25 (7): 683–90. doi:10.1002 / bies.10297. PMID 12815723.
- ^ Liu X, Han D, Li J, Han B, Ouyang X, Cheng J, Li X, Jin Z, Wang Y, Bitner-Glindzicz M, Kong X, Xu H, Kantardzhieva A, Eavey RD, Seidman CE, Seidman JG, Du LL, Chen ZY, Dai P, Teng M, Yan D, Yuan H (leden 2010). „Ztráty funkce mutací v genu PRPS1 způsobují typ nesyndromické X-vázané senzorineurální hluchoty, DFN2“. Dopoledne. J. Hum. Genet. 86 (1): 65–71. doi:10.1016 / j.ajhg.2009.11.015. PMC 2801751. PMID 20021999.
- ^ Kim HJ, Sohn KM, Shy ME, Krajewski KM, Hwang M, Park JH, Jang SY, Won HH, Choi BO, Hong SH, Kim BJ, Suh YL, Ki CS, Lee SY, Kim SH, Kim JW (září 2007 ). „Mutace v PRPS1, který kóduje enzym fosforibosylpyrofosfátsyntetázu kritický pro biosyntézu nukleotidů, způsobují dědičnou periferní neuropatii se ztrátou sluchu a optickou neuropatii (cmtx5)“. Dopoledne. J. Hum. Genet. 81 (3): 552–8. doi:10.1086/519529. PMC 1950833. PMID 17701900.
- ^ Becker MA, Smith PR, Taylor W, Mustafi R, Switzer RL (listopad 1995). „Genetický a funkční základ superaktivity fosforibosylpyrofosfát-syntetázy purinového nukleotidu se zpětnou vazbou“. J. Clin. Investovat. 96 (5): 2133–41. doi:10.1172 / JCI118267. PMC 185862. PMID 7593598.
- ^ Zoref E, De Vries A, Sperling O (listopad 1975). "Mutantní zpětně rezistentní fosforibosylpyrofosfát syntetáza spojená s nadprodukcí purinu a dnou. Fosforibosylpyrofosfát a metabolismus purinu v kultivovaných fibroblastech". J. Clin. Investovat. 56 (5): 1093–9. doi:10,1172 / JCI108183. PMC 301970. PMID 171280.
- ^ "Superaktivita fosforibosylpyrofosfát syntetázy". Lister Hill National Center for Biomedical Communications. Citováno 25. února 2014.
- ^ Synofzik M, Müller Vom Hagen J, Haack TB, Wilhelm C, Lindig T, Beck-Wödl S, Nabuurs SB, van Kuilenburg AB, de Brouwer AP, Schöls L (2014). „X-vázaná Charcot-Marie-Toothova choroba, Artsův syndrom a prelingvální nesyndromová hluchota tvoří kontinuum nemoci: důkazy z rodiny s novou mutací PRPS1“. Orphanet J Rare Dis. 9 (1): 24. doi:10.1186/1750-1172-9-24. PMC 3931488. PMID 24528855.
externí odkazy
- Uniprot - ribóza-fosfát pyrofosfokináza 1
- GeneReviews / NIH / NCBI / UW vstup na Charcot-Marie-Tooth Neuropathy X Type 5
- OMIM záznamy o Charcot-Marie-Tooth Neuropathy X Type 5
- GeneReviews / NCBI / NIH / UW záznam o syndromu umění
- GeneReviews / NIH / NCBI / UW vstup na superaktivitu fosforibosylpyrofosfát syntetázy (PRS)
- GeneReviews / NCBI / NIH / UW vstup na DFNX1 nesyndromová ztráta sluchu a hluchota
- Fosforibosyl + pyrofosfát + syntetáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
