Adenin fosforibosyltransferáza - Adenine phosphoribosyltransferase
Adenin fosforibosyltransferáza (APRTase) je enzym kódováno APRT gen, nalezen v lidé na chromozom 16.[5] Je součástí rodiny PRTase typu I a podílí se na záchrana nukleotidů cesta, která poskytuje alternativu k nukleotid biosyntéza de novo u lidí a většiny ostatních zvířat.[6] V parazitické prvoky jako Giardia „APRTase poskytuje jediný mechanismus, kterým adenin lze vyrobit.[7] Nedostatek APRTázy přispívá k tvorbě ledvinových kamenů (urolitiáza ) a potenciál selhání ledvin.[8]
Funkce
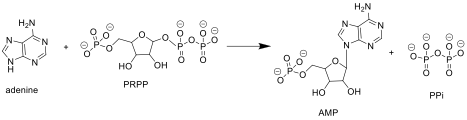
APRTáza katalyzuje následující reakci v purinu záchrana nukleotidů cesta:
Adenin + Fosforibosylpyrofosfát (PRPP ) → Adenylát (AMP ) + Pyrofosfát (PPi )
V organismech, které se mohou syntetizovat puriny de novo, nukleotidová záchranná cesta poskytuje alternativu, která je energeticky účinnější. Může zachránit adenin z polyamin biosyntetickou cestou nebo z dietních zdrojů purinů.[6] Ačkoli je APRTáza v těchto organismech funkčně nadbytečná, stává se důležitější v obdobích rychlého růstu, jako je embryogeneze a růst nádorů.[9] Je konstitutivně exprimován ve všech savčích tkáních.[10]
v prvoky paraziti, nukleotidová záchranná cesta poskytuje jediný prostředek pro syntézu nukleotidů. Vzhledem k tomu, že důsledky nedostatku APRTázy u lidí jsou poměrně mírné a léčitelné, je možné některé léčit parazitární infekce cílením na funkci APRTase.[11]
v rostliny Stejně jako v jiných organismech funguje ARPTáza primárně pro syntézu adenylát. Má jedinečnou schopnost metabolizovat cytokininy -A rostlinný hormon který může existovat jako základna, nukleotid nebo nukleosid —Do adenylátových nukleotidů.[12]
APRT funkčně souvisí s hypoxanthin-guanin fosforibosyltransferáza (HPRT).
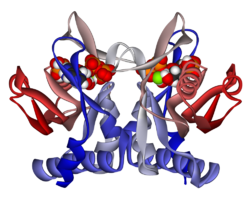
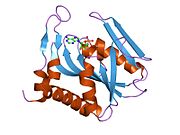
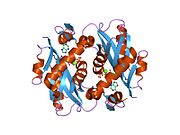
Struktura
APRTase je homodimer, s 179 aminokyselina zbytky na monomer. Každý monomer obsahuje následující oblasti:
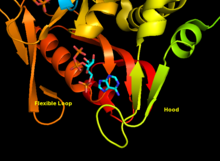
- "Základní" doména (zbytky 33-169) s pěti paralelními β-listy
- "Hood" doména (zbytky 5-34) s 2 α-šroubovice a 2 β-listy
- "Flexibilní smyčka" doména (zbytky 95-113) se 2 antiparalelními β-listy[10]
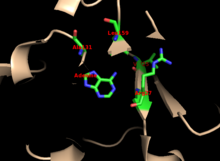
Jádro je vysoce konzervované napříč mnoha PRTázami. Kukla, která obsahuje adenin vazebné místo, má větší variabilitu v rodině enzymů. Motiv se 13 zbytky obsahuje PRPP vazebná oblast a zahrnuje dvě sousední kyselé zbytky a alespoň jedno okolí hydrofobní zbytek.[13]
Specifičnost enzymu pro adenin zahrnuje hydrofobní zbytky Ala131 a 159 Leu v základní doméně. U lidí dva zbytky v doméně digestoře vodíková vazba s purinem pro další specifičnost: Val25 s vodíky na N6 a Arg27 s N1. Ačkoli pružná smyčka během rozpoznávání purinů neinteraguje s kuklou, předpokládá se, že se uzavírá přes Aktivní stránky a izolovat reakci od rozpouštědla.[10]
Většina výzkumů na APRTase uvádí, že Mg2+ je nezbytný pro přenos fosforibosylu a je zachován u PRTáz typu I.[12] Nedávné úsilí o vyřešení struktury lidské APRTázy však nedokázalo najít jediné místo pro Mg2+, ale našel důkazy naznačující Cl− atom poblíž Trp98. Navzdory obtížnosti umístění Mg2+, je všeobecně přijímáno, že katalytický mechanismus je závislá na tomto iontu.[6]
Mechanismus
APRTáza probíhá prostřednictvím bi bi uspořádaného sekvenčního mechanismu zahrnujícího tvorbu ternárního komplexu. Enzym se nejprve váže PRPP, následován adenin. Poté, co dojde k přenosu fosforibosylu, pyrofosfát nejprve odejde, následuje AMP. Kinetické studie naznačují, že přenos fosforibosylu je relativně rychlý, zatímco uvolňování produktu (zejména uvolňování AMP) je rychlost omezující.[9]
V lidské APRTáze se předpokládá, že proton N9 adeninu je abstrahován Glu104 za vzniku oxakarbenia přechodový stav. Toto funguje jako nukleofil zaútočit na anomerní uhlík PRPP, tvořící AMP a vytěsňující pyrofosfát z PRPP. Mechanismus APRTázy je obecně konzistentní s mechanismem jiných PRTáz, které zachovávají funkci vytěsňování a-1-pyrofosforečnanu PRPP pomocí dusík nukleofil, buď v SN1 nebo S.N2 útok.[6]
Nedostatek
Pokud má APRTase sníženou nebo neexistující aktivitu, adenin se hromadí z jiných cest. Je degradován xanthin dehydrogenáza na 2,8-dihydroxyadenin (DHA). Ačkoli je DHA vázán na bílkoviny plazma, má špatné rozpustnost v moč a postupně se vysráží ledvinové tubuly, což vede k tvorbě ledvinových kamenů (urolitiáza ). Pokud se tento stav neléčí, může se nakonec vytvořit selhání ledvin.[8]
Nedostatek ARPTázy byl poprvé diagnostikován u Spojené království v roce 1976. Od té doby byly u lidí definovány dvě kategorie deficitu APRTázy.[14]
Nedostatek typu I má za následek úplnou ztrátu aktivity APRTázy a může se objevit u pacientů, kteří jsou homozygotní nebo složený heterozygot pro různé mutace.[15] Sekvenování odhalila mnoho různých mutací, které mohou odpovídat za typ 1, včetně missense mutace, nesmyslné mutace duplikovaná sada 4 základní páry v exon 3,[16] a jeden tymin vložení v intron 4.[17] Tyto mutace způsobují účinky, které jsou seskupeny do tří hlavních oblastí: ve vazbě β-fosfátu PRPP, ve vazbě 5'-fosfátu PRPP a v segmentu pružné smyčky, která se během katalýzy uzavírá nad aktivním místem. [10] Nedostatek typu I byl pozorován u různých etnických skupin, ale studoval se převážně mezi nimi Bílý populace.[17]
Nedostatek typu II způsobuje, že APRTáza má sníženou afinitu k PRPP, což vede k desetinásobnému zvýšení KM hodnota.[6] Bylo pozorováno a studováno primárně v Japonsko.[17]
Diagnózu nedostatku APRTázy lze provést analýzou ledvinové kameny, měření koncentrací DHA v moči nebo analýza aktivity APRTázy v erytrocyty. Je léčitelný pravidelnými dávkami alopurinol nebo febuxostat, které inhibují aktivitu xanthin dehydrogenázy, aby se zabránilo hromadění a srážení DHA.[18] Stav lze také zmírnit dietou s nízkým obsahem purinů a vysokým příjmem tekutin.[14]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000198931 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000006589 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Valaperta R, Rizzo V, Lombardi F, Verdelli C, Piccoli M, Ghiroldi A, Creo P, Colombo A, Valisi M, Margiotta E, Panella R, Costa E (1. července 2014). „Nedostatek adenin fosforibosyltransferázy (APRT): identifikace nové nesmyslné mutace“. BMC nefrologie. 15: 102. doi:10.1186/1471-2369-15-102. PMC 4094445. PMID 24986359.
- ^ A b C d E Silva CH, Silva M, Iulek J, Thiemann OH (červen 2008). „Strukturální komplexy lidské adeninfosforibosyltransferázy odhalují nové rysy katalytického mechanismu APRT“. Journal of Biomolecular Structure & Dynamics. 25 (6): 589–97. doi:10.1080/07391102.2008.10507205. PMID 18399692. S2CID 40788077.
- ^ Sarver AE, Wang CC (říjen 2002). „Adenin fosforibosyltransferáza z Giardia lamblia má jedinečný reakční mechanismus a neobvyklé vlastnosti vázání substrátu.“. The Journal of Biological Chemistry. 277 (42): 39973–80. doi:10,1074 / jbc.M205595200. PMID 12171924.
- ^ A b Shi W, Tanaka KS, Crother TR, Taylor MW, Almo SC, Schramm VL (září 2001). "Strukturní analýza adeninfosforibosyltransferázy ze Saccharomyces cerevisiae". Biochemie. 40 (36): 10800–9. doi:10.1021 / bi010465h. PMID 11535055.
- ^ A b Bashor C, Denu JM, Brennan RG, Ullman B (březen 2002). "Kinetický mechanismus adenin fosforibosyltransferázy z Leishmania donovani". Biochemie. 41 (12): 4020–31. doi:10.1021 / bi0158730. PMID 11900545.
- ^ A b C d Silva M, Silva CH, Iulek J, Thiemann OH (červen 2004). „Trojrozměrná struktura lidské adeninfosforibosyltransferázy a její vztah k DHA-urolitiáze“. Biochemie. 43 (24): 7663–71. doi:10.1021 / bi0360758. PMID 15196008.
- ^ Shi W, Sarver AE, Wang CC, Tanaka KS, Almo SC, Schramm VL (říjen 2002). „Komplexy adeninfosforibosyltransferázy z Giardia lamblia z uzavřeného místa ukazují mechanismus migrace ribosylu“. The Journal of Biological Chemistry. 277 (42): 39981–8. doi:10,1074 / jbc.M205596200. PMID 12171925.
- ^ A b Allen M, Qin W, Moreau F, Moffatt B (květen 2002). „Izoformy adeninfosforibosyltransferázy Arabidopsis a jejich potenciální příspěvky k metabolismu adeninu a cytokininů“. Physiologia Plantarum. 115 (1): 56–68. doi:10.1034 / j.1399-3054.2002.1150106.x. PMID 12010467.
- ^ Liu Q, Hirono S, Moriguchi I (srpen 1990). „Kvantitativní vztahy mezi strukturou a aktivitou pro inhibitory kalmodulinu“. Chemický a farmaceutický bulletin. 38 (8): 2184–9. doi:10,1248 / cpb.38.2184. PMID 2279281.
- ^ A b Cassidy MJ, McCulloch T, Fairbanks LD, Simmonds HA (březen 2004). „Diagnostika deficitu adeninfosforibosyltransferázy jako základní příčiny selhání ledvin u příjemce transplantace ledviny“. Nefrologie, dialýza, transplantace. 19 (3): 736–8. doi:10.1093 / ndt / gfg562. PMID 14767036.
- ^ Bollée G, Harambat J, Bensman A, Knebelmann B, Daudon M, Ceballos-Picot I (září 2012). "Nedostatek adenin fosforibosyltransferázy". Klinický časopis Americké nefrologické společnosti. 7 (9): 1521–7. doi:10.2215 / CJN.02320312. PMID 22700886.
- ^ Kamatani N, Hakoda M, Otsuka S, Yoshikawa H, Kashiwazaki S (červenec 1992). „Pouze tři mutace představují téměř všechny defektní alely způsobující nedostatek adenin fosforibosyltransferázy u japonských pacientů“. The Journal of Clinical Investigation. 90 (1): 130–5. doi:10,1172 / JCI115825. PMC 443071. PMID 1353080.
- ^ A b C Bollée G, Dollinger C, Boutaud L, Guillemot D, Bensman A, Harambat J, Deteix P, Daudon M, Knebelmann B, Ceballos-Picot I (duben 2010). "Fenotypová a genotypová charakterizace deficitu adeninfosforibosyltransferázy". Časopis Americké nefrologické společnosti. 21 (4): 679–88. doi:10.1681 / ASN.2009080808. PMC 2844298. PMID 20150536.
- ^ Edvardsson VO, Palsson R, Sahota A (1993). Pagon RA, Adam MP, Ardinger HH, Wallace SE, Amemiya A, Bean LJ, Bird TD, Fong CT, Mefford HC, Smith RJ, Stephens K. (eds.). "Nedostatek adenfosforibosyltransferázy". SourceGeneReviews. PMID 22934314.
Další čtení
- Tischfield JA, Engle SJ, Gupta PK, Bye S, Boyadjiev S, Shao C, O'Neill P, Albertini RJ, Stambrook PJ, Sahota AS (1995). "Germline a somatická mutace na APRT lokusu myší a člověka". Pokroky v experimentální medicíně a biologii. 370: 661–4. doi:10.1007/978-1-4615-2584-4_137. ISBN 978-1-4613-6105-3. PMID 7660991.
- Takeuchi H, Kaneko Y, Fujita J, Yoshida O (duben 1993). „Případ sloučeniny heterozygot pro nedostatek adenin fosforibosyltransferázy (APRT * J / APRT * Q0) vedoucí k urolitiáze 2,8-dihydroxyadeninu: přehled hlášených případů 2,8-dihydroxyadeninových kamenů v Japonsku“. The Journal of Urology. 149 (4): 824–6. doi:10.1016 / s0022-5347 (17) 36222-5. PMID 8455250.
- Ludwig H, Kuzmits R, Pietschmann H, Müller MM (listopad 1979). „Enzymy systému interkonverze purinů u chronické lymfatické leukémie: snížená aktivita purinové nukleosidové fosforylázy a aktivita adenosindeaminázy“. Blut. 39 (5): 309–15. doi:10.1007 / BF01014193. PMID 116697. S2CID 6283377.
- Johnson LA, Gordon RB, Emmerson BT (duben 1977). „Adenin fosforibosyltransferáza: jednoduchý spektrofotometrický test a výskyt mutací v normální populaci“. Biochemická genetika. 15 (3–4): 265–72. doi:10.1007 / BF00484458. PMID 869896. S2CID 41264715.
- Kamatani N, Hakoda M, Otsuka S, Yoshikawa H, Kashiwazaki S (červenec 1992). „Pouze tři mutace představují téměř všechny defektní alely způsobující nedostatek adenin fosforibosyltransferázy u japonských pacientů“. The Journal of Clinical Investigation. 90 (1): 130–5. doi:10,1172 / JCI115825. PMC 443071. PMID 1353080.
- Chen J, Sahota A, Laxdal T, Scrine M, Bowman S, Cui C, Stambrook PJ, Tischfield JA (prosinec 1991). "Identifikace jediné missense mutace v genu adenin fosforibosyltransferázy (APRT) od pěti islandských pacientů a britského pacienta". American Journal of Human Genetics. 49 (6): 1306–11. PMC 1686459. PMID 1746557.
- Mimori A, Hidaka Y, Wu VC, Tarlé SA, Kamatani N, Kelley WN, Pallela TD (leden 1991). „Mutantní alela společná s nedostatkem adeninfosforibosyltransferázy typu I u japonských subjektů“. American Journal of Human Genetics. 48 (1): 103–7. PMC 1682758. PMID 1985452.
- Chen J, Sahota A, Stambrook PJ, Tischfield JA (červenec 1991). „Amplifikace polymerázové řetězové reakce a sekvenční analýza genů lidské mutantní adenin fosforibosyltransferázy: povaha a frekvence chyb způsobených Taq DNA polymerázou“. Mutační výzkum. 249 (1): 169–76. doi:10.1016 / 0027-5107 (91) 90143-C. PMID 2067530.
- Gathof BS, Sahota A, Gresser U, Chen J, Stambrook PJ, Tischfield JA, Zöllner N (prosinec 1990). "Identifikace sestřihové mutace na lokusu adenin fosforibosyltransferázy v německé rodině". Klinische Wochenschrift. 69 (24): 1152–5. doi:10.1007 / BF01815434. PMID 2135300. S2CID 11791868.
- Kamatani N, Kuroshima S, Hakoda M, Palella TD, Hidaka Y (říjen 1990). „Crossovery v krátké sekvenci DNA naznačují dlouhou evoluční historii mutace APRT * J“ (PDF). Genetika člověka. 85 (6): 600–4. doi:10.1007 / BF00193582. hdl:2027.42/47628. PMID 2227951. S2CID 10595601.
- Kamatani N, Kuroshima S, Terai C, Hidaka Y, Palella TD, Nishioka K (srpen 1989). „Detekce aminokyselinové substituce v mutantním enzymu pro speciální typ deficitu adenin fosforibosyltransferázy (APRT) štěpením sekvenčně specifického proteinu“. American Journal of Human Genetics. 45 (2): 325–31. PMC 1683345. PMID 2502918.
- Hidaka Y, Tarlé SA, Fujimori S, Kamatani N, Kelley WN, Palella TD (březen 1988). „Nedostatek lidské adeninfosforibosyltransferázy. Demonstrace jediné mutantní alely společné Japoncům“. The Journal of Clinical Investigation. 81 (3): 945–50. doi:10.1172 / JCI113408. PMC 442550. PMID 3343350.
- Wilson JM, O'Toole TE, Argos P, Shewach DS, Daddona PE, Kelley WN (říjen 1986). "Lidská adeninfosforibosyltransferáza. Kompletní aminokyselinová sekvence enzymu erytrocytů". The Journal of Biological Chemistry. 261 (29): 13677–83. PMID 3531209.
- Broderick TP, Schaff DA, Bertino AM, Dush MK, Tischfield JA, Stambrook PJ (květen 1987). „Srovnávací anatomie lidského genu a enzymu APRT: divergence nukleotidové sekvence a zachování nenáhodného uspořádání dinukleotidů CpG“. Sborník Národní akademie věd Spojených států amerických. 84 (10): 3349–53. doi:10.1073 / pnas.84.10.3349. PMC 304867. PMID 3554238.
- Hidaka Y, Palella TD, O'Toole TE, Tarlé SA, Kelley WN (listopad 1987). „Lidská adeninfosforibosyltransferáza. Identifikace alelických mutací na úrovni nukleotidů jako příčina úplného nedostatku enzymu“. The Journal of Clinical Investigation. 80 (5): 1409–15. doi:10.1172 / JCI113219. PMC 442397. PMID 3680503.
- Hidaka Y, Tarlé SA, O'Toole TE, Kelley WN, Palella TD (listopad 1987). „Nukleotidová sekvence lidského genu APRT“. Výzkum nukleových kyselin. 15 (21): 9086. doi:10.1093 / nar / 15.21.9086. PMC 306432. PMID 3684585.
- Chen J, Sahota A, Martin GF, Hakoda M, Kamatani N, Stambrook PJ, Tischfield JA (červen 1993). „Analýza zárodečných linií a somatických mutací in vivo v genu lidské adenin fosforibosyltransferázy: horká místa mutace v donorovém místě sestřihu intronu 4 a v kodonu 87“. Mutační výzkum. 287 (2): 217–25. doi:10.1016/0027-5107(93)90014-7. PMID 7685481.
- Sahota A, Chen J, Boyadjiev SA, Gault MH, Tischfield JA (květen 1994). „Missense mutace v genu pro adenin fosforibosyltransferázu způsobující urolitiázu 2,8-dihydroxyadenin“. Lidská molekulární genetika. 3 (5): 817–8. doi:10,1093 / hmg / 3,5,817. PMID 7915931.
externí odkazy
- Adenin + fosforibosyltransferáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Člověk APRT umístění genomu a APRT stránka s podrobnostmi o genu v UCSC Genome Browser.