Adenosindeamináza - Adenosine deaminase
| Adenosin / AMP deamináza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
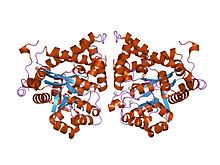 krystalová struktura adenosindeaminázy plasmodium yoelii (py02076) | |||||||||
| Identifikátory | |||||||||
| Symbol | A_deamináza | ||||||||
| Pfam | PF00962 | ||||||||
| Pfam klan | CL0034 | ||||||||
| InterPro | IPR001365 | ||||||||
| STRÁNKA | PDOC00419 | ||||||||
| SCOP2 | 1 přidat / Rozsah / SUPFAM | ||||||||
| CDD | cd01320 | ||||||||
| |||||||||
| Doména adenosindeaminázy (editázy) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | A_deamin | ||||||||
| Pfam | PF02137 | ||||||||
| InterPro | IPR002466 | ||||||||
| STRÁNKA | PDOC00419 | ||||||||
| SCOP2 | 1 přidat / Rozsah / SUPFAM | ||||||||
| |||||||||
| N-terminál adenosin / AMP deamináza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | A_deaminase_N | ||||||||
| Pfam | PF08451 | ||||||||
| InterPro | IPR013659 | ||||||||
| |||||||||
Adenosindeamináza (také známý jako adenosin aminohydrolázanebo ADA) je enzym (ES 3.5.4.4 ) zahrnutý do něčeho, zůčastnit se čeho metabolismus purinů. Je to nutné pro rozdělení adenosin z potravin a na obrat nukleové kyseliny v tkáních.
Jeho primární funkcí u lidí je vývoj a údržba imunitního systému.[5] Plná fyziologická role ADA však dosud není zcela objasněna.[6]
Struktura
ADA existuje jak v malé formě (jako monomer), tak ve velké formě (jako dimer-komplex).[6] V monomerní formě je enzymem polypeptidový řetězec,[7] složené do osmi řetězců paralelních α / β hlav, které obklopují centrální hlubokou kapsu, která je aktivním místem.[5] Kromě osmi centrálních β-sudy a osm periferních α-šroubovice, ADA také obsahuje pět dalších helixů: zbytky 19-76 násobně do tří helixů, umístěných mezi β1 a al záhyby; a dvě antiparalelní karboxy-koncové šroubovice jsou umístěny přes amino-terminál p-barelu.
Aktivní místo ADA obsahuje iont zinku, který je umístěn v nejhlubším vybrání aktivního místa a koordinován pěti atomy z His15, His17, His214, Asp295 a substrátu.[5] Zinek je jediný kofaktor nezbytné pro činnost.
Substrát, adenosin, je stabilizován a vázán na aktivní místo devíti vodíkovými vazbami.[5] Karboxylová skupina Glu217, zhruba koplanární s purinovým kruhem substrátu, je schopna vytvořit vodíkovou vazbu s N1 substrátu. Karboxylová skupina Asp296, rovněž koplanární s purinovým kruhem substrátu, tvoří vodíkovou vazbu s N7 substrátu. NH skupina Gly184 je v pozici, aby vytvořila vodíkovou vazbu s N3 substrátu. Asp296 tvoří vazby jak se Zn2+ iontů a také s 6-OH substrátu. His238 také vodíkové vazby na substrát 6-OH. 3'-OH substrátu ribózy tvoří vodíkovou vazbu s Asp19, zatímco 5'-OH tvoří vodíkovou vazbu s His17. Dvě další vodíkové vazby se vytvářejí na molekuly vody při otevření aktivního místa 2'-OH a 3'-OH substrátu.
V důsledku recese aktivního místa uvnitř enzymu je substrát, jakmile je navázán, téměř úplně izolován od rozpouštědla.[5] Povrchová expozice podkladu rozpouštědlu po navázání je 0,5% povrchové expozice podkladu ve volném stavu.
Reakce
ADA nevratně deaminuje adenosin, jeho převedením na související nukleosid inosin nahrazením amino skupinu keto skupinou.


Inosin pak může být deribosylován (odstraněn z ribóza ) jiným nazývaným enzymem purinová nukleosid fosforyláza (PNP) a převádí jej na hypoxanthin.
Mechanismus katalýzy
Navrhovaným mechanismem pro ADA katalyzovanou deaminaci je stereospecifická eliminace adice přes čtyřboký meziprodukt.[8] Z obou mechanismů, Zn2+ jako silný elektrofil aktivuje molekulu vody, která je deprotonována základním Asp295 za vzniku útočícího hydroxidu.[5] His238 orientuje molekulu vody a stabilizuje náboj útočícího hydroxidu. Glu217 je protonován, aby daroval proton na N1 substrátu.
Reakce je stereospecifické kvůli umístění zinku, zbytků Asp295 a His238, které všechny směřují na stranu B purinového kruhu substrátu.[5]
Byla pozorována kompetitivní inhibice u ADA, kde produkt inosin působí u kompetitivního inhibitoru na enzymatickou aktivitu.[9]
Funkce
ADA je považován za jeden z klíčových enzymů metabolismu purinů.[8] Enzym byl nalezen v bakteriích, rostlinách, bezobratlých, obratlovcích a savcích vysoká ochrana aminokyselinové sekvence.[6] Vysoký stupeň zachování aminokyselinové sekvence naznačuje zásadní povahu ADA v purinové záchranné cestě.
ADA se u lidí primárně podílí na vývoji a udržování imunitního systému. Asociace ADA však byla také pozorována u epiteliálních buněk diferenciace, neurotransmise, a těhotenství údržba.[10] Rovněž bylo navrženo, že ADA kromě štěpení adenosinu stimuluje uvolňování excitační aminokyseliny a je nezbytný pro spojení receptorů adenosinu Al a heterotrimerní G proteiny.[6] Nedostatek adenosindeaminázy vede k plicní fibróze,[11] což naznačuje, že chronická expozice vysokým hladinám adenosinu může spíše zhoršit reakce zánětu než je potlačit. Rovněž bylo zjištěno, že protein a aktivita adenosindeaminázy jsou nadměrně regulovány v myších srdcích, která nadměrně exprimují HIF-1 alfa, což částečně vysvětluje oslabené hladiny adenosinu v srdcích exprimujících HIF-1 alfa během ischemická stres.[12]
Patologie
Nějaký mutace v genu pro adenosindeaminázu způsobí, že nebude exprimován. Výsledný nedostatek je jednou z příčin závažná kombinovaná imunodeficience (SCID), zejména autozomálně recesivní dědičnosti.[13] Deficitní hladiny ADA byly také spojeny s plicním zánětem, smrtí thymických buněk a vadnou signalizací receptoru T-buněk.[14][15]
Naopak mutace způsobující nadměrnou expresi tohoto enzymu jsou jednou z příčin hemolytická anémie.[16]
Existují určité důkazy, že jiné alela (ADA2) může vést k autismus.[17]
Zvýšené hladiny ADA byly také spojeny s AIDS.[14][18]
Izoformy
K dispozici jsou 2 izoformy ADA: ADA1 a ADA2.
- ADA1 se nachází zejména ve většině tělních buněk lymfocyty a makrofágy, kde je přítomen nejen v cytosolu a jádru, ale také jako ektoforma na buněčné membráně připojené k dipeptidyl peptidáza-4 (aka CD26). ADA1 se podílí většinou na intracelulární aktivitě a existuje jak v malé formě (monomer), tak ve velké formě (dimer).[6] Interkonverze malých a velkých forem je regulována „konverzním faktorem“ v plicích.[19]
- ADA2 byl poprvé identifikován v lidské slezině.[20] Následně byl nalezen v jiných tkáních včetně makrofágu, kde koexistuje s ADA1. Tyto dvě izoformy regulují poměr adenosinu k deoxyadenosinu potencující usmrcování parazitů. ADA2 se nachází převážně v lidské plazmě a séru a existuje pouze jako homodimer.[21]
Klinický význam
ADA2 je převládající forma přítomná u člověka krevní plazma a zvyšuje se u mnoha nemocí, zejména těch, které souvisejí s imunitním systémem: například revmatoidní artritida, psoriáza, a sarkoidóza. Plazmatická izoforma ADA2 je také zvýšena u většiny druhů rakoviny. ADA2 není všudypřítomný, ale koexistuje s ADA1 pouze v monocytech-makrofágech.[Citace je zapotřebí ]
Celková plazmatická ADA může být měřena pomocí vysoce účinná kapalinová chromatografie nebo enzymatické nebo kolorimetrické techniky. Snad nejjednodušší systém je měření amoniak uvolňován z adenosinu, když se rozloží na inosin. Po inkubaci plazmy s pufrovaným roztokem adenosinu reaguje amoniak s a Berthelotovo činidlo za vzniku modré barvy, která je úměrná množství aktivity enzymu. Pro měření ADA2, erythro-9- (2-hydroxy-3-nonyl) adenin (EHNA) se přidá před inkubací, aby se inhibovala enzymatická aktivita ADA1.[20] Je to absence ADA1, která způsobuje SCID.
ADA může být také použit při zpracování lymfocytů pleurální výpotky nebo peritoneální ascites, jelikož takové vzorky s nízkou hladinou ADA v zásadě vylučují tuberkulózu z úvahy.[22]
Tuberkulóza pleurální výpotky lze nyní přesně diagnostikovat zvýšenými hladinami pleurální tekutiny adenosindeaminázy nad 40 U na litr.[23]
Kladribin a Pentostatin jsou antineoplastická činidla používaná při léčbě vlasatobuněčná leukémie; jejich mechanismem účinku je inhibice adenosindeaminázy.
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000196839 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000017697 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b C d E F G Wilson DK, Rudolph FB, Quiocho FA (květen 1991). „Atomová struktura adenosindeaminázy v komplexu s analogem přechodového stavu: porozumění mutacím katalýzy a imunodeficience“. Věda. 252 (5010): 1278–1284. doi:10.1126 / science.1925539. PMID 1925539.
- ^ A b C d E Cristalli G, Costanzi S, Lambertucci C, Lupidi G, Vittori S, Volpini R, Camaioni E (březen 2001). "Adenosindeamináza: funkční důsledky a různé třídy inhibitorů". Recenze lékařského výzkumu. 21 (2): 105–128. doi:10.1002 / 1098-1128 (200103) 21: 2 <105 :: AID-MED1002> 3.0.CO; 2-U. PMID 11223861.
- ^ Daddona PE, Kelley WN (leden 1977). "Lidská adenosindeamináza. Čištění a struktura podjednotky". The Journal of Biological Chemistry. 252 (1): 110–115. PMID 13062.
- ^ A b Losey HC, Ruthenburg AJ, Verdine GL (leden 2006). "Krystalová struktura Staphylococcus aureus tRNA adenosindeamináza TadA v komplexu s RNA". Přírodní strukturní a molekulární biologie. 13 (2): 153–159. doi:10.1038 / nsmb1047. PMID 16415880. S2CID 34848284.
- ^ Saboury AA, Divsalar A, Jafari GA, Moosavi-Movahedi AA, Housaindokht MR, Hakimelahi GH (květen 2002). „Studie inhibice produktu na adenosindeaminase spektroskopií a kalorimetrií“. Journal of Biochemistry and Molecular Biology. 35 (3): 302–305. doi:10,5483 / BMBRep.2002.35.3.302. PMID 12297022.
- ^ Moriwaki Y, Yamamoto T, Higashino K (říjen 1999). "Enzymy podílející se na metabolismu purinů - přehled histochemické lokalizace a funkčních důsledků". Histologie a histopatologie. 14 (4): 1321–1340. PMID 10506947.
- ^ Blackburn MR (2003). "Příliš dobrá věc: přetížení adenosinem u myší s deficitem adenosin-deaminázy." Trendy ve farmakologických vědách. 24 (2): 66–70. doi:10.1016 / S0165-6147 (02) 00045-7. PMID 12559769.
- ^ Wu J, Bond C, Chen P, Chen M, Li Y, Shohet RV, Wright G (2015). „HIF-1α v srdci: přestavba metabolismu nukleotidů“. Journal of Molecular and Cellular Cardiology. 82: 194–200. doi:10.1016 / j.yjmcc.2015.01.014. PMC 4405794. PMID 25681585.
- ^ Sanchez JJ, Monaghan G, Børsting C, Norbury G, Morling N, Gaspar HB (květen 2007). „Nosná frekvence nesmyslné mutace v genu pro adenosindeaminázu (ADA) implikuje vysoký výskyt těžké kombinované imunodeficience (SCID) s nedostatkem ADA v Somálsku a jediný společný haplotyp označuje společného původu.“ Annals of Human Genetics. 71 (Pt 3): 336–47. doi:10.1111 / j.1469-1809.2006.00338.x. PMID 17181544. S2CID 34850391.
- ^ A b Blackburn MR, Kellems RE (2005). „Nedostatek adenosindeaminázy: metabolický základ imunitní nedostatečnosti a plicního zánětu“. Pokroky v imunologii. 86: 1–41. doi:10.1016 / S0065-2776 (04) 86001-2. ISBN 9780120044863. PMID 15705418. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Apasov SG, Blackburn MR, Kellems RE, Smith PT, Sitkovsky MV (červenec 2001). „Nedostatek adenosindeaminázy zvyšuje apoptózu brzlíku a způsobuje vadnou signalizaci receptoru T buněk“. The Journal of Clinical Investigation. 108 (1): 131–141. doi:10,1172 / JCI10360. PMC 209335. PMID 11435465.
- ^ Chottiner EG, Cloft HJ, Tartaglia AP, Mitchell BS (březen 1987). "Zvýšená aktivita adenosindeaminázy a dědičná hemolytická anémie. Důkazy o abnormální translační kontrole syntézy proteinů". The Journal of Clinical Investigation. 79 (3): 1001–5. doi:10.1172 / JCI112866. PMC 424261. PMID 3029177.
- ^ Persico AM, Militerni R, Bravaccio C, Schneider C, Melmed R, Trillo S, Montecchi F, Palermo MT, Pascucci T, Puglisi-Allegra S, Reichelt KL, Conciatori M, Baldi A, Keller F (prosinec 2000). „Alely adenosindeaminázy a autistická porucha: případové kontroly a rodinné asociační studie“. American Journal of Medical Genetics. 96 (6): 784–90. doi:10.1002 / 1096-8628 (20001204) 96: 6 <784 :: AID-AJMG18> 3.0.CO; 2-7. PMID 11121182.
- ^ Cowan MJ, Brady RO, Widder KJ (únor 1986). „Zvýšená aktivita adenosindeaminázy erytrocytů u pacientů se syndromem získané imunodeficience“. Sborník Národní akademie věd Spojených států amerických. 83 (4): 1089–1091. doi:10.1073 / pnas.83.4.1089. PMC 323016. PMID 3006027.
- ^ Schrader WP, Stacy AR (září 1977). "Čištění a podjednotková struktura adenosindeaminázy z lidské ledviny". The Journal of Biological Chemistry. 252 (18): 6409–6415. PMID 893413.
- ^ A b Schrader WP, Pollara B, Meuwissen HJ (leden 1978). „Charakterizace reziduální aktivity deaktivující adenosin ve slezině pacienta s kombinovaným onemocněním imunodeficience a nedostatkem adenosindeaminázy“. Sborník Národní akademie věd Spojených států amerických. 75 (1): 446–50. doi:10.1073 / pnas.75.1.446. PMC 411266. PMID 24216.
- ^ Zavialov AV, Engström A (říjen 2005). „Lidský ADA2 patří do nové rodiny růstových faktorů s aktivitou adenosindeaminázy“. The Biochemical Journal. 391 (Pt 1): 51–57. doi:10.1042 / BJ20050683. PMC 1237138. PMID 15926889.
- ^ Jiménez Castro D, Díaz Nuevo G, Pérez-Rodríguez E, Light RW (2003). „Diagnostická hodnota adenosindeaminázy u netuberkulózních lymfocytárních pleurálních výpotků“ (PDF). Eur. Respir. J. 21 (2): 220–4. doi:10.1183/09031936.03.00051603. PMID 12608433. S2CID 10703687.
- ^ Brunicardi F, Andersen D, Billiar T, Dunn D, Hunter J, Pollock RE (2005). „Kapitola 18, otázka 16“. Schwartzovy principy chirurgie (8. vydání). New York: McGraw-Hill Professional. ISBN 978-0071410908.
Další čtení
- da Cunha JG (1992). „[Adenosindeamináza. Pluridisciplinární enzym]“. Acta Médica Portuguesa. 4 (6): 315–23. PMID 1807098.
- Franco R, Casadó V, Ciruela F, Saura C, Mallol J, Canela EI, Lluis C (červenec 1997). "Adenosindeamináza na povrchu buněk: mnohem víc než ektoenzym". Pokrok v neurobiologii. 52 (4): 283–94. doi:10.1016 / S0301-0082 (97) 00013-0. PMID 9247966. S2CID 40318396.
- Valenzuela A, Blanco J, Callebaut C, Jacotot E, Lluis C, Hovanessian AG, Franco R (1997). „Obal HIV-1 gp120 a virové částice blokují vazbu adenosindeaminázy na lidský CD26“. Pokroky v experimentální medicíně a biologii. 421: 185–92. doi:10.1007/978-1-4757-9613-1_24. ISBN 978-1-4757-9615-5. PMID 9330696.
- Moriwaki Y, Yamamoto T, Higashino K (říjen 1999). "Enzymy podílející se na metabolismu purinů - přehled histochemické lokalizace a funkčních důsledků". Histologie a histopatologie. 14 (4): 1321–40. PMID 10506947.
- Hirschhorn R (1993). „Identifikace dvou nových missense mutací (R156C a S291L) u dvou pacientů s ADA-SCID neobvyklých pro reakci na terapii částečnými výměnnými transfuzi“. Lidská mutace. 1 (2): 166–8. doi:10.1002 / humu.1380010214. PMID 1284479. S2CID 44617309.
- Berkvens TM, van Ormondt H, Gerritsen EJ, Khan PM, van der Eb AJ (srpen 1990). „Identická delece 3250 bp mezi dvěma AluI opakováními v genech ADA nesouvisejících pacientů s ADA-SCID“. Genomika. 7 (4): 486–90. doi:10.1016/0888-7543(90)90190-6. PMID 1696926.
- Aran JM, Colomer D, Matutes E, Vives-Corrons JL, Franco R (srpen 1991). „Přítomnost adenosindeaminázy na povrchu mononukleárních krvinek: imunochemická lokalizace pomocí světelné a elektronové mikroskopie“. The Journal of Histochemistry and Cytochemistry. 39 (8): 1001–8. doi:10.1177/39.8.1856451. PMID 1856451.
- Bielat K, Tritsch GL (duben 1989). "Ektoenzymová aktivita lidské erytrocytové adenosindeaminázy". Molekulární a buněčná biochemie. 86 (2): 135–42. doi:10.1007 / BF00222613. PMID 2770711. S2CID 20850552.
- Hirschhorn R, Tzall S, Ellenbogen A, Orkin SH (únor 1989). „Identifikace bodové mutace vedoucí k teplotně labilní adenosindeamináze (ADA) u dvou nepříbuzných dětí s částečným nedostatkem ADA“. The Journal of Clinical Investigation. 83 (2): 497–501. doi:10,1172 / JCI113909. PMC 303706. PMID 2783588.
- Murray JL, Perez-Soler R, Bywaters D, Hersh EM (leden 1986). "Snížená aktivita adenosindeaminázy (ADA) a 5'nukleotidázy (5NT) v T buňkách periferní krve u Hodgkinovy choroby". American Journal of Hematology. 21 (1): 57–66. doi:10.1002 / ajh.2830210108. PMID 3010705. S2CID 25540139.
- Wiginton DA, Kaplan DJ, States JC, Akeson AL, Perme CM, Bilyk IJ, Vaughn AJ, Lattier DL, Hutton JJ (prosinec 1986). "Kompletní sekvence a struktura genu pro lidskou adenosindeaminázu". Biochemie. 25 (25): 8234–44. doi:10.1021 / bi00373a017. PMID 3028473.
- Akeson AL, Wiginton DA, Dusing MR, States JC, Hutton JJ (listopad 1988). "Mutantní lidské alely adenosindeaminázy a jejich exprese transfekcí do fibroblastů". The Journal of Biological Chemistry. 263 (31): 16291–6. PMID 3182793.
- Glader BE, Backer K (únor 1988). „Zvýšená aktivita adenosindeaminázy červených krvinek: marker narušené erytropoézy u anemie Diamond-Blackfan a dalších hematologických onemocnění“. British Journal of Hematology. 68 (2): 165–8. doi:10.1111 / j.1365-2141.1988.tb06184.x. PMID 3348976. S2CID 44789636.
- Petersen MB, Tranebjaerg L, Tommerup N, Nygaard P, Edwards H (únor 1987). „Nové přiřazení lokusu genu pro adenosindeaminázu k chromozomu 20q13 x 11 studií pacienta s intersticiální delecí 20q“. Journal of Medical Genetics. 24 (2): 93–6. doi:10,1136 / jmg.24.2.93. PMC 1049896. PMID 3560174.
- Orkin SH, Goff SC, Kelley WN, Daddona PE (duben 1985). „Přechodná exprese cDNA lidské adenosindeaminázy: identifikace nefunkčního klonu vyplývající z jedné aminokyselinové substituce“. Molekulární a buněčná biologie. 5 (4): 762–7. doi:10,1 128 / mcb. 5. 4. 762. PMC 366780. PMID 3838797.
- Valerio D, Duyvesteyn MG, Dekker BM, Weeda G, Berkvens TM, van der Voorn L, van Ormondt H, van der Eb AJ (únor 1985). „Adenosindeamináza: charakterizace a exprese genu s pozoruhodným promotorem“. Časopis EMBO. 4 (2): 437–43. doi:10.1002 / j.1460-2075.1985.tb03648.x. PMC 554205. PMID 3839456.
- Bonthron DT, Markham AF, Ginsburg D, Orkin SH (srpen 1985). „Identifikace bodové mutace v genu pro adenosindeaminázu odpovědnou za imunodeficienci“. The Journal of Clinical Investigation. 76 (2): 894–7. doi:10.1172 / JCI112050. PMC 423929. PMID 3839802.
- Daddona PE, Shewach DS, Kelley WN, Argos P, Markham AF, Orkin SH (říjen 1984). "Lidská adenosindeamináza. CDNA a kompletní primární aminokyselinová sekvence". The Journal of Biological Chemistry. 259 (19): 12101–6. PMID 6090454.
- Valerio D, Duyvesteyn MG, Meera Khan P, Geurts van Kessel A, de Waard A, van der Eb AJ (listopad 1983). "Izolace cDNA klonů pro lidskou adenosindeaminázu". Gen. 25 (2–3): 231–40. doi:10.1016/0378-1119(83)90227-5. PMID 6198240.
externí odkazy
- ADA umístění lidského genu v UCSC Genome Browser.
- ADA podrobnosti o lidském genu v UCSC Genome Browser.
- PDBe-KB poskytuje přehled všech strukturních informací dostupných v PDB pro lidskou adenosindeaminázu
- PDBe-KB poskytuje přehled všech strukturních informací dostupných v PDB pro myší adenosindeaminázu