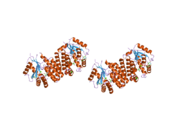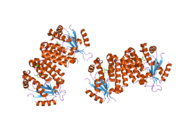Deoxycytidinkináza - Deoxycytidine kinase
Deoxycytidinkináza (dCK) je enzym který je kódován DCK gen v lidé.[5] dCK převážně fosforyluje deoxycytidin (dC) a převede dC na deoxycytidinmonofosfát. dCK katalyzuje jeden z počátečních kroků v záchrana nukleosidů cesta[6] a má potenciál konkrétně fosforylovat další předem vytvořené nukleosidy deoxyadenosin (dA) a deoxyguanosin (dG) a převést je na monofosfátové formy.[7] V poslední době existuje zájem biomedicínského výzkumu o zkoumání potenciálu dCK jako terapeutického cíle pro různé typy rakovina.[6][7][8]
Struktura

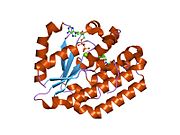
dCK je a homodimer kde každá monomerní podjednotka sestává z více alfa helixy obklopující a beta list jádro.[9][7][10] Každá podjednotka obsahuje vazebné místo pro donor nukleotidů, vazebné místo pro akceptor nukleosidů, smyčku pro snímání nukleotidové báze (240-254 zbytků), inzertní oblast (12-15 zbytků), která spojuje šroubovice 2 a 3.[9][10] dCK má několik různých proteinových konformací, ale jeho konformace závisí na nukleosidu nebo nukleotidu, na který se váže. dCK se může vázat na ADP, ATP, UDP nebo UTP (dárci fosforylové skupiny), ale vazba UDP / UTP mění konformaci enzymu přeskupením smyčky pro snímání nukleotidové báze ve srovnání s konformací dCK, když se váže na ATP. Tato změna konformace, když je specifický donor fosforylu vázán na vazebné místo pro nukleotidy, určuje, který nukleosid se může vázat na vazebné místo pro nukleosidy.[9][10] Bylo například pozorováno, že když se dCK váže na ADP, přebírá dCK „uzavřenou“ konformaci nebo kompaktnější vazebné místo pro nukleosidy, kde kyselina glutamová 53 (Glu53) se přivede do těsnější blízkosti k přímé interakci s 5 'hydroxylovou skupinou nukleosidu.[9][10]
- Jednou z hypotéz pro funkčnost „otevřené“ konformace je, že „otevřená“ konformace může pomáhat při počáteční vazbě nukleosidů a uvolňování monofosfátového produktu[9]
Funkce
Deoxycytidinkináza (dCK) fosforyluje několik deoxyribonukleosidů a jejich nukleosidové analogy (nukleosid s cukrem a jinou náhražkou nebo analogem báze nukleové kyseliny, který má po úpravě jedinečné vlastnosti) pomocí fosfátových skupin z ATP a UTP.[9][10] Přesněji řečeno, dCK přidává první fosforylovou skupinu k předem vytvořeným nukleosidům a je obvykle enzymem omezujícím rychlost celkového procesu přeměny nukleosidů na jejich deoxynukleosid trifosfátovou formu, nebo nukleotid formě, v záchranné cestě nukleosidů.[10] Níže je uvedena zjednodušená cesta, která zobrazuje roli dCK při syntéze nukleotidů pomocí záchranné cesty nukleosidů.[8][11]

Glu53 provádí základní katalýza deprotonovat hydroxylovou skupinu, což umožňuje, aby nyní nukleofilní kyslík z nukleosidové 5 'hydroxylové skupiny napadl konec fosfátového řetězce (gama fosfát) na fosforylovém donoru (např. ATP nebo UTP). Toto považovalo „uzavřenou“ konformaci za katalyticky aktivní konformaci, protože katalyzuje přenos fosforylu mezi donory fosforylu a přijímajícími nukleosidy.[9] Podobně se „otevřená“ konformace obecně označuje jako katalyticky neaktivní forma, protože Glu53 není v těsné blízkosti nukleosidové 5 'hydroxylové skupiny a nebude katalyzovat přenos fosforylu.[9]
Nařízení
Jednou metodou regulace jak katalytické aktivity, tak substrátové specificity je posttranslační modifikace na Serinu 74, zbytku v inzertní oblasti na každé z jednotlivých podjednotek dCK.[9] Ačkoli je serin 74 daleko od aktivního místa dCK, fosforylace serinu 74 (Ser74) na dCK způsobuje změnu v konformaci enzymu a ovlivňuje kinetiku enzymu. Přesněji řečeno, fosforylace Ser74 upřednostňuje dCK, aby přijala svoji otevřenou (neaktivní) konformaci a umožnila dCK, aby se stala kompetentnější pro vazbu a uvolňování nukleosidů, ale omezuje dCK v přenosu fosforylových skupin. Uzavřená (aktivní) konformace dCK umožňuje dCK přenášet fosforylové skupiny, ale nevázat ani neuvolňovat nukleosidy. Stavy „otevřený“ a „uzavřený“ označují vazebné místo pro nukleosidy na dCK.[9]
Biosyntéza nukleotidů
dCK je klíčový enzym v nukleosidové záchranné cestě (NSP). Přesněji řečeno, tato cesta recykluje preformované nukleosidy z degradujících molekul DNA za účelem syntézy dNTP pro buňku. Nukleosidová záchranná cesta může působit jako alternativní cesta k produkci nukleotidů (dNTP) v případě de novo downregulace dráhy.[6] To znamená, že záchranná cesta (a tedy dCK) je upregulována, když je de novo cesta downregulována nebo inhibována, aby se kompenzovala ztráta produkce nukleotidů. Oba de novo cesta (DNP) a cesta pro záchranu nukleosidů (NSP) jsou anabolické cesty, které produkují deoxyribonukleotid trifosfáty (dNTP) nebo nukleotidy, monomery které tvoří DNA.
Terapeutické důsledky
Nedostatek dCK je spojen s rezistencí na antivirové a protinádorové chemoterapeutické látky. Naopak zvýšená aktivita deoxycytidinkinázy je spojena se zvýšenou aktivací těchto látek na cytotoxické deriváty nukleosid trifosfátu. dCK je klinicky důležitý kvůli svému vztahu k rezistenci a citlivosti na léky.[5] Ukázalo se, že manipulace s enzymatickou aktivitou dCK má silnou korelaci v senzibilizaci buněk s účinky jiných léčiv (např. Inhibitory RNR,[6] gemcitabin) nebo léčby (např. ionizujícím zářením)[11] a další kombinované terapie jsou v současné době studovány ke snížení mechanismů biologické rezistence a drogová snášenlivost u pacientů.[6][11][12]
Například, gemcitabin je analog pyrimidinového nukleosidu schválený FDA a je založen na aktivitě dCK proléčivo který se používá k léčbě rakoviny slinivky, prsu, močového měchýře a nemalobuněčného karcinomu plic.[8][11] Mechanicky dCK, který absorbuje preformované nukleosidy, přidává první fosforylovou skupinu na dFdC (původní forma gemcitabinu jako analog deoxycytidinu), aby ji přeměnil na dFdCMP, svou monofosfátovou formu.[8][11] Cytidylát kináza nebo UMP-CMP kináza poté přidá druhou fosforylovou skupinu za vzniku dFdCDP (forma gemcitabin difosfátu), která může inhibovat ribonukleotid reduktáza. Nukleosid-difosfátkináza nebo nukleosid kináza A přidává třetí fosforylovou skupinu za vzniku dFdCTP (forma gemcitabin trifosfátu), což je aktivní forma gemcitabinu, která inhibuje jak deoxycytidylát deamináza a DNA polymeráza.[8] Ačkoli se gemcitabin široce používá k léčbě solidních nádorů po více než deset let, pacienti užívající samotný gemcitabin (monoterapie ) byly pozorovány chemorezistence na drogu.[8][11]
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000156136 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000029366 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b „Entrez Gene: DCK deoxycytidinkináza“.
- ^ A b C d E Nathanson DA, Armijo AL, Tom M, Li Z, Dimitrova E, Austin WR, Nomme J, Campbell DO, Ta L, Le TM, Lee JT, Darvish R, Gordin A, Wei L, Liao HI, Wilks M, Martin C , Sadeghi S, Murphy JM, Boulos N, Phelps ME, Faull KF, Herschman HR, Jung ME, Czernin J, Lavie A, Radu CG (březen 2014). „Společné cílení biosyntetických drah konvergentních nukleotidů na eradikaci leukémie“. The Journal of Experimental Medicine. 211 (3): 473–86. doi:10.1084 / jem.20131738. PMC 3949575. PMID 24567448.
- ^ A b C Sabini E, Ort S, Monnerjahn C, Konrad M, Lavie A (červenec 2003). „Struktura lidského dCK naznačuje strategie ke zlepšení protinádorové a antivirové terapie“. Přírodní strukturní biologie. 10 (7): 513–9. doi:10.1038 / nsb942. hdl:11858 / 00-001M-0000-0012-F0B9-8. PMID 12808445. S2CID 6212685.
- ^ A b C d E F de Sousa Cavalcante L, Monteiro G (říjen 2014). "Gemcitabin: metabolismus a molekulární mechanismy působení, citlivost a chemorezistence u rakoviny pankreatu". European Journal of Pharmacology. 741: 8–16. doi:10.1016 / j.ejphar.2014.07.041. PMID 25084222.
- ^ A b C d E F G h i j Hazra S, Szewczak A, Ort S, Konrad M, Lavie A (duben 2011). „Posttranslační fosforylace serinu 74 lidské deoxycytidinkinázy upřednostňuje enzym, který přijímá otevřenou konformaci, díky čemuž je kompetentní pro vazbu a uvolňování nukleosidů.“. Biochemie. 50 (14): 2870–80. doi:10.1021 / bi2001032. PMC 3071448. PMID 21351740.
- ^ A b C d E F Sabini E, Hazra S, Konrad M, Lavie A (červenec 2008). "Elucidace různých vazebných režimů purinových nukleosidů na lidskou deoxycytidinkinázu". Journal of Medicinal Chemistry. 51 (14): 4219–25. doi:10.1021 / jm800134t. PMC 2636677. PMID 18570408.
- ^ A b C d E F Grégoire V, Rosier JF, De Bast M, Bruniaux M, De Coster B, Octave-Prignot M, Scalliet P (červen 2002). „Role aktivity deoxycytidinkinázy (dCK) v radioaktivním posílení gemcitabinu u myší a lidských buněčných linií in vitro.“ Radioterapie a onkologie. 63 (3): 329–38. doi:10.1016 / s0167-8140 (02) 00106-8. PMID 12142097.
- ^ Bozic I, Reiter JG, Allen B, Antal T, Chatterjee K, Shah P, Moon YS, Yaqubie A, Kelly N, Le DT, Lipson EJ, Chapman PB, Diaz LA, Vogelstein B, Nowak MA (červen 2013). „Evoluční dynamika rakoviny v reakci na cílenou kombinovanou terapii“. eLife. 2: e00747. doi:10,7554 / eLife.00747. PMC 3691570. PMID 23805382.
Další čtení
- Hazra S, Szewczak A, Ort S, Konrad M, Lavie A (duben 2011). „Posttranslační fosforylace serinu 74 lidské deoxycytidinkinázy upřednostňuje enzym, který přijímá otevřenou konformaci, díky čemuž je kompetentní pro vazbu a uvolňování nukleosidů.“. Biochemie. 50 (14): 2870–80. doi:10.1021 / bi2001032. PMC 3071448. PMID 21351740.
- Hazra S, Konrad M, Lavie A (srpen 2010). „Cukrový kruh nukleosidu je nutný pro produktivní umístění substrátu v aktivním místě lidské deoxycytidinkinázy (dCK): důsledky pro vývoj dCK aktivovaných acyklických analogů guaninu“. Journal of Medicinal Chemistry. 53 (15): 5792–800. doi:10.1021 / jm1005379. PMC 2936711. PMID 20684612.
- Hazra S, Ort S, Konrad M, Lavie A (srpen 2010). „Strukturální a kinetická charakterizace variant lidské deoxycytidinkinázy schopných fosforylovat 5-substituované analogy deoxycytidinu a thymidinu“. Biochemie. 49 (31): 6784–90. doi:10.1021 / bi100839e. PMC 2925221. PMID 20614893.
- Hazra S, Sabini E, Ort S, Konrad M, Lavie A (únor 2009). „Rozšíření aktivity thymidinkinázy na katalytický repertoár lidské deoxycytidinkinázy“. Biochemie. 48 (6): 1256–63. doi:10.1021 / bi802062w. PMC 2701478. PMID 19159229.
- Sabini E, Hazra S, Konrad M, Lavie A (červenec 2008). "Elucidace různých způsobů vazby purinových nukleosidů na lidskou deoxycytidinkinázu". Journal of Medicinal Chemistry. 51 (14): 4219–25. doi:10.1021 / jm800134t. PMC 2636677. PMID 18570408.
- Sabini E, Hazra S, Ort S, Konrad M, Lavie A (květen 2008). „Strukturální základ pro promiskuitu substrátu dCK“. Journal of Molecular Biology. 378 (3): 607–21. doi:10.1016 / j.jmb.2008.02.061. PMC 2426910. PMID 18377927.
- McSorley T, Ort S, Hazra S, Lavie A, Konrad M (březen 2008). „Napodobování fosforylace Ser-74 na lidskou deoxycytidinkinázu selektivně zvyšuje katalytickou aktivitu pro dC a dC analogy“. FEBS Dopisy. 582 (5): 720–4. doi:10.1016 / j.febslet.2008.01.048. PMC 2636680. PMID 18258203.
- Sabini E, Hazra S, Konrad M, Lavie A (červen 2007). "Neenantioselektivní vlastnost lidské deoxycytidinkinázy vysvětlena strukturami enzymu v komplexu s L- a D-nukleosidy". Journal of Medicinal Chemistry. 50 (13): 3004–14. doi:10.1021 / jm0700215. PMC 2586175. PMID 17530837.
- Sabini E, Hazra S, Konrad M, Burley SK, Lavie A (2007). „Strukturální základ pro aktivaci terapeutických analogů L-nukleosidů 3TC a troxacitabinu lidskou deoxycytidinkinázou“. Výzkum nukleových kyselin. 35 (1): 186–92. doi:10.1093 / nar / gkl1038. PMC 1802566. PMID 17158155.
- Arnér ES, Eriksson S (1996). "Savčí deoxyribonukleosidové kinázy". Farmakologie a terapeutika. 67 (2): 155–86. doi:10.1016/0163-7258(95)00015-9. PMID 7494863.
- Chottiner EG, Shewach DS, Datta NS, Ashcraft E, Gribbin D, Ginsburg D, Fox IH, Mitchell BS (únor 1991). "Klonování a exprese cDNA lidské deoxycytidinkinázy". Sborník Národní akademie věd Spojených států amerických. 88 (4): 1531–5. doi:10.1073 / pnas.88.4.1531. PMC 51053. PMID 1996353.
- Eriksson S, Cederlund E, Bergman T, Jörnvall H, Bohman C (březen 1991). "Charakterizace lidské deoxycytidinkinázy. Korelace se sekvencemi cDNA". FEBS Dopisy. 280 (2): 363–6. doi:10.1016 / 0014-5793 (91) 80332-W. PMID 2013338. S2CID 26841109.
- Yamada Y, Goto H, Ogasawara N (listopad 1983). "Purinové nukleosidové kinázy v lidských T- a B-lymfoblastech". Biochimica et Biophysica Acta (BBA) - Obecné předměty. 761 (1): 34–40. doi:10.1016/0304-4165(83)90359-8. PMID 6315069.
- Hurley MC, Palella TD, Fox IH (prosinec 1983). "Lidský placentární deoxyadenosin a deoxyguanosin fosforylační aktivita". The Journal of Biological Chemistry. 258 (24): 15021–7. PMID 6317685.
- Spasokoukotskaja T, Arnér ES, Brosjö O, Gunvén P, Juliusson G, Liliemark J, Eriksson S (1995). "Exprese deoxycytidinkinázy a fosforylace 2-chlorodeoxyadenosinu v lidských normálních a nádorových buňkách a tkáních". European Journal of Cancer. 31A (2): 202–8. doi:10.1016/0959-8049(94)00435-8. PMID 7718326.
- Stegmann AP, Honders MW, Bolk MW, Wessels J, Willemze R, Landegent JE (srpen 1993). "Přiřazení genu lidské deoxycytidinkinázy (DCK) do pásma chromozomu 4 q13.3-q21.1". Genomika. 17 (2): 528–9. doi:10.1006 / geno.1993.1365. PMID 8406512.
- Song JJ, Walker S, Chen E, Johnson EE, Spychala J, Gribbin T, Mitchell BS (leden 1993). "Genomická struktura a chromozomální lokalizace genu lidské deoxycytidinkinázy". Sborník Národní akademie věd Spojených států amerických. 90 (2): 431–4. doi:10.1073 / pnas.90.2.431. PMC 45676. PMID 8421671.
- Johansson M, Brismar S, Karlsson A (říjen 1997). „Lidská deoxycytidinkináza se nachází v buněčném jádru“. Sborník Národní akademie věd Spojených států amerických. 94 (22): 11941–5. doi:10.1073 / pnas.94.22.11941. PMC 23663. PMID 9342341.
- Hatzis P, Al-Madhoon AS, Jüllig M, Petrakis TG, Eriksson S, Talianidis I (listopad 1998). „Intracelulární lokalizace deoxycytidinkinázy“. The Journal of Biological Chemistry. 273 (46): 30239–43. doi:10.1074 / jbc.273.46.30239. PMID 9804782.
- Saada A, Shaag A, Mandel H, Nevo Y, Eriksson S, Elpeleg O (listopad 2001). "Mutantní mitochondriální thymidinkináza v mitochondriální myopatii vyčerpání DNA". Genetika přírody. 29 (3): 342–4. doi:10.1038 / ng751. PMID 11687801. S2CID 3045143.
- Veuger MJ, Heemskerk MH, Honders MW, Willemze R, Barge RM (únor 2002). "Funkční role alternativně sestřižené deoxycytidinkinázy v citlivosti na cytarabin akutních myeloidních leukemických buněk". Krev. 99 (4): 1373–80. doi:10.1182 / krev. V99.4.1373. PMID 11830489.
- Innoceta A, Galluzzi L, Ruzzo A, Andreoni F, Chiarantini L, Magnani M (únor 2002). "Molekulární základ 2 ', 3'-dideoxycytidinu vyvolané lékové rezistence v lidských buňkách". Molekulární a buněčná biochemie. 231 (1–2): 173–7. doi:10.1023 / A: 1014441209108. PMID 11952160. S2CID 11289854.
- Krawiec K, Kierdaszuk B, Shugar D (leden 2003). „Anorganický tripolyfosfát (PPP (i)) jako donor fosfátu pro lidské deoxyribonukleosid kinázy“. Sdělení o biochemickém a biofyzikálním výzkumu. 301 (1): 192–7. doi:10.1016 / S0006-291X (02) 03007-3. PMID 12535661.
- van der Wilt CL, Kroep JR, Loves WJ, Rots MG, Van Groeningen CJ, Kaspers GJ, Peters GJ (březen 2003). "Exprese deoxycytidinkinázy v leukemických buňkách ve srovnání s buněčnými liniemi pevných nádorů, jaterními metastázami a normálními játry". European Journal of Cancer. 39 (5): 691–7. doi:10.1016 / S0959-8049 (02) 00813-4. PMID 12628850.
- Ge Y, Jensen TL, Matherly LH, Taub JW (prosinec 2003). „Fyzické a funkční interakce mezi proteiny USF a Sp1 regulují aktivitu promotoru lidské deoxycytidinkinázy“. The Journal of Biological Chemistry. 278 (50): 49901–10. doi:10,1074 / jbc.M305085200. PMID 14514691.
- Usova E, Maltseva T, Földesi A, Chattopadhayaya J, Eriksson S (prosinec 2004). "Lidská deoxycytidinkináza jako deoxyribonukleosid fosforyláza". Journal of Molecular Biology. 344 (5): 1347–58. doi:10.1016 / j.jmb.2004.10.016. PMID 15561147.
- Mani RS, Usova EV, Eriksson S, Cass CE (říjen 2004). "Fluorescenční studie vazby substrátu na lidskou rekombinantní deoxycytidinkinázu". Nukleosidy, nukleotidy a nukleové kyseliny. 23 (8–9): 1343–6. doi:10.1081 / NCN-200027609. PMID 15571255. S2CID 20686075.
externí odkazy
- Deoxycytidin + kináza v americké národní lékařské knihovně Lékařské předměty (Pletivo)