Terminální deoxynukleotidyltransferáza - Terminal deoxynucleotidyl transferase
Terminální deoxynukleotidyltransferáza (TdT), také známý jako DNA nukleotidylexotransferáza (DNTT) nebo terminální transferáza, je specialista DNA polymeráza vyjádřeno nezralým, pre-B, pre-T lymfoidní buňky a akutní lymfoblastická leukémie / lymfomové buňky. TdT dodává N-nukleotidy do V, D a J exony genů TCR a BCR během rekombinace genů protilátek, umožňující fenomén křižovatková rozmanitost. U lidí je terminální transferáza kódována DNTT gen.[5][6] Jako člen rodiny X X DNA polymeráza enzymy, funguje ve spojení s polymerázou λ a polymerázou μ, které oba patří do stejné rodiny X polymerázových enzymů. Rozmanitost zavedená TdT hrála důležitou roli ve vývoji imunitního systému obratlovců, což významně zvyšuje rozmanitost receptorů antigenu, kterými je buňka vybavena pro boj s patogeny. Studie využívající TdT knockout myši prokázaly drastická (10násobná) snížení Receptor T-buněk (TCR) rozmanitost ve srovnání s rozmanitostí normálních nebo divokých typů systémů. Větší rozmanitost TCR, kterou je organismus vybaven, vede k větší odolnosti proti infekci.[7][8] Ačkoli TdT byla jednou z prvních DNA polymeráz identifikovaných u savců v roce 1960,[9] zůstává jednou z nejméně chápaných ze všech DNA polymeráz.[7] V letech 2016–18 byla objevena TdT v trans chování závislé na šabloně kromě jeho obecněji známého chování nezávislého na šabloně[10][11]
TdT ve fetálních játrech chybí HSC, významně zhoršující křižovatková rozmanitost v B-buňkách během fetálního období.[12]
Funkce a regulace
Obecně TdT katalýzy přidání nukleotidy do 3 'konec a DNA molekula. Na rozdíl od většiny DNA polymeráz nevyžaduje templát. Výhodným substrátem tohoto enzymu je a 3'-převis, ale může také přidávat nukleotidy na tupé nebo zapuštěné 3 'konce. Dále je TdT jedinou polymerázou, o které je známo, že katalyzuje syntézu 2-15nt DNA polymerů z volných nukleotidů v roztoku in vivo.[13] In vitro, toto chování katalyzuje obecnou tvorbu DNA polymerů bez specifické délky.[14] Produkovalo se 2 až 15 fragmentů DNA in vivo se předpokládá, že budou působit v signálních drahách souvisejících s opravnými a / nebo rekombinačními mechanizmy DNA.[13] Stejně jako mnoho polymeráz vyžaduje TdT dvojmocný kation kofaktor,[15] TdT je však jedinečný ve své schopnosti používat širší škálu kationtů, jako jsou Mg2 +, Mn2 +, Zn2 + a Co2 +.[15] Rychlost enzymatické aktivity závisí na dostupných dvojmocných kationtech a přidaném nukleotidu.[16]
TdT je exprimován většinou v primárních lymfoidních orgánech, jako je brzlík a kostní dřeň. Regulace jeho exprese probíhá několika cestami. Patří mezi ně interakce protein-protein, jako jsou ty s TdIF1. TdIF1 je další protein, který interaguje s TdT za účelem inhibice jeho funkce maskováním oblasti vázající DNA TdT polymerázy. Regulace exprese TdT existuje také na transkripční úrovni, s regulací ovlivněnou faktory specifickými pro danou fázi, a dochází k ní vývojově omezujícím způsobem.[7][17][18] Ačkoli se obvykle zjistí, že exprese je v primárních lymfoidních orgánech, nedávná práce naznačuje, že stimulace prostřednictvím antigenu může vést k sekundární expresi TdT spolu s dalšími enzymy potřebnými pro přeskupení genů mimo brzlík pro T-buňky.[19] Pacienti s akutní lymfoblastickou leukémií značně nadměrně produkují TdT.[16] Buněčné linie odvozené od těchto pacientů sloužily jako jeden z prvních zdrojů čistého TdT a vedly k objevu, že existují rozdíly v aktivitě mezi lidskými a hovězími izoformami.[16]
Mechanismus
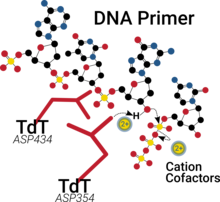
Podobně jako u mnoha polymerázy, katalytické místo TdT má ve své palmové doméně dva dvojmocné kationty, které pomáhají při vazbě nukleotidů, pomáhají snižovat pKA 3'-OH skupiny a nakonec usnadnit odchod výsledného pyrofosfátového vedlejšího produktu.[20][21]
Varianta izoformy
Několik izoformy TdT byly pozorovány u myší, skotu a lidí. Dosud byly u myší identifikovány dvě varianty, u lidí tři.[22]
Dvě varianty sestřihu identifikované u myší jsou pojmenovány podle jejich příslušných délek: TdTS sestává z 509 aminokyselin, zatímco TdTL, delší varianta, sestává z 529 aminokyselin. Rozdíly mezi TdTS a TdTL se vyskytují mimo oblasti, které vážou DNA a nukleotidy. To, že rozdíl 20 aminokyselin ovlivňuje enzymatickou aktivitu, je kontroverzní, přičemž někteří tvrdí, že modifikace TdTL poskytují aktivitu exonukleázy, zatímco jiné tvrdí, že TdTL a TdTS mají téměř identické in vitro aktivita. Navíc TdTL údajně může modulovat katalytickou aktivitu TdTS in vivo neznámým mechanismem. Navrhuje se, že to pomáhá při regulaci role TdT při rekombinaci V (D) J.[23]
Lidské izoformy TdT mají tři varianty TdTL1, TdTL2 a TdTS. TdTL1 je obecně exprimován v lymfoidních buněčných liniích, zatímco TdTL2 je převážně exprimován v normálních malých lymfocytech. Oba se lokalizují v jádře, když jsou exprimovány[24] a oba mají 3 '-> 5' exonukleázovou aktivitu.[25] Naproti tomu izoformy TdTS nemají exonukleázovou aktivitu a provádějí nezbytné prodloužení během V (D) J rekombinace.[25] Jelikož se podobná aktivita exonukleázy předpokládaná u myšího TdTL nachází u lidského a hovězího TdTL, někteří předpokládají, že hovězí a lidské TdTL izoformy regulují izoformy TdTS podobným způsobem, jak se navrhuje u myší.[23] Někteří dále předpokládají, že TdTL1 může být zapojen do regulace aktivity TdTL2 a / nebo TdTS.
Role ve V (D) J rekombinaci
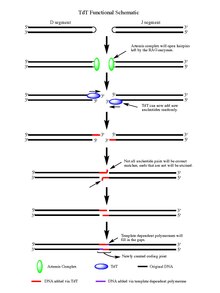
Na základě akce HADR 1/2 enzymů, štěpená dvouvláknová DNA je ponechána sponka do vlasů struktury na konci každého segmentu DNA vytvořeného štěpnou událostí. Vlásenky jsou oba otevřeny Artemis komplex, který má endonukleáza aktivita, když je fosforylován, poskytuje volné 3 'OH konce, na které TdT působí. Jakmile komplex Artemis odvedl svoji práci a přidal palindromické nukleotidy (P-nukleotidy) k nově otevřeným vlásenkám DNA, je připravena fáze, aby TdT svou práci splnil. TdT je nyní schopen přijít a přidat N-nukleotidy ke stávajícím P-nukleotidům ve směru 5 'až 3', o kterém je známo, že fungují polymerázy. V průměru se na každý 3 'konec vygenerovaný po akci komplexu Artemis přidá 2–5 náhodných párů bází. Počet přidaných bází je dostatečný pro dvě nově syntetizované ssDNA segmenty, které mají podstoupit zarovnání mikrohomologie během nehomologní spojování konců podle normálu Watson-Crickovo párování základen vzory (A-T, C-G). Odtamtud jsou nepárové nukleotidy vyříznuty exonukleázou, jako je Artemis Complex (který má kromě aktivity endonukleázy také aktivitu exonukleáz), a mezery pak mohou vyplnit mezerami závislé polymerázy, které nakonec vytvoří nový kódující kloub s kombinací ligázy segmenty. Ačkoli TdT nerozlišuje mezi čtyřmi páry bází, když je přidává do N-nukleotidových segmentů, vykazuje zkreslení pro guanin a cytosin základní páry.[7]
Aktivita závislá na šabloně

V závislosti na templátu může TdT inkorporovat nukleotidy přes zlomky řetězců v dvouvláknové DNA způsobem označovaným jako v trans na rozdíl od v cis mechanismus nacházející se ve většině polymeráz. K tomu dochází optimálně s přestávkou jednoho páru bází mezi prameny a méně s rostoucí mezerou. To je usnadněno podsekcí TdT zvanou Loop1, která selektivně sonduje na krátké přestávky ve dvouvláknové DNA. Objev této aktivity závislé na šabloně dále vedl k přesvědčivějším mechanistickým hypotézám o tom, jak při rekombinaci V (D) J dochází k distribuci délek sčítání N oblastí.[26]

Polymeráza μ a polymeráza λ vykazují podobné v trans templátovanou závislou syntetickou aktivitu na TdT, ale bez podobné závislosti na následné dvouvláknové DNA.[27] Dále bylo také zjištěno, že polymeráza X vykazuje podobnou syntetickou aktivitu nezávislou na templátu. Spolu s aktivitou jako terminální transferáza je známo, že funguje také obecnějším způsobem závislým na šabloně.[28] Podobnosti mezi TdT a polymerázou μ naznačují, že jsou úzce evolučně příbuzné.[26]
Použití
Terminal transferase má aplikace v molekulární biologie. Může být použit v ZÁVOD pro přidání nukleotidů, které mohou být následně použity jako templát pro primer PCR. Může být také použit k přidání nukleotidů značených radioaktivní izotopy, například v Test TUNEL (Terminální deoxynukleotidyltransferáza dUTP Nick End Labeling) za předvedení apoptóza (který je částečně označen fragmentovanou DNA). Používá se také v imunofluorescenčním testu pro diagnostiku akutní lymfoblastická leukémie.[29]
v imunohistochemie Protilátky proti TdT lze použít k prokázání přítomnosti nezralých T a B buněk a pluripotentu krvetvorné kmenové buňky, které obsahují antigen, zatímco zralé lymfoidní buňky jsou vždy TdT negativní. Zatímco TdT-pozitivní buňky se nacházejí v malém počtu ve zdravých lymfatických uzlinách a mandlích, maligní buňky akutní lymfoblastické leukémie jsou také TdT-pozitivní a protilátku lze proto použít jako součást panelu k diagnostice tohoto onemocnění ak odlišit ji například od malých buněk z dětství.[30]
TdT také viděl nedávnou aplikaci v De Novo syntéze oligonukleotidů s TdT-dNTP vázanými analogy schopnými prodloužení primeru o 1 nt najednou.[31] Jinými slovy, enzym TdT prokázal schopnost tvorby syntetické DNA přidáním jednoho písmena po druhém do sekvence primeru.
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000107447 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000025014 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Isobe M, Huebner K, Erikson J, Peterson RC, Bollum FJ, Chang LM, Croce CM (září 1985). "Chromozomová lokalizace genu pro lidskou terminální deoxynukleotidyltransferázu do oblasti 10q23-q25". Sborník Národní akademie věd Spojených států amerických. 82 (17): 5836–40. Bibcode:1985PNAS ... 82,5836I. doi:10.1073 / pnas.82.17.5836. PMC 390648. PMID 3862101.
- ^ Yang-Feng TL, Landau NR, Baltimore D, Francke U (1986). „Terminální gen deoxynukleotidyltransferázy je umístěn na lidském chromozomu 10 (10q23 ---- q24) a na myším chromozomu 19“. Cytogenetika a genetika buněk. 43 (3–4): 121–6. doi:10.1159/000132309. PMID 3467897.
- ^ A b C d Motea EA, Berdis AJ (květen 2010). „Terminální deoxynukleotidyltransferáza: příběh zavádějící DNA polymerázy“. Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 1804 (5): 1151–66. doi:10.1016 / j.bbapap.2009.06.030. PMC 2846215. PMID 19596089.
- ^ Haeryfar SM, Hickman HD, Irvine KR, Tscharke DC, Bennink JR, Yewdell JW (červenec 2008). „Terminální deoxynukleotidyltransferáza zavádí a rozšiřuje antivirové hierarchie imunodominance CD8 + T buněk“. Journal of Immunology. 181 (1): 649–59. doi:10,4049 / jimmunol.181.1.649. PMC 2587314. PMID 18566432.
- ^ Bollum FJ (srpen 1960). "Calf thymus polymerase". The Journal of Biological Chemistry. 235: 2399–403. PMID 13802334.
- ^ Gouge J, Rosario S, Romain F, Poitevin F, Béguin P, Delarue M (duben 2015). „Strukturální základ pro nový mechanismus přemostění a vyrovnání DNA při opravě eukaryotické DSB DNA“. Časopis EMBO. 34 (8): 1126–42. doi:10.15252 / embj.201489643. PMC 4406656. PMID 25762590.
- ^ Loc'h J, Delarue M (prosinec 2018). „Terminální deoxynukleotidyltransferáza: příběh neplánované DNA polymerázy schopné přemostění DNA a templátové syntézy napříč řetězci“. Aktuální názor na strukturní biologii. 53: 22–31. doi:10.1016 / j.sbi.2018.03.019. PMID 29656238.
- ^ Hardy R (2008). „Kapitola 7: B vývoj lymfocytů a biologie“. V Paul W (ed.). Základní imunologie (Kniha) (6. vydání). Philadelphia: Lippincott Williams & Wilkins. 237–269. ISBN 978-0-7817-6519-0.
- ^ A b Ramadan K, Shevelev IV, Maga G, Hübscher U (květen 2004). "De novo syntéza DNA lidskou DNA polymerázou lambda, DNA polymerázou mu a terminální deoxyribonukleotidyltransferázou". Journal of Molecular Biology. 339 (2): 395–404. doi:10.1016 / j.jmb.2004.03.056. PMID 15136041.
- ^ Bollum FJ, Chang LM, Tsiapalis CM, Dorson JW (1974). "Nukleotidové polymerizující enzymy z telecí brzlíku". Metody v enzymologii. 29: 70–81. doi:10.1016/0076-6879(74)29010-4. ISBN 9780121818920. PMID 4853390.
- ^ A b Chang LM, Bollum FJ (duben 1970). „Enzymy polymerující doxynukleotidy telecího brzlíku. IV. Inhibice terminální deoxynukleotidyltransferázy kovovými ligandy“. Sborník Národní akademie věd Spojených států amerických. 65 (4): 1041–8. Bibcode:1970PNAS ... 65.1041C. doi:10.1073 / pnas.65.4.1041. PMC 283020. PMID 4985880.
- ^ A b C Deibel MR, Coleman MS (květen 1980). "Biochemické vlastnosti purifikované lidské terminální deoxynukleotidyltransferázy". The Journal of Biological Chemistry. 255 (9): 4206–12. PMID 7372675.
- ^ Cherrier M, D'Andon MF, Rougeon F, Doyen N (únor 2008). "Identifikace nového cis-regulačního prvku terminálního genu pro deoxynukleotidyltransferázu v 5 'oblasti myšího lokusu". Molekulární imunologie. 45 (4): 1009–17. doi:10.1016 / j.molimm.2007.07.027. PMID 17854898.
- ^ Kubota T, Maezawa S, Koiwai K, Hayano T, Koiwai O (srpen 2007). "Identifikace funkčních domén v TdIF1 a jeho inhibiční mechanismus pro aktivitu TdT". Geny do buněk. 12 (8): 941–59. doi:10.1111 / j.1365-2443.2007.01105.x. PMID 17663723. S2CID 25530793.
- ^ Zhang Y, Shi M, Wen Q, Luo W, Yang Z, Zhou M, Ma L (01.01.2012). „Antigenní stimulace indukuje expresi genu 1 aktivujícího rekombinaci a expresi terminální deoxynukleotidyltransferázy v hybridomu myší T-buňky“. Buněčná imunologie. 274 (1–2): 19–25. doi:10.1016 / j.cellimm.2012.02.008. PMID 22464913.
- ^ Vashishtha AK, Wang J, Konigsberg WH (září 2016). „Různé dvojmocné kationty mění kinetiku a věrnost DNA polymeráz“. The Journal of Biological Chemistry. 291 (40): 20869–20875. doi:10,1074 / jbc.R116,742494. PMC 5076500. PMID 27462081.
- ^ Delarue M, Boulé JB, Lescar J, Expert-Bezançon N, Jourdan N, Sukumar N a kol. (Únor 2002). „Krystalové struktury templát-nezávislé DNA polymerázy: myší terminální deoxynukleotidyltransferáza“. Časopis EMBO. 21 (3): 427–39. doi:10.1093 / emboj / 21.3.427. PMC 125842. PMID 11823435.
- ^ Steenberg ML, Lokhandwala MF, Jandhyala BS (1988). „Abnormality v transportu sodíku jako příčinný faktor zvýšeného přetečení norepinefrinu u spontánně hypertenzních potkanů“. Klinická a experimentální hypertenze. Část A, Teorie a praxe. 10 (5): 833–41. doi:10.1080/07300077.1988.11878788. PMID 2846215.
- ^ A b Schmoldt A, Benthe HF, Haberland G (září 1975). "Metabolismus digitoxinu mikrosomy jater jater potkana". Biochemická farmakologie. 24 (17): 1639–41. doi:10.1016/0006-2952(75)90094-5. PMID 10.
- ^ Thai TH, Kearney JF (září 2004). „Výrazné a opačné aktivity variant spojování lidské terminální deoxynukleotidyltransferázy“. Journal of Immunology. 173 (6): 4009–19. doi:10,4049 / jimmunol.173.6.4009. PMID 15356150. S2CID 40193319.
- ^ A b Thai TH, Kearney JF (2005). "Isoformy terminální deoxynukleotidyltransferázy: vývojové aspekty a funkce". Pokroky v imunologii. 86: 113–36. doi:10.1016 / S0065-2776 (04) 86003-6. ISBN 9780120044863. PMID 15705420.
- ^ A b Bland RD, Clarke TL, Harden LB (únor 1976). „Rychlá infuze hydrogenuhličitanu sodného a albuminu vysoce rizikovým předčasně narozeným dětem brzy po narození: kontrolovaná, prospektivní studie“. American Journal of Obstetrics and Gynecology. 124 (3): 263–7. doi:10.1016 / 0002-9378 (76) 90154-x. PMID 2013.
- ^ Martin MJ, Blanco L (červenec 2014). „Rozhodování během NHEJ: síť interakcí v lidské Polμ zapojené do rozpoznávání substrátu a přemostění konce“. Výzkum nukleových kyselin. 42 (12): 7923–34. doi:10.1093 / nar / gku475. PMC 4081086. PMID 24878922.
- ^ Maga G, Ramadan K, Locatelli GA, Shevelev I, Spadari S, Hübscher U (leden 2005). „Prodloužení DNA aktivitou lidské DNA polymerázy lambda polymerázy a terminální transferázy jsou odlišně koordinovány proliferujícím buněčným jaderným antigenem a replikačním proteinem A“. The Journal of Biological Chemistry. 280 (3): 1971–81. doi:10,1074 / jbc.M411650200. PMID 15537631. S2CID 43322190.
- ^ Faber J, Kantarjian H, Roberts MW, Keating M, Freireich E, Albitar M (leden 2000). "Terminální deoxynukleotidyltransferáza-negativní akutní lymfoblastická leukémie". Archivy patologie a laboratorní medicíny. 124 (1): 92–7. doi:10.1043 / 0003-9985 (2000) 124 <0092: TDTNAL> 2.0.CO; 2 (neaktivní 12. 10. 2020). PMID 10629138.CS1 maint: DOI neaktivní od října 2020 (odkaz)
- ^ Leong AS, Cooper K, Leong FJ (2003). Manuál diagnostické cytologie (2. vyd.). Greenwich Medical Media, Ltd. str. 413–414. ISBN 1-84110-100-1.
- ^ Palluk S, Arlow DH, de Rond T, Barthel S, Kang JS, Bector R, Baghdassarian HM, Truong AN, Kim PW, Singh AK, Hillson NJ, Keasling JD (srpen 2018). "De novo syntéza DNA s použitím konjugátů polymeráza-nukleotid". Přírodní biotechnologie. 36 (7): 645–650. doi:10,1038 / nbt.4173. OSTI 1461176. PMID 29912208. S2CID 49271982.
Další čtení
- O'Malley DP, Orazi A (srpen 2006). „Terminální buňky pozitivní na deoxynukleotidyltransferázu ve slezině, slepém střevě a rozštěpových cystách u pediatrických pacientů“. Haematologica. 91 (8): 1139–40. PMID 16885057.
- Yamashita N, Shimazaki N, Ibe S, Kaneko R, Tanabe A, Toyomoto T a kol. (Červenec 2001). „Terminální deoxynukleotidyltransferáza přímo interaguje s novým jaderným proteinem, který je homologní s p65.“ Geny do buněk. 6 (7): 641–52. doi:10.1046 / j.1365-2443.2001.00449.x. PMID 11473582. S2CID 19573920.
- Chang LM, Bollum FJ (1986). "Molekulární biologie terminální transferázy". CRC kritické recenze v biochemii. 21 (1): 27–52. doi:10.3109/10409238609113608. PMID 3524991.
- Maezawa S, Hayano T, Koiwai K, Fukushima R, Kouda K, Kubota T, Koiwai O (květen 2008). „Bood POZ obsahující gen typu 2 je lidským protějškem kvasinkového Btb3p a podporuje degradaci terminální deoxynukleotidyltransferázy“. Geny do buněk. 13 (5): 439–57. doi:10.1111 / j.1365-2443.2008.01179.x. PMID 18429817. S2CID 9698107.
- Taplin ME, Frantz ME, Canning C, Ritz J, Blumberg RS, Balk SP (březen 1996). „Důkazy proti vývoji T-buněk ve střevní sliznici dospělého člověka na základě nedostatku exprese terminální deoxynukleotidyltransferázy“. Imunologie. 87 (3): 402–7. doi:10.1046 / j.1365-2567.1996.496571.x. PMC 1384108. PMID 8778025.
- Grupe A, Li Y, Rowland C, Nowotny P, Hinrichs AL, Smemo S a kol. (Leden 2006). „Sken chromozomu 10 identifikuje nový lokus vykazující silnou souvislost s Alzheimerovou chorobou s pozdním nástupem“. American Journal of Human Genetics. 78 (1): 78–88. doi:10.1086/498851. PMC 1380225. PMID 16385451.
- Dworzak MN, Fritsch G, Fröschl G, Printz D, Gadner H (listopad 1998). „Čtyřbarevný průtokový cytometrický výzkum terminálních lymfoidních prekurzorů pozitivních na deoxynukleotidyltransferázu v dětské kostní dřeni: exprese CD79a předchází CD19 v časné ontogenezi B-buněk“. Krev. 92 (9): 3203–9. doi:10,1182 / krev. V92.9.3203. PMID 9787156.
- Fujita K, Shimazaki N, Ohta Y, Kubota T, Ibe S, Toji S a kol. (Červen 2003). „Terminální deoxynukleotidyltransferáza tvoří ternární komplex s novým proteinem remodelujícím chromatin s 82 kDa a jádrovým histonem“. Geny do buněk. 8 (6): 559–71. doi:10.1046 / j.1365-2443.2003.00656.x. PMID 12786946. S2CID 25223336.
- Kubota T, Maezawa S, Koiwai K, Hayano T, Koiwai O (srpen 2007). "Identifikace funkčních domén v TdIF1 a jeho inhibiční mechanismus pro aktivitu TdT". Geny do buněk. 12 (8): 941–59. doi:10.1111 / j.1365-2443.2007.01105.x. PMID 17663723. S2CID 25530793.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (říjen 1997). "Konstrukce a charakterizace knihovny cDNA obohacené o celou délku a 5'-end". Gen. 200 (1–2): 149–56. doi:10.1016 / S0378-1119 (97) 00411-3. PMID 9373149.
- Bridges SL (srpen 1998). „Časté přidávání dusíku a klonální příbuznost mezi lehkými řetězci lambda imunoglobulinu exprimovanými v synovii revmatoidní artritidy a PBL a vliv využití segmentu genu V lambda na délku CDR3“. Molekulární medicína. 4 (8): 525–53. doi:10.1007 / BF03401757. PMC 2230400. PMID 9742508.
- Liu L, McGavran L, Lovell MA, Wei Q, Jamieson BA, Williams SA a kol. (Červen 2004). "Nonpositive terminální deoxynukleotidyltransferáza u pediatrického prekurzoru B-lymfoblastické leukémie". American Journal of Clinical Pathology. 121 (6): 810–5. doi:10.1309 / QD18-PPV1-NH3T-EUTF. PMID 15198352.
- Yang B, Gathy KN, Coleman MS (duben 1994). "Mutační analýza zbytků v nukleotidové vazebné doméně lidské terminální deoxynukleotidyltransferázy". The Journal of Biological Chemistry. 269 (16): 11859–68. PMID 8163485.
- Thai TH, Kearney JF (září 2004). „Výrazné a opačné aktivity variant spojování lidské terminální deoxynukleotidyltransferázy“. Journal of Immunology. 173 (6): 4009–19. doi:10,4049 / jimmunol.173.6.4009. PMID 15356150. S2CID 40193319.
- Shimazaki N, Fujita K, Koiwai O (březen 2002). „[Exprese a funkce terminální deoxynukleotidyl-transferázy a objev nové DNA polymerázy mu]“. Seikagaku. The Journal of Japanese Biochemical Society. 74 (3): 227–32. PMID 11974916.
- Mahajan KN, Mitchell BS (září 2003). "Role lidského Pso4 v opravě savčí DNA a ve spojení s terminální deoxynukleotidyltransferázou". Sborník Národní akademie věd Spojených států amerických. 100 (19): 10746–51. Bibcode:2003PNAS..10010746M. doi:10.1073 / pnas.1631060100. PMC 196874. PMID 12960389.
- Mahajan KN, Gangi-Peterson L, Sorscher DH, Wang J, Gathy KN, Mahajan NP a kol. (Listopad 1999). "Sdružení terminální deoxynukleotidyltransferázy s Ku". Sborník Národní akademie věd Spojených států amerických. 96 (24): 13926–31. Bibcode:1999PNAS ... 9613926M. doi:10.1073 / pnas.96.24.13926. PMC 24167. PMID 10570175.
- Ibe S, Fujita K, Toyomoto T, Shimazaki N, Kaneko R, Tanabe A a kol. (Září 2001). „Terminální deoxynukleotidyltransferáza je negativně regulována přímou interakcí s nukleárním antigenem proliferujících buněk“. Geny do buněk. 6 (9): 815–24. doi:10.1046 / j.1365-2443.2001.00460.x. PMID 11554927. S2CID 19287230.
externí odkazy
- Terminál + deoxyribonukleotidyltransferáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)





