Fosforibosylglycinamid formyltransferáza - Phosphoribosylglycinamide formyltransferase - Wikipedia
| Fosforibosylglycinamid formyltransferáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
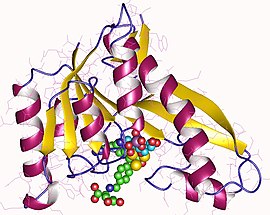 Monomer formyltransferázy GAR, člověk | |||||||||
| Identifikátory | |||||||||
| EC číslo | 2.1.2.2 | ||||||||
| Číslo CAS | 2604945 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Fosforibosylglycinamid formyltransferáza (ES 2.1.2.2, 2-amino-N-ribosylacetamid 5'-fosfát transformyláza, GAR formyltransferáza, GAR transformyláza, glycinamid ribonukleotid transformyláza, GAR TFase, 5,10-methenyltetrahydrofolát: 2-amino-N-ribosylacetamid ribonukleotid transformyláza) je enzym s systematické jméno 10-formyltetrahydrofolát: 5'-fosforibosylglycinamid N-formyltransferáza.[1][2][3] Tento enzym katalýzy následující chemická reakce
- 10-formyltetrahydrofolát + N1- (5-fosfo-D-ribosyl) glycinamid tetrahydrofolát + N2-formyl-N1- (5-fosfo-D-ribosyl) glycinamid

Tento enzym závislý na THF katalyzuje nukleofilní acylovou substituci formylové skupiny z 10-formyltetrahydrofolátu (fTHF) na N1- (5-fosfo-D-ribosyl) glycinamid (GAR) za vzniku N2-formyl-N1- (5-fosfo-D-ribosyl) glycinamid (fGAR), jak je uvedeno výše.[4] Tato reakce hraje důležitou roli při tvorbě purinu prostřednictvím de novo biosyntéza purinu cesta. Tato cesta vytváří inosin monofosfát (IMP), předchůdce adenosinmonofosfát (AMP) a guanosinmonofosfát (GMP). AMP je stavebním kamenem pro důležité nosiče energie, jako je ATP, NAD+ a FAD a signální molekuly, jako je tábor. Role GARTfase v de novo biosyntéza purinu z něj dělá cíl pro protinádorová léčiva[5] a jeho nadměrná exprese během postnatálního vývoje byla spojena s Downův syndrom.[6] Existují dva známé typy genů kódujících GAR transformylázu v E. coli: purN a purT, zatímco u lidí se nachází pouze purN.[7] Mnoho zbytků v aktivním místě je konzervováno napříč bakteriálními, kvasinkovými, ptačími a lidskými enzymy.[8]
Struktura enzymu
U lidí je GARTfase součástí trifunkční enzym který také zahrnuje glycinamid ribnukleotid syntázu (GARS ) a aminoimidazol ribonukleotid syntetáza (VZDUCHY ). Tento protein (110 kDa) katalyzuje kroky 2, 3 a 5 biosyntézy purinu de novo. Blízkost těchto enzymových jednotek a flexibilita proteinu slouží ke zvýšení propustnosti dráhy. GARTfáza je umístěna na C-terminálním konci proteinu.[10]
Lidská GARTfáze byla krystalizována metodou sedací kapky s difúzí par a zobrazena na Stanfordská synchrotronová radiační laboratoř (SSRL) nejméně dvěma skupinami.[5][11]
Struktura může být popsána dvěma subdoménami, které jsou spojeny sedmivláknovou beta fólií. N-terminální doména se skládá z mononukleotidového záhybu typu Rossman, se čtyřvláknovou částí beta listu obklopenou na každé straně dvěma alfa šroubovicemi. Beta vrstva pokračuje do C terminální domény, kde je na jedné straně pokryta dlouhou alfa šroubovicí a na druhé je částečně vystavena rozpouštědlu. Je to rozštěp mezi dvěma subdoménami, kde leží aktivní místo.[8]
Rozštěp se skládá z vazebného místa GAR a kapsy pro vazbu folátu. Folát vázající kapsa je vymezena rozštěpem vázajícím pteridin, oblastí přenosu formylů a oblastí benzoylglutamátu, které vážou hlavu pteridinu, a ocasem benzoylglutamátu spojeným dusíkem fTHF vázaným na formyl. Tato oblast vázající folát byla předmětem mnoha výzkumů, protože její inhibice malými molekulami vedla k objevu antineoplastických léčiv. Ukázalo se, že smyčka vázající folát mění konformaci v závislosti na pH roztoku a jako taková vykazuje lidská GAR transformyláza nejvyšší aktivitu kolem pH 7,5-8. Podmínky nižšího pH (~ 4,2) mění také konformaci vazebných smyček substrátu (GAR).[11]
Mechanismus
Mechanismus purN GARTfase

Klein et al nejprve navrhli mechanismus podporovaný molekulou vody. Jedna molekula vody případně udržovaná na místě vodíkovou vazbou s karboxylátovou skupinou perzistentního zbytku Asp144 přenáší protony z GAR-N na THF-N. Nukleofilní dusík na terminální aminoskupině GAR útočí na karbonylový uhlík formylové skupiny na THF a tlačí negativní náboj na kyslík. Klein naznačuje, že His108 stabilizuje přechodový stav vodíkovou vazbou se záporně nabitým kyslíkem a že reformace karbonylové dvojné vazby vede k rozbití THF-N-formyl vazby. Výpočty Qiao et al naznačují, že postupný protonový přenos vody z Gar-N na THF-N je o 80-100 kj / mol příznivější než společný přenos navrhovaný Kleinem. Zobrazený mechanismus navrhuje Qiao a kol., Kteří ve svých výpočtech nepochybně nezohlednili okolní rezidua.[12][13] Velká část časného mapování aktivního místa na GAR TFáze byla stanovena bakteriálním enzymem vzhledem k množství dostupnému z jeho nadměrné exprese v E. coli.[14] Za použití afinitního analogu bromacetyl dideazafolátu James Inglese a kolegové nejprve identifikovali Asp144 jako zbytek aktivního místa pravděpodobně zapojený do mechanismu přenosu formylu.[15]
Mechanismus purT GARTfase
Studie purT varianty GAR transformylázy v E. coli zjistily, že reakce probíhá přes formylfosfátový meziprodukt. Zatímco in vitro reakce může probíhat bez THF, celkově je in vivo reakce stejná.[16]
Zapojení do de novo Biosyntéza purinu
GART katalyzuje třetí krok de novo biosyntéza purinu, tvorba N2-formyl-N1- (5-fosfo-D-ribosyl) glycinamid (fGAR) přidáním formylu k N1- (5-fosfo-D-ribosyl) glycinamid (GAR).[3] V E. coli je enzym purN proteinem 23 kDa[17] ale u lidí je součástí trifunkčního proteinu 110 kDa, který zahrnuje funkce AIRS a GARS.[10] Tento protein katalyzuje tři různé kroky de novo purinová cesta.
Relevance nemoci
Cíl rakoviny
Vzhledem k jejich zvýšené rychlosti růstu a metabolickým požadavkům se rakovinové buňky spoléhají de novo biosyntéza nukleotidů k dosažení nezbytných hladin AMP a GMP.[18] Umět blokovat kterýkoli z kroků de novo purinová dráha by představovala významné snížení růstu nádoru. Byly provedeny studie vazby na substrát[19] a vazebné místo folátu[20] najít inhibitory.
Downův syndrom
GARTfase je podezřelá z souvislosti s Downovým syndromem. Gen kódující lidský trifunkční protein GARS-AIRS-GART se nachází na chromozomu 21q22.1 v kritické oblasti Downova syndromu. Protein je nadměrně exprimován v mozečku během postnatálního vývoje jedinců s Downovým syndromem. Typicky je tento protein nedetekovatelný v mozečku krátce po narození, ale v prenatálním vývoji se vyskytuje ve vysokých úrovních.[6][21]
Viz také
Reference
- ^ Hartman SC, Buchanan JM (červenec 1959). "Biosyntéza purinů. XXVI. Identifikace formyl donorů transformylačních reakcí". The Journal of Biological Chemistry. 234 (7): 1812–6. PMID 13672969.
- ^ Smith GK, Benkovic PA, Benkovic SJ (červenec 1981). „L (-) - 10-formyltetrahydrofolát je kofaktorem glycinamid ribonukleotidové transformylázy z kuřecích jater“. Biochemie. 20 (14): 4034–6. doi:10.1021 / bi00517a013. PMID 7284307.
- ^ A b Warren L, Buchanan JM (prosinec 1957). "Biosyntéza purinů. XIX. 2-Amino-N-ribosylacetamid 5'-fosfát (glycinamid ribotid) transformyláza". The Journal of Biological Chemistry. 229 (2): 613–26. PMID 13502326.
- ^ McMurry, J. a Tadhg, B. The Organic Chemistry of Biological Pathways
- ^ A b Connelly S, DeMartino JK, Boger DL, Wilson IA (červenec 2013). „Biologické a strukturní hodnocení 10R- a 10S-methylthio-DDACTHF odhaluje novou roli síry v inhibici glycinamid ribonukleotidové transformylázy“. Biochemie. 52 (30): 5133–44. doi:10.1021 / bi4005182. PMC 3823235. PMID 23869564.
- ^ A b Banerjee D, Nandagopal K (prosinec 2007). „Potenciální interakce mezi genem GARS-AIRS-GART a transkripčním faktorem CP2 / LBP-1c / LSF u Alzheimerovy choroby související s Downovým syndromem“. Buněčná a molekulární neurobiologie. 27 (8): 1117–26. doi:10.1007 / s10571-007-9217-2. PMID 17902044.
- ^ Nygaard P, Smith JM (červen 1993). „Důkazy o nové glycinamid ribonukleotidové transformyláze v Escherichia coli“. Journal of Bacteriology. 175 (11): 3591–7. doi:10.1128 / jb.175.11.3591-3597.1993. PMC 204760. PMID 8501063.
- ^ A b Chen P, Schulze-Gahmen U, Stura EA, Inglese J, Johnson DL, Marolewski A, Benkovic SJ, Wilson IA (září 1992). "Krystalová struktura glycinamid ribonukleotidové transformylázy z Escherichia coli v rozlišení 3,0 A. Cílový enzym pro chemoterapii". Journal of Molecular Biology. 227 (1): 283–92. doi:10.1016 / 0022-2836 (92) 90698-j. PMID 1522592.
- ^ Zhang, Y., Desharnais, J., Boger, D.L., Wilson, I.A. (2005) „Komplexní struktura lidské GAR Tfázy s kyselinou 10- (trifluoracetyl) -5,10-dideazaacykl-5,6,7,8-tetrahydrofolovou a substrátem beta-GAR.“ Nedokončené. PDB: 1RBY.
- ^ A b Welin M, Grossmann JG, Flodin S, Nyman T, Stenmark P, Trésaugues L, Kotenyova T, Johansson I, Nordlund P, Lehtiö L (listopad 2010). „Strukturální studie trifunkční lidské GART“. Výzkum nukleových kyselin. 38 (20): 7308–19. doi:10.1093 / nar / gkq595. PMC 2978367. PMID 20631005.
- ^ A b Zhang Y, Desharnais J, Greasley SE, Beardsley GP, Boger DL, Wilson IA (prosinec 2002). "Krystalové struktury lidské GAR Tfázy při nízkém a vysokém pH a se substrátem beta-GAR". Biochemie. 41 (48): 14206–15. doi:10,1021 / bi020522m. PMID 12450384.
- ^ Klein C, Chen P, Arevalo JH, Stura EA, Marolewski A, Warren MS, Benkovic SJ, Wilson IA (květen 1995). „Směrem ke konstrukci léku na základě struktury: krystalová struktura komplexu multisubstrátového aduktu glycinamid ribonukleotidové transformylázy při rozlišení 1,96 A“. Journal of Molecular Biology. 249 (1): 153–75. doi:10.1006 / jmbi.1995.0286. PMID 7776369.
- ^ Qiao QA, Jin Y, Yang C, Zhang Z, Wang M (prosinec 2005). „Kvantová chemická studie mechanismu inhibitoru glycinamid ribonukleotidové transformylázy: kyselina 10-formyl-5,8,10-trideazafolová“. Biofyzikální chemie. 118 (2–3): 78–83. doi:10.1016 / j.bpc.2005.07.001. PMID 16198047.
- ^ Inglese J, Johnson DL, Shiau A, Smith JM, Benkovic SJ (únor 1990). "Subklonování, charakterizace a afinitní značení glyceramid ribonukleotidové transformylázy Escherichia coli". Biochemie. 29 (6): 1436–43. doi:10.1021 / bi00458a014. PMID 2185839.
- ^ Inglese J, Smith JM, Benkovic SJ (červenec 1990). "Mapování aktivního místa a místně specifická mutageneze glycinamid ribonukleotidové transformylázy z Escherichia coli". Biochemie. 29 (28): 6678–87. doi:10.1021 / bi00480a018. PMID 2204419.
- ^ Marolewski AE, Mattia KM, Warren MS, Benkovic SJ (červen 1997). „Formylfosfát: navrhovaný meziprodukt v reakci katalyzovaný Escherichia coli PurT GAR transformylázou“. Biochemie. 36 (22): 6709–16. doi:10.1021 / bi962961p. PMID 9184151.
- ^ Nixon AE, Benkovic SJ (květen 2000). „Zlepšení účinnosti formyl přenosu hybridního enzymu GAR transformylázy“. Proteinové inženýrství. 13 (5): 323–7. doi:10.1093 / protein / 13.5.323. PMID 10835105.
- ^ Tong X, Zhao F, Thompson CB (únor 2009). „Molekulární determinanty biosyntézy nukleotidů de novo v rakovinných buňkách“. Aktuální názor na genetiku a vývoj. 19 (1): 32–7. doi:10.1016 / j.gde.2009.01.002. PMC 2707261. PMID 19201187.
- ^ Antle VD, Donat N, Hua M, Liao PL, Vince R, Carperelli CA (říjen 1999). "Substrátová specificita lidské glycinamid ribonukleotidové transformylázy". Archivy biochemie a biofyziky. 370 (2): 231–5. doi:10.1006 / abbi.1999.1428. PMID 10577357.
- ^ Costi MP, Ferrari S (červen 2001). "Aktualizace cílů antifolátových léků". Aktuální drogové cíle. 2 (2): 135–66. doi:10.2174/1389450013348669. PMID 11469716.
- ^ Brodsky G, Barnes T, Bleskan J, Becker L, Cox M, Patterson D (listopad 1997). „Lidský gen GARS-AIRS-GART kóduje dva proteiny, které jsou odlišně exprimovány během vývoje lidského mozku a dočasně nadměrně exprimovány v mozečku jedinců s Downovým syndromem.“. Lidská molekulární genetika. 6 (12): 2043–50. doi:10,1093 / hmg / 6.12.2043. PMID 9328467.
externí odkazy
- Fosforibosylglycinamid + formyltransferáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)

