Vanad hexakarbonyl - Vanadium hexacarbonyl
 | |
| Jména | |
|---|---|
| Název IUPAC hexakarbonylvanad (0) | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| Informační karta ECHA | 100.039.928 |
PubChem CID | |
| UNII | |
| |
| Vlastnosti | |
| C6Ó6PROTI | |
| Molární hmotnost | 219,00 g / mol |
| Vzhled | modrozelené krystaly žluté roztoky |
| Hustota | 1,7 g / cm3 |
| Bod tání | rozkládá se |
| Bod varu | sublimuje při 50 ° C (122 ° F; 323 K) (15 mmHg) |
| nerozpustný | |
| Rozpustnost v jiných rozpouštědlech | 5 g / l hexan; rozpustnější v dichlormethan |
| Struktura | |
| ortorombický | |
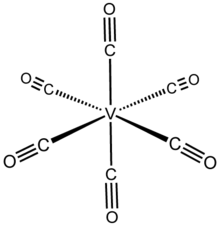
| osmistěn | |
| 0 D | |
| Nebezpečí | |
| Hlavní nebezpečí | Zdroj CO |
| Související sloučeniny | |
Související sloučeniny | Cr (CO)6, VCl3 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Vanad hexakarbonyl je anorganická sloučenina s vzorec V (CO)6. Je to modročerná těkavá látka. Tento vysoce reaktivní druh je z teoretického hlediska pozoruhodný jako vzácný izolát homoleptický kovový karbonyl to je paramagnetické. Většina druhů se vzorcem M.X(CO)y následuj 18-elektronové pravidlo zatímco V (CO)6 má 17 valenčních elektronů.[1]
Syntéza
Tradičně V (CO)6 se připravuje ve dvou krocích prostředníkem V (CO)−
6. V prvním kroku VCI3 se redukuje metalízou sodík pod 200 atm CO při 160 ° C. Rozpouštědlem pro tuto redukci je obvykle diglyme, CH3OCH2CH2OCH2CH2OCH3. Tento triéter solubilizuje sodné soli, podobné chování a korunový ether:
- 4 Na + VCl3 + 6 CO + 2 diglym → [Na (diglym)2] [V (CO)6] + 3 NaCl
Výsledný anion se oxiduje kyselinou:[2]
- 2 V (CO)−
6 + 2 H3PO4 → 2 V (CO)6 + H2 + 2 H
2PO−
4
Reakce
Hexakarbonyl vanadu je tepelně nestabilní. Jeho primární reakcí je redukce na monoanion V (CO)−
6, jejichž soli jsou dobře studovány. Je také náchylný k terciární substituci fosfinové ligandy, často vedoucí k nepřiměřenost.
V (CO)6 reaguje se zdroji cyklopentadienyl anion dát oranžovou komplex čtyřnohých klavírních stoliček (C5H5) V (CO)4 (t.t. 136 ° C). Stejně jako mnoho organokovových sloučenin neutrálních vůči nábojům je i tento polo sendvičový druh těkavý. Při původní přípravě tohoto druhu C.5H5Jako zdroj byl použit HgCl C
5H−
5.
Struktura
V (CO)6 přijímá osmistěn koordinační geometrie a je isostrukturní s chrom hexakarbonyl, i když mají různé valenční počty elektronů. Rentgenová krystalografie s vysokým rozlišením naznačuje, že molekula je mírně zkreslená dvěma (axiální) kratší vzdálenosti V – C 1,993 (2) Å vs. čtyři (rovníkové) 2,005 (2) Å. Přestože V (−I) je větší iont než V (0), vzdálenosti V – C jsou v V (CO)−
6 jsou o 0,07 Å kratší než v neutrálním předchůdci.[3]
Reference
- ^ Elschenbroich, C .; Salzer, A. (1992). Organometallics: Stručný úvod (2. vyd.). Weinheim: Wiley-VCH. ISBN 3-527-28165-7.
- ^ Liu, X .; Ellis, J. E. (2004). "Hexacarbonylvanadate (1−) and Hexacarbonylvanadium (0)". Inorg. Synth. 34: 96–103. doi:10.1002 / 0471653683.ch3. ISBN 0-471-64750-0.
- ^ Bellard, S .; Rubinson, K. A .; Sheldrick, G. M. (1979). "Krystalová a molekulární struktura hexadu karbonylu vanadu". Acta Crystallographica. B35: 271–274. doi:10.1107 / S0567740879003332.
Další čtení
- Originální syntéza: Ercoli, R .; Calderazzo, F .; Alberola, A. (1960). "Syntéza hexadekarbonu vanadu". J. Am. Chem. Soc. 81: 2966–2967. doi:10.1021 / ja01496a073.
