Tetrarhodium dodekakarbonyl - Tetrarhodium dodecacarbonyl
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC tri-μ-karbonyl-1: 2κ2C; 1: 3κ2C; 2: 3κ2C-na-karbonyl-1K2C, 2κ2C, 3κ2C, 4κ3C-[Td- (13) -Δ4-closo]- | |
| Ostatní jména rhodium (0) karbonyl; rhodium karbonyl; rhodium dodekakarbonyl | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.039.232 |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| Rh4(CO)12 | |
| Molární hmotnost | 747 743 g / mol |
| Vzhled | Červené krystaly |
| Rozpustnost | Chlorované uhlovodíky, toluen, tetrahydrofuran |
| Související sloučeniny | |
Související sloučeniny | Chlorid rhodičitý, Rh6(CO)16, Rh2(CO)4Cl2 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Tetrarhodium dodekakarbonyl je chemická sloučenina s vzorec Rh4(CO)12. Tato tmavočervená krystalická pevná látka je nejmenší stabilní binární rhodium karbonyl. Používá se jako katalyzátor v organická syntéza.
Struktura, syntéza, reakce
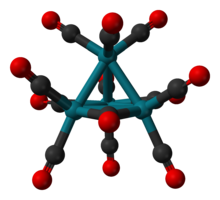
Struktura Rh4(CO)12 je popsána čtyřboká soustava čtyř Rh atomy s devíti koncovými CO ligandy a tři přemostění CO ligandů. Strukturu lze vyjádřit jako Rh4(CO)9(µ-CO)3.[1] Je připraven zpracováním vodného roztoku chloridu rhodia aktivovaným měď kov pod atmosférou CO.[2]
- 4 RhCl3(H2Ó)3 + 8 Cu + 22 CO → Rh4(CO)12 + 2 CO2 + 8 Cu (CO) Cl + 4 HCl + 10 H2Ó
Alternativně lze sloučeninu připravit zpracováním a methanolový řešení RhCl3(H2Ó)3 s CO za vzniku H [RhCl2(CO)2], následovaná karbonylací za přítomnosti citrát sodný.[1]
Klastr prochází tepelně substituce s fosforovými ligandy, L:
- Rh4(CO)12-n + n L → Rh4(CO)12-nLn + n CO
Příbuzné kovové karbonyly
Vzhledem k jejich významu pro hydroformylace katalýza, kovové karbonyly byl systematicky studován ve vysoké míře. Nestabilita Rh2(CO)8 byl zdroj zvědavosti. Analogická binární karbonylová skupina kobaltu, Spol2(CO)8, je známý. Řešení Rh4(CO)12 pod vysokým tlakem CO převést na sloučeninu dirhodia:[3]
- Rh4(CO)12 + 4 CO → 2 Rh2(CO)8
Na rozdíl od Co2(CO)8 který obsahuje přemosťující karbonyly, hlavní izomer Rh2(CO)8 obsahuje pouze terminální CO ligandy. Relativní nestabilita Rh2(CO)8 je obdobou tendence Ru (CO)5 převést na Ru3(CO)12.
Reference
- ^ A b Serp, P .; Kalck, P .; Feurer, R .; Morancho, R. (1998). Marcetta. Y. Darensbourg (ed.). "Tri-u-karbonyl-nonacarbonyltetrarhodium". Anorganické syntézy. Anorganické syntézy. 32: 284–287. doi:10.1002 / 9780470132630.ch45. ISBN 9780470132630.
- ^ S. Martinengo; G. Giordano; P. Chini; G. W. Parshall; E. R Wonchoba (1990). Robert J. Angelico (ed.). "Tri-u-karbonyl-nonacarbonyltetrarhodium". Anorganické syntézy. Anorganické syntézy. 28: 242–245. doi:10.1002 / 9780470132593.ch62. ISBN 9780470132593.
- ^ Brown, D. T .; Eguchi, T .; Heaton, B. T .; Iggo, J. A .; Whyman, R. (1991). „Vysokotlaké spektroskopické studie reakcí klastrů [Rh4(CO)12–X{P (OPh)3}X] (X = 1–4) s oxidem uhelnatým nebo syntézním plynem “. Journal of the Chemical Society, Dalton Transactions: 677–683. doi:10.1039 / DT9910000677.
Obecné čtení
- King, R. B., "Rhodium: Organometallic Chemistry" Encyclopedia of Anorganic Chemistry 1994, 7, 3494.
