Octan rhodičitý - Rhodium(II) acetate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Octan rhodičitý | |
| Ostatní jména Dirhodium tetraacetát, Tetrakis (acetato) dirhodium (II), Dimer diacetátu rhodia, Tetrakis (μ-acetato) dirhodium | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.036.425 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| |
| |
| Vlastnosti | |
| C8H12Ó8Rh2 | |
| Molární hmotnost | 441,99 g / mol |
| Vzhled | Smaragdově zelený prášek |
| Hustota | 1,126 g / cm3 |
| Bod tání | > 100 ° C |
| Bod varu | rozkládá se |
| rozpustný | |
| Rozpustnost v jiných rozpouštědlech | polární organická rozpouštědla |
| Struktura | |
| monoklinický | |
| osmistěn | |
| 0 D | |
| Nebezpečí | |
| Bezpečnostní list | Bezpečnostní list společnosti Coleparmer |
| R-věty (zastaralý) | 36/38 |
| S-věty (zastaralý) | 15, 26, 28A, 37/39 |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | nízká hořlavost |
| Související sloučeniny | |
Související sloučeniny | Octan měďnatý Octan chromitý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Octan rhodičitý je chemická sloučenina s vzorec Rh2(AcO)4, kde AcO− je acetát ion (CH
3CO−
2). Tento tmavě zelený prášek je mírně rozpustný v polárních rozpouštědlech, včetně vody. Používá se jako katalyzátor pro cyklopropanace z alkeny.
Příprava
Octan rhodičitý se obvykle připravuje zahříváním hydratovaný chlorid rhodný v octová kyselina (CH3COOH):[1] Podstupuje dimer octanu rhodného výměna ligandu, nahrazení acetátové skupiny jinými karboxyláty a související skupiny.[2]
- Rh2(OAc)4 + 4 HO2CR → Rh2(Ó2ČR)4 + 4 HOAc
Struktura a vlastnosti
Struktura octanu rhodia obsahuje dvojici rhodium atomy, každý s oktaedrická molekulární geometrie, definovaný čtyřmi atomy kyslíku v acetátu, vodou a vazbou Rh – Rh o délce 2,39A. Voda adukt je vyměnitelná a řada dalších Lewisovy základny navázat na axiální polohy.[3] Octan měďnatý a octan chromitý přijmout podobné struktury.
Chemické vlastnosti
Teyssie a spolupracovníci propagovali aplikaci dirhodium tetraacetátu na organickou syntézu.[4] Rozsáhlá škála reakcí včetně inzerce do vazeb a cyklopropanace z alkeny[5] a aromatický systémy.[6] Selektivně se váže ribonukleosidy (vs. deoxynukleosidy ) selektivní vazbou na ribonukleosidy na jejich 2 'a 3' -ACH skupiny.[7] Dimer octanu rhodného ve srovnání s dimerem octanu rhodnatého octan měďnatý, je reaktivnější a užitečnější při diferenciaci ribonukleosidů a deoxynukleosidů, protože je rozpustný v vodný roztok jako voda, zatímco octan měďnatý se rozpouští pouze v nevodném roztoku.
Vybrané katalytické reakce
Dirhodium tetraacetát se také používá jako katalyzátor pro vložení do vazeb C – H a X – H (X = N, S, O).
- Cyklopropanace

skrz rozklad diazokarbonylových sloučenin, intra- a intermolekulárně cyklopropanace dochází k reakcím.
- Aromatická cykloadice
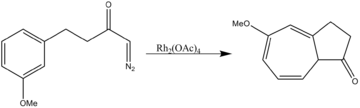
Octan rhodičitý katalyzuje obě dvousložkové látky cykloadice stejně jako třísložkové 1,3-dipolární cykloadice.
- C – H vložení

Rh (II) -katalyzovaný regioselektivní intramolekulární a regiospecifické intermolekulární C – H vložení do alifatický a aromatický Vazby C – H jsou užitečnou metodou pro syntézu nejrůznějších organických sloučenin.
- Oxidace alkoholů

Allylic a benzylová alkoholy byly oxidovány na odpovídající karbonylové sloučeniny za použití tert-butylhydroperoxid v stechiometrický částky a Rh2(OAc)4 jako katalyzátor v dichlormethan při okolní teplotě.
- Vložení X – H (X = N, S, O)
Reference
- ^ Rempel, G. A .; Legzdins, P .; Smith, H .; Wilkinson, G. (1972). Tetrakis (acetato) dirhodium (II) a podobné karboxylátové sloučeniny. Inorg. Synth. Anorganické syntézy. 13. str. 90–91. doi:10.1002 / 9780470132449.ch16. ISBN 9780470132449.
- ^ Doyle, M. P. (2000). „Asymetrická adiční a inzertní reakce katalyticky generovaných kovových karbenů“. V Ojima, Iwao (ed.). Katalytická asymetrická syntéza (2. vyd.). New York: Wiley. ISBN 978-0-471-29805-2.
- ^ Cotton, F. A .; Deboer, B.G .; Laprade, M. D .; Pipal, J. R .; Ucko, D. A. (1971). „Krystaly a molekulární struktury dihydrátu dichromium-tetraacetátu a dihydrátu dirhodium-tetraacetátu“. Acta Crystallogr B. 27 (8): 1664. doi:10.1107 / S0567740871004527.
- ^ Paulissen, R .; Reimlinger, H .; Hayez, E .; Hubert, A. J .; Teyssié, P. (1973). „Reakce diazozloučenin katalyzované přechodným kovem. II: Vložení do hydroxylové vazby“. Tetrahedron Lett. 14 (24): 2233. doi:10.1016 / S0040-4039 (01) 87603-6.
- ^ Hubert, A. J .; Feron, A .; Warin, R .; Teyssie, P. (1976). „Syntéza iminoaziridinů z karbodiimidů a diazoesterů: nový příklad reakcí karbenů katalyzovaných solemi přechodných kovů“. Tetrahedron Lett. 17 (16): 1317. doi:10.1016 / S0040-4039 (00) 78050-6.
- ^ Anciaux, A. J .; Demonceau, A .; Hubert, A. J .; Noels, A. F .; Petiniot, N .; Teyssié, P. (1980). „Katalytická kontrola reakcí dipólů a karbenů; snadná a účinná syntéza cykloheptatrienů z aromatických sloučenin rozšířením Buchnerovy reakce“. J. Chem. Soc., Chem. Commun. (16): 765–766. doi:10.1039 / C39800000765.
- ^ Berger, N. A .; Tarien, E .; Eichhorn, G.L. (1972). „Stereoselektivní diferenciace mezi ribonukleosidy a deoxynukleosidy reakcí s dimerem octanu měďnatého“. Příroda nová biologie. 239 (95): 237–40. doi:10.1038 / newbio239237a0. PMID 4538853.
Acetylhalogenidy a jejich soli acetát ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | On | ||||||||||||||||||
| LiOAc | Být (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | Ahoj | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 ALSOL Al (OAc)2ACH Al2TAK4(OAc)4 | Si | P | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Jako (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Pozn | Mo (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | Cd (OAc)2 | v | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Ta | Ž | Re | Os | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Bi (OAc)3 | Po | Na | Rn | |||
| Fr. | Ra | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La (OAc)3 | Ce (OAc)X | Pr | Nd | Odpoledne | Sm (OAc)3 | EU (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Ho (OAc)3 | Er | Tm | Yb (OAc)3 | Lu (OAc)3 | |||||
| Ac | Čt | Pa | UO2(OAc)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||






