Teriparatid - Teriparatide
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Forteo / Forsteo, Teribone,[1] Bonsity |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a603018 |
| Licenční údaje |
|
| Těhotenství kategorie | |
| Trasy z správa | Podkožní |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Biologická dostupnost | 95% |
| Metabolismus | Játra (nespecifická proteolýza) |
| Odstranění poločas rozpadu | Subkutánně: 1 hodina |
| Vylučování | Ledviny (metabolity) |
| Identifikátory | |
| Číslo CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Informační karta ECHA | 100.168.733 |
| Chemické a fyzikální údaje | |
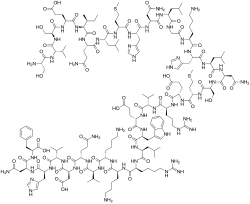
| Vzorec | C181H291N55Ó51S2 |
| Molární hmotnost | 4117.77 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Teriparatid je forma parathormon skládající se z první (N-konec ) 34 aminokyseliny, což je bioaktivní část hormonu. Je to efektivní anabolický (podpora tvorby kostí) agent[3] používané při léčbě některých forem osteoporóza.[4] Také se občas používá mimo označení urychlit hojení zlomenin. Teriparatid je totožný s částí člověka parathormon (PTH) a občasné použití se aktivuje osteoblasty více než osteoklasty, což vede k celkovému zvýšení kostní hmoty.
Rekombinantní teriparatid prodává společnost Eli Lilly and Company pod značkou Forteo / Forsteo. 11. června 2020 zahájila společnost Alvogen, Inc, partner pro komercializaci společnosti Pfenex Inc., injekci teriparatidu (Bonsity) ve Spojených státech. Injekce teriparatidu byla vyvinuta společností Pfenex Inc a schválena USA Úřad pro kontrolu potravin a léčiv (FDA) 4. října 2019.[5] Injekce teriparatidu je farmaceuticky ekvivalentní přípravku Forteo (to znamená, že má stejnou aktivní složku ve stejné síle, dávkové formě a způsobu podání) a bylo prokázáno, že má srovnatelnou biologickou dostupnost. Tyto vlastnosti umožňovaly, aby byl produkt schválen podle 505 (b) (2) NDA, pro kterou byl Forteo referenčním léčivem. Může poskytovat levnější možnost teriparatidu pro zvýšení hustoty kostí u pacientů s vysokým rizikem zlomenin a je schválen FDA pro stejné indikace jako Forteo, což znamená, že může být použit pro stejné pacienty jako Forteo, včetně nových pacientů a ti, kteří v současné době reagují na léčbu.[6]
Teriparatid byl schválen pro lékařské použití v Evropské unii v červnu 2003.[7] Pro marketing v Evropské unii byl povolen syntetický teriparatid od společnosti Teva Generics.[8] Biosimilární produkt od Gedeon Richter plc byl registrován v Evropské unii.[9] 4. října 2019 schválila americká FDA rekombinantní teriparatidový produkt.[5]
V červnu 2020 se Výbor pro humánní léčivé přípravky (CHMP) z Evropská agentura pro léčivé přípravky (EMA) doporučila schválení biologicky podobných produktů Qutavina a Livogiva.[10][11]
Lékařské použití
Je účinný při růstu kostí (např. 8% zvýšení hustoty kostí v páteři po jednom roce)[12] a snížení rizika zlomenin křehkosti.[13][14] Při studiu se teriparatid pouze ukázal kostní minerální hustota (BMD) zlepšení během prvních 18 měsíců používání. Teriparatid by měl být používán pouze po dobu maximálně 2 let. Po 2 letech další agent jako bisfosfonát nebo denosumab by měla být použita v případě osteoporózy.[15]
Teriparatid snižuje riziko zlomeniny kyčle o více než polovinu, ale nesnižuje riziko zlomeniny paže nebo zápěstí.[16]
jiný
Může být použit teriparatid mimo označení urychlit opravu zlomeniny a léčit zlomeninu odbory.[17] Bylo údajně úspěšně použito k hojení zlomenin.[18] Obecně kvůli HIPAA předpisy, není zveřejněno, když američtí sportovci dostávají tuto léčbu ke zlepšení regenerace zlomenin.[17] Ale italský fotbalista, Francesco Totti, dostal teriparatid po a holenní kost /fibula zlomeninu a neočekávaně se vzpamatoval včas Světový pohár 2006.[17] Bylo hlášeno, že Mark Mulder použil ji k zotavení ze zlomeniny kyčle Oakland A's pro 2003 play-off MLB[19] a Terrell Owens zotavit se ze zlomeniny kotníku před 2005 Super Bowl.[19]
Kontraindikace
Teriparatid by neměl být předepisován osobám, které mají zvýšené riziko vzniku osteosarkomu. To zahrnuje i ty s Pagetova nemoc kostí nebo nevysvětlitelné zvýšení alkalického fosfátu v séru, otevřené epifýza nebo předchozí radiační terapie zahrnující kostru. Ve studiích na zvířatech a v jedné případové zprávě u člověka bylo zjištěno, že je potenciálně spojen s rozvojem osteosarkomu u testovaných osob po více než 2 letech užívání.[20]
Pacienti by neměli zahájit léčbu teriparatidem dříve, než začne Vitamín D nedostatek je opraven.[21]
Nepříznivé účinky
Nežádoucí účinky teriparatidu zahrnují bolesti hlavy, nevolnost, závratě a bolesti končetin.[13]Teriparatid má teoretické riziko osteosarkom, který byl nalezen ve studiích na potkanech, ale nebyl potvrzen u lidí.[3] Může to být proto, že na rozdíl od lidí rostou krysí kosti po celý život.[3] Nádory nalezené ve studiích na potkanech byly lokalizovány na konci kostí, které rostly po zahájení injekcí.[21] Po devíti letech na trhu byly hlášeny pouze dva případy osteosarkomu.[12] Toto riziko považovala FDA za „extrémně vzácné“ (1 ze 100 000 lidí)[13] a je jen o málo vyšší než výskyt v populaci starší 60 let (0,4 ze 100 000).[13]
Mechanismus účinku
Teriparatid je část člověka parathormon (PTH), aminokyselinová sekvence 1 až 34, celé molekuly (obsahující 84 aminokyselin). Endogenní PTH je primárním regulátorem metabolismu vápníku a fosfátů v kostech a ledvinách. PTH zvyšuje sérový vápník, čehož částečně dosahuje zvýšením kostní resorpce. Chronicky zvýšený PTH tedy vyčerpá zásoby kostí. Přerušovaná expozice PTH však aktivuje osteoblasty více než osteoklasty. Injekce teriparatidu jednou denně tedy mají čistý účinek stimulace nové tvorby kostí vedoucí ke zvýšené minerální hustotě kostí.[22][23][24]
Teriparatid je první agentura schválená FDA pro léčbu osteoporózy, která stimuluje novou tvorbu kostí.[25]
Schválení FDA
Teriparatid byl schválen USA Úřad pro kontrolu potravin a léčiv (FDA) ze dne 26. Listopadu 2002 k léčbě osteoporóza u mužů a postmenopauzální ženy, u nichž existuje vysoké riziko zlomeniny.[26] Lék je také schválen ke zvýšení kostní hmoty u mužů s primární nebo hypogonadální osteoporózou, u nichž je vysoké riziko zlomenin. Dne 4. října 2019 schválila americká FDA rekombinantní teriparatidový produkt Teriparatide Injection (dříve označovaný jako PF708 a Bonsity) od společnosti Pfenex Inc. Teriparatide Injection je prvním FDA schváleným terapeutickým ekvivalentním kandidátem na přípravek Forteo.
Kombinovaný teriparatid a denosumab
Kombinovaný teriparatid a denosumab zvýšila BMD více než u kteréhokoli z těchto látek samostatně a více, než bylo hlášeno u schválených terapií. Kombinovaná léčba by proto mohla být užitečná k léčbě pacientů s vysokým rizikem zlomenin zvýšením BMD. U pacientů užívajících kombinaci teriparatidu a denosumabu však nejsou žádné důkazy o snížení četnosti zlomenin. První takovou studii publikovali Leder et al. v Lancetu v roce 2013 s dalšími údaji následně publikovanými v JCEM ve studii s postmenopauzálními osteoporotickými ženami, které prokázaly větší zvýšení minerální hustoty kostí v páteři a kyčli při kombinované léčbě ve srovnání s oběma léčivy samotnými.[27][28]
Viz také
Reference
- ^ http://www.minsa.gob.pa/sites/default/files/alertas/nota_seguridad_teriparatida.pdf
- ^ A b „Použití teriparatidu během těhotenství“. Drugs.com. 25. listopadu 2019. Citováno 14. září 2020.
- ^ A b C Riek AE, Towler DA (2011). „Farmakologická léčba osteoporózy“. Missouri Medicine. 108 (2): 118–23. PMC 3597219. PMID 21568234.
- ^ Saag KG, Shane E, Boonen S, Marín F, Donley DW, Taylor KA a kol. (Listopad 2007). „Teriparatid nebo alendronát při osteoporóze vyvolané glukokortikoidy“. The New England Journal of Medicine. 357 (20): 2028–39. doi:10.1056 / NEJMoa071408. PMID 18003959.
- ^ A b „Balíček pro schvalování drog: Bonsity“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 26. února 2020. Citováno 14. září 2020.
- ^ Pfenex Inc (12. června 2020). „Pfenex oznamuje komerční zahájení injekce teriparatidu v USA“. GlobeNewswire News Room.
- ^ „Forsteo EPAR“. Evropská agentura pro léčivé přípravky (EMA). 17. září 2018. Citováno 26. června 2020.
- ^ BfArM (8. 5. 2017). „ZPRÁVA O HODNOCENÍ VEŘEJNOSTI - Decentralizovaný postup - Teriparatid-ratiopharm 20 µg / 80ml, injekční roztok“ (PDF).
- ^ „Souhrn Evropské veřejné zprávy o hodnocení (EPAR) pro přípravek Terrosa“. Citováno 2019-08-14.
- ^ „Qutavina: čeká na rozhodnutí EK“. Evropská agentura pro léčivé přípravky (EMA). 25. června 2020. Citováno 26. června 2020.
- ^ „Livogiva: čeká na rozhodnutí EK“. Evropská agentura pro léčivé přípravky (EMA). 25. června 2020. Citováno 26. června 2020.
- ^ A b Kawai M, Mödder UI, Khosla S, Rosen CJ (únor 2011). „Nové terapeutické příležitosti pro obnovu kostry“. Recenze přírody. Objev drog. 10 (2): 141–56. doi:10.1038 / nrd3299. PMC 3135105. PMID 21283108.
- ^ A b C d Rizzoli R, Reginster JY, Boonen S, Bréart G, Diez-Perez A, Felsenberg D a kol. (Srpen 2011). „Nežádoucí účinky a lékové interakce při léčbě žen s postmenopauzální osteoporózou“. Kalcifikovaná tkáňová mezinárodní. 89 (2): 91–104. doi:10.1007 / s00223-011-9499-8. PMC 3135835. PMID 21637997.
- ^ Murad MH, Drake MT, Mullan RJ, Mauck KF, Stuart LM, Lane MA a kol. (Červen 2012). „Klinický přehled. Srovnávací účinnost léčby drogami k prevenci zlomenin křehkosti: systematický přehled a síťová metaanalýza.“. The Journal of Clinical Endocrinology and Metabolism. 97 (6): 1871–80. doi:10.1210 / jc.2011-3060. PMID 22466336.
- ^ O'Connor KM (červenec 2016). "Hodnocení a léčba osteoporózy". Lékařské kliniky Severní Ameriky. 100 (4): 807–26. doi:10.1016 / j.mcna.2016.03.016. PMID 27235616.
- ^ Díez-Pérez A, Marin F, Eriksen EF, Kendler DL, Krege JH, Delgado-Rodríguez M (březen 2019). „Účinky teriparatidu na zlomeniny kyčle a horní končetiny u pacientů s osteoporózou: systematický přehled a metaanalýza“. Kost. 120: 1–8. doi:10.1016 / j.bone.2018.09.020. PMID 30268814.
- ^ A b C Jancin B (12.12.2011). „Zrychlení hojení zlomenin pomocí teriparatidu“. Digitální síť Zprávy o interním lékařství. Citováno 2013-09-20.
- ^ Giannotti S, Bottai V, Dell'osso G, Pini E, De Paola G, Bugelli G, Guido G (květen 2013). „Současné léčebné strategie týkající se hojení zlomenin“. Klinické případy minerálního a kostního metabolismu. 10 (2): 116–20. PMC 3796998. PMID 24133528.
- ^ A b William L. Carroll (2005). "Kapitola 1: Definice problému". The Juice: Skutečný příběh drogových problémů baseballu. ISBN 1-56663-668-X.
- ^ Harper KD, Krege JH, Marcus R, Mitlak BH (únor 2007). „Osteosarkom a teriparatid?“. Journal of Bone and Mineral Research. 22 (2): 334. doi:10.1359 / jbmr.061111. PMID 17129179. S2CID 36420876.
- ^ A b "Forteo". Druhy.com.
- ^ Bauer W, Aub JC, Albright F (leden 1929). „Studie metabolismu vápníku a fosforu: V. Studie kostních trabekul jako snadno dostupné rezervní zásoby vápníku“. The Journal of Experimental Medicine. 49 (1): 145–62. doi:10.1084 / jem.49.1.145. PMC 2131520. PMID 19869533.
- ^ Selye H (1932). „Na stimulaci tvorby nové kosti extraktem příštítných tělísek a ozářeným ergosterolem“. Endokrinologie. 16 (5): 547–558. doi:10.1210 / endo-16-5-547.
- ^ Dempster DW, Cosman F, Parisien M, Shen V, Lindsay R (prosinec 1993). "Anabolické působení parathormonu na kost". Endokrinní hodnocení. 14 (6): 690–709. doi:10.1210 / edrv-14-6-690. PMID 8119233.
- ^ „Fortéo: injekce teriparatidu (původ rDNA)“. Archivovány od originál dne 2009-12-27.
- ^ „Balíček pro schválení léků: injekce Forteo [teriparatid (původ rDNA)]; NDA # 021318“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 14. září 2020.
- ^ Leder, Benjamin Z .; Tsai, Joy N .; Uihlein, Alexander V .; Burnett-Bowie, Sherri-Ann M .; Zhu, Yuli; Foley, Katelyn; Lee, Hang; Neer, Robert M. (01.05.2014). „Dva roky podávání denosumabu a teriparatidu u postmenopauzálních žen s osteoporózou (studie rozšíření DATA): randomizovaná kontrolovaná studie“. The Journal of Clinical Endocrinology & Metabolism. 99 (5): 1694–1700. doi:10.1210 / jc.2013-4440. ISSN 0021-972X. PMC 4010689. PMID 24517156.
- ^ Tsai, Joy N; Uihlein, Alexander V; Lee, Hang; Kumbhani, Ruchit; Siwila-Sackman, Erica; McKay, Elizabeth A; Burnett-Bowie, Sherri-Ann M; Neer, Robert M; Leder, Benjamin Z (červenec 2013). „Teriparatid a denosumab, samostatně nebo v kombinaci, u žen s postmenopauzální osteoporózou: randomizovaná studie studie DATA“. Lancet. 382 (9886): 50–56. doi:10.1016 / s0140-6736 (13) 60856-9. ISSN 0140-6736. PMC 4083737. PMID 23683600.
externí odkazy
- „Teriparatid“. Informační portál o drogách. Americká národní lékařská knihovna.
- „Kdy použít teriparatid“. Medscape.
