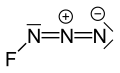Azid fluoru - Fluorine azide
| |||
| Jména | |||
|---|---|---|---|
| Ostatní jména triazadienyl fluorid | |||
| Identifikátory | |||
3D model (JSmol ) | |||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| FN3 | |||
| Molární hmotnost | 61,019 g / mol | ||
| Vzhled | Žlutozelený plyn | ||
| Bod tání | -139 ° C (-218 ° F; 134 K) | ||
| Bod varu | -30 ° C (-22 ° F; 243 K) | ||
| Výbušná data | |||
| Citlivost na nárazy | Extrémní | ||
| Citlivost na tření | Extrémní | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Extrémně citlivá výbušnina | ||
| NFPA 704 (ohnivý diamant) | |||
| Související sloučeniny | |||
jiný kationty | Kyselina hydrazoová Azid chloru | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Azid fluoru nebo triazadienyl fluorid (FN3) je žlutozelený plyn složený z dusík a fluor se vzorcem FN3.[1] Počítá se jako interhalogenová sloučenina, protože azidová funkční skupina se nazývá a pseudohalogen. Připomíná to ClN3, BrN3, a V3 v tomto ohledu.[2] Vazba mezi atomem fluoru a dusíkem je velmi slabá, což vede k tomu, že tato látka je velmi nestabilní a náchylná k výbuchu.[3] Výpočty ukazují, že úhel F – N – N je přibližně 102 ° s přímkou 3 atomů dusíku.[4]
Plyn se vaří při –30 ° C a taje při –139 ° C.[5]
Poprvé ho vyrobil John F. Haller v roce 1942.[6]
Reakce
Azid fluoru lze připravit reakcí kyselina hydrazoová a plynný fluor.[5]
Dalším způsobem, jak to vytvořit, je reakce azid sodný s fluorem.[7]
Azid fluoru se za normálních teplot rozkládá bez exploze dinitrogen difluorid:
- 2 FN3 → N2F2 + 2 N.2.[1]
Při vyšších teplotách, jako je například 1000 ° C, se azid fluoru rozpadá na dusíkatý monofluorid radikální:[7]
- FN3 → FN {a1Δ} + N2.
Pevný nebo kapalný FN3 exploduje a uvolní mnoho tepla. Tenký film hoří rychlostí 1,6 km / s.[8] Protože nebezpečí výbuchu je velké, mělo by se manipulovat pouze s velmi malým množstvím této látky najednou. Pro experimenty se doporučuje limit 0,02 g.[9]
N3F adukty lze vytvořit pomocí Lewisovy kyseliny fluorid boritý (BF3) a pentafluorid arzenitý (AsF5) při -196 ° C. Tyto molekuly se vážou na Nα atom.[10]
Vlastnosti
Spektroskopie
| parametr | hodnota[9] | jednotka |
| A | 48131.448 | MHz |
| B | 5713.266 | MHz |
| C | 5095.276 | MHz |
| μA | 1.1 | |
| μb | 0.7 |
Tvar
Atomy dusíku v této molekule mohou být označeny řeckými písmeny: Nα pro dusík připojený k fluoru, Nβ pro meziprodukt dusík a Ny pro koncový dusík.[10] Koncový dusík může být také označen Nω.[3]
Vzdálenosti mezi atomy jsou F-N 0,1444 nm, FN-NN 0,1253 nm a FNN-N 0,1132 nm.[9]
Fyzický
N3F má hustotu 1,3 g / cm3.[11]
N3F adsorbce na pevné povrchy fluorid draselný, ale ne na fluorid lithný nebo Fluorid sodný. Tato vlastnost byla vyšetřována, takže N3F by mohl zvýšit energii tuhých pohonných hmot.[11]
Ultrafialové fotoelektrické spektrum ukazuje ionizační píky při 11,01, 13,72, 15,6, 15,9, 16,67, 18,2 a 19,7 eV. Příslušně jsou přiřazeny k orbitalům: π, nN nebo nF, nF, πF, nN nebo σ, π a σ.[3]
Reference
- ^ A b Gipstein, Edward; John F. Haller (1966). "Absorpční spektrum azidu fluoru". Aplikovaná spektroskopie. 20 (6): 417–418. Bibcode:1966ApSpe..20..417G. doi:10.1366/000370266774386470. ISSN 0003-7028.
- ^ Saxena, P. B. (01.01.2007). Chemistry of Interhalogen Compounds. Nakladatelství Discovery. str. 96. ISBN 9788183562430. Citováno 16. června 2014.
- ^ A b C Rademacher, Paul; Andreas J. Bittner; Gabriele Schatte; Helge Willner (1988). "Fotoelektronové spektrum a elektronová struktura triazadienylfluoridu, N3F". Chemische Berichte. 121 (3): 555–557. doi:10.1002 / cber.19881210325. ISSN 0009-2940.
- ^ Peters, Nancy J. S .; Leland C. Allen; Raymond A. Firestone (1988). "Azid fluoru a dusičnan fluoru: struktura a vazba". Anorganická chemie. 27 (4): 755–758. doi:10.1021 / ic00277a035. ISSN 0020-1669.
- ^ A b Gholivand, Khodayar; Gabriele Schatte; Helge Willner (1987). "Vlastnosti triazadienylfluoridu, N3F". Anorganická chemie. 26 (13): 2137–2140. doi:10.1021 / ic00260a025. ISSN 0020-1669.
- ^ Lowe, Derek (21. října 2008). „Věci, se kterými nebudu pracovat: Triazadienyl fluorid“. V potrubí. Citováno 15. června 2014.
- ^ A b Benard, D. J .; B. K. Winker; T. A. Seder; R. H. Cohn (1989). "Výroba dusíkatého monofluoridu (a1Δ) disociací azidu fluoru". The Journal of Physical Chemistry. 93 (12): 4790–4796. doi:10.1021 / j100349a022. ISSN 0022-3654.
- ^ Seder, T. A.; D.J. Benard (1991). "Rozklad kondenzovaného fluoru azidu". Spalování a plamen. 85 (3–4): 353–362. doi:10.1016/0010-2180(91)90139-3. ISSN 0010-2180.
- ^ A b C Christen, Dines .; H. G. Mack; G. Schatte; H. Willner (1988). "Struktura triazadienylfluoridu, FN3, mikrovlnnými, infračervenými a ab initio metodami". Journal of the American Chemical Society. 110 (3): 707–712. doi:10.1021 / ja00211a007. ISSN 0002-7863.
- ^ A b Schatte, G .; H. Wllner (1991). „Die Wechselwirkung von N3F mit Lewis-Säuren und HF. N3F als möglicher Vorläufer für die Synthese von N3+ -Salzen = Interakce N3F s Lewisovými kyselinami a HF • N3F jako možný předchůdce syntézy N3+ soli ". Zeitschrift für Naturforschung B (v němčině). 46 (4): 483–489. ISSN 0932-0776.
- ^ A b Brener, Nathan E .; Kestner, Neil R .; Callaway, Joseph (prosinec 1990). Teoretické studie vysoce energetických materiálů CBES: závěrečná zpráva za období od 2. března 1987 do 31. května 1987 (PDF). Louisianská státní univerzita, katedra fyziky a astronomie. 21–27. Citováno 25. června 2014.
externí odkazy
 Média související s Azid fluoru na Wikimedia Commons
Média související s Azid fluoru na Wikimedia Commons
Soli a kovalentní deriváty azid ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HN3 | On | ||||||||||||||||||
| LiN3 | Buďte (N3)2 | B (č3)3 | CH3N3, C (č3)4 | N (N3)3, H2N — N3 | Ó | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Hřích3)4 | P | TAK2(N3)2 | ClN3 | Ar | ||||||||||||
| KN3 | Umět3)2 | Sc (č3)3 | Cín3)4 | VO (č3)3 | Cr (č3)3, CrO2(N3)2 | Mn (č3)2 | Fe (N3)2, Fe (N3)3 | Ošidit3)2, Ošidit3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | Tak jako | Se (N3)4 | BrN3 | Kr | ||
| RbN3 | Sr (N3)2 | Y | Zr (N3)4 | Pozn | Mo | Tc | Běh3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (č3)2 | v | Sn | Sb | Te | V3 | Xe (č3)2 | ||
| CsN3 | Zákaz3)2 | Hf | Ta | Ž | Re | Os | Ir (č3)63− | Pt (č3)62− | Au (N3)4− | Hg2(N3)2, Hg (č3)2 | TlN3 | Pb (č3)2 | Zásobník3)3 | Po | Na | Rn | |||
| Fr. | Běžel3)2 | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Los Angeles | Ce (N3)3, Ce (N3)4 | Pr | Nd | Odpoledne | Sm | Eu | Gd (N3)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Čt | Pa | UO2(N3)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||