Azid bromu - Bromine azide
 | |
| Jména | |
|---|---|
| Název IUPAC Azid bromu | |
| Ostatní jména Nitrid bromu, bromid dusíku, azidobromid | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| BrN3 | |
| Molární hmotnost | 121,924 g / mol |
| Vzhled | Červená tekutina |
| Hustota | N / A |
| Bod tání | -45 stupňů C (-49 ° F) |
| Bod varu | Exploduje |
| Struktura[1] | |
| čtyřúhelníkový | |
| Já4CD | |
Jednotky vzorce (Z) | 16 |
| Nebezpečí | |
| Hlavní nebezpečí | Tohle je jed který může spontánně explodovat.[2] Při kontaktu s arsenem, sodíkem, stříbrnou fólií nebo fosforem exploduje. Má třídu nebezpečnosti 1,1 A. |
| Související sloučeniny | |
Související sloučeniny | Azid fluoru Azid chloru Jodid jódu Kyselina hydrazoová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
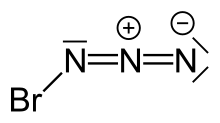
Azid bromu je výbušnina anorganická sloučenina se vzorcem BrN3. Byl popsán jako krystal nebo červená kapalina při pokojové teplotě.[Citace je zapotřebí ] Je extrémně citlivý na malé výkyvy teploty a tlaku, s výbuchy na Δp ≥ 0,05 Torr a také při krystalizaci, proto je při práci s tímto činidlem nutná extrémní opatrnost.
Příprava
Azid bromu lze připravit reakcí azid sodný s Br2. Tato reakce tvoří azid bromu a bromid sodný:[1]
- NaN3 + Br2 → BrN3 + NaBr
Struktura
Vysoká citlivost azidu bromu vedla k obtížím při rozlišování jeho krystalové struktury. Navzdory tomu byla pomocí miniatury získána krystalová struktura azidu bromu zónové tavení postup se zaměřením infračervený laser záření. Na rozdíl od V3, který po krystalizaci tvoří nekonečnou řetězcovitou strukturu, BrN3 tvoří spirálovitou strukturu. Každá molekula přijímá a trans-ohnutý struktura, která se také nachází v plynné fázi.[1]
Reakce
Azid bromnatý se přidává k alkeny oba skrz iontový a přídavek volných radikálů, přičemž každý poskytuje opačnou orientaci ve výrobcích. Nastává iontová adice stereospecificky v trans.[3]S reakcemi zahrnujícími azid bromu je obtížné pracovat. Molekula je velmi reaktivní a je známo, že snadno exploduje. Díky tomu je klíčovým činidlem ve výbušninách.[4] Fotochemie experimenty s azidem bromitým to zjistily UV fotolýza malého vzorku azidu bromu vedlo k disociaci celého vzorku, což způsobilo jeho nestabilitu. Podobné vzorky s azidovými molekulami nevykazovaly takový účinek. To ukazuje nestabilní tendence bromidu azidu v tom, že i za přítomnosti slunečního světla bude azid bromu reaktivní molekulou.[5]
Bezpečnost
Při zacházení s azidem bromným je třeba postupovat velmi opatrně, protože je potenciálně toxický a může za různých podmínek explodovat. Mohou také explodovat koncentrované roztoky v organických rozpouštědlech. Kapalina při kontaktu exploduje arsen, sodík, stříbrná fólie nebo fosfor. Při zahřátí na rozklad vydává vysoce toxické výpary bromu a exploduje. Množství sloučeniny použité během experimentu by mělo být omezeno na 2 mmol. Rovněž představuje potenciální mírné nebezpečí požáru ve formě par chemickou reakcí. Je to také silný oxidant.[1]
Bylo zakázáno přepravovat v EU Spojené státy podle Americké ministerstvo dopravy.
Reference
- ^ A b C d Lyhs, Benjamin; Bläser, Dieter; Wölper, Christoph; Schulz, Stephan; Jansen, Georg (20. února 2012). „Solid-State Structure of Bromine Azide“. Angewandte Chemie International Edition. 51 (8): 1970–1974. doi:10,1002 / anie.201108092. PMID 22250068.
- ^ Patnaik, Pradyot (2007). Komplexní průvodce nebezpečnými vlastnostmi chemických látek. 615: Wiley-Interscience. p. 615. ISBN 0-471-71458-5.CS1 maint: umístění (odkaz)
- ^ Liu, Robert (1968). „2,3-Bis (perfluormethyl) bicyklo2.2.2] okta-2,5,7-trieny a jejich fotorearanžovací reakce“. J. Am. Chem. Soc. 90 (1): 215–216. doi:10.1021 / ja01003a041.
- ^ Perry, Dale L., vyd. (1995). Příručka anorganických sloučenin. Boca Raton: CRC Press. p. 74. ISBN 0-8493-8671-3.
- ^ Henshaw, T. L .; David, S. J .; MacDonald, M. A .; Gilbert, J. V .; Stedman, D. H .; Coombe, R. D. (1987). "Kolizní rozklad azidu bromu". J. Phys. Chem. 91 (9): 2287–2293. doi:10.1021 / j100293a016.
| HN3 | On | ||||||||||||||||||
| LiN3 | Buďte (N3)2 | B (č3)3 | CH3N3, C (č3)4 | N (N3)3, H2N — N3 | Ó | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Hřích3)4 | P | TAK2(N3)2 | ClN3 | Ar | ||||||||||||
| KN3 | Umět3)2 | Sc (č3)3 | Cín3)4 | VO (č3)3 | Cr (č3)3, CrO2(N3)2 | Mn (č3)2 | Fe (N3)2, Fe (N3)3 | Ošidit3)2, Ošidit3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | Tak jako | Se (N3)4 | BrN3 | Kr | ||
| RbN3 | Sr (N3)2 | Y | Zr (N3)4 | Pozn | Mo | Tc | Běh3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (č3)2 | v | Sn | Sb | Te | V3 | Xe (č3)2 | ||
| CsN3 | Zákaz3)2 | Hf | Ta | Ž | Re | Os | Ir (č3)63− | Pt (č3)62− | Au (N3)4− | Hg2(N3)2, Hg (č3)2 | TlN3 | Pb (č3)2 | Zásobník3)3 | Po | Na | Rn | |||
| Fr. | Běžel3)2 | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Los Angeles | Ce (N3)3, Ce (N3)4 | Pr | Nd | Odpoledne | Sm | Eu | Gd (N3)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Čt | Pa | UO2(N3)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||
