Azid cesný - Caesium azide
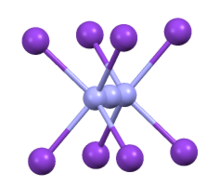 Koordinační sféra azidu v CsN 3 | |
| Jména | |
|---|---|
| Název IUPAC azid cesný | |
| Ostatní jména azid cesný | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.041.072 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti[1] | |
| CsN3 | |
| Molární hmotnost | 174,926 g / mol |
| Vzhled | bezbarvé jehly |
| Hustota | 3,5 g / cm3 |
| Bod tání | 310 ° C (590 ° F; 583 K) |
| 224,2 g / 100 ml (0 ° C) | |
| Struktura[2] | |
| čtyřúhelníkový | |
| I4 / mcm, č. 140 | |
A = 6,5412 Å, C = 8,0908 Å | |
Jednotky vzorce (Z) | 4 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Azid cesný nebo azid cesný je anorganická sloučenina z cesium a azid se vzorcem CsN
3.
Struktura
CsN
3 přijímá stejnou strukturu jako KN
3, RbN
3, a TlN
3, krystalizace v tetragonální zkreslené struktuře chloridu cesného, kde se každý azidový iont koordinuje s osmi kovovými kationty a každý kovový kationtový koordinát s osmi koncovými N centry.[2] Při zahřátí na 151 ° C, přechází do kubické struktury.[3]
Příprava a reakce
Azid cesný lze připravit z neutralizační reakce mezi kyselina hydrazoová a hydroxid cesný:[4]
CsOH + HN
3 → CsN
3 + H
2Ó
Uhličitan česný lze také použít jako základ:
Čs
2CO
3 + HN
3 → CsN
3 + CO
2 + H
2Ó
Tepelný rozklad CsN
3 ve vakuu lze použít jako metodu generování vysoce čistého kovu cesia:[5]
2CsN
3 → 2Cs + 3N
2
Reference
- ^ Perry, Dale L. (18. května 2011). Příručka anorganických sloučenin. CRC Press. p. 110. ISBN 978-1-4398-1461-1.
- ^ A b Müller, Ulrich (1972). „Verfeinerung der Kristallstrukturen von KN3, RbN3, CsN3 und TIN3". Zeitschrift für anorganische und allgemeine Chemie 1972. 392 (2): 159–166. doi:10.1002 / zaac.19723920207.
- ^ McIntyre, J.E. (ed.). Slovník anorganických sloučenin Svazek 3: C46 - Zr. Chapman & Hill. p. 3096. ISBN 0-412-30120-2.
- ^ Steudel, R .; Schenk, P. W. (1975). "Stickstoff". V Brauer, Georg (ed.). Handbuch der Präparativen Anorganischen Chemie, 3. Auflage, pásmo I. p. 458. ISBN 3-432-02328-6.
- ^ Blatter, Fritz; Schumacher, Ernst (15. ledna 1986). "Výroba vysoce čistého cesia". Journal of the Less Common Metals. 115 (2): 307–313. doi:10.1016/0022-5088(86)90153-0.
Soli a kovalentní deriváty azid ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HN3 | On | ||||||||||||||||||
| LiN3 | Buďte (N3)2 | B (č3)3 | CH3N3, C (č3)4 | N (N3)3, H2N — N3 | Ó | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Hřích3)4 | P | TAK2(N3)2 | ClN3 | Ar | ||||||||||||
| KN3 | Umět3)2 | Sc (č3)3 | Cín3)4 | VO (č3)3 | Cr (č3)3, CrO2(N3)2 | Mn (č3)2 | Fe (N3)2, Fe (N3)3 | Ošidit3)2, Ošidit3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | Tak jako | Se (N3)4 | BrN3 | Kr | ||
| RbN3 | Sr (N3)2 | Y | Zr (N3)4 | Pozn | Mo | Tc | Běh3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (č3)2 | v | Sn | Sb | Te | V3 | Xe (č3)2 | ||
| CsN3 | Zákaz3)2 | Hf | Ta | Ž | Re | Os | Ir (č3)63− | Pt (č3)62− | Au (N3)4− | Hg2(N3)2, Hg (č3)2 | TlN3 | Pb (č3)2 | Zásobník3)3 | Po | Na | Rn | |||
| Fr. | Běžel3)2 | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Los Angeles | Ce (N3)3, Ce (N3)4 | Pr | Nd | Odpoledne | Sm | Eu | Gd (N3)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Čt | Pa | UO2(N3)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||
