Azid draselný - Potassium azide
 | |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Azid draselný | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| Informační karta ECHA | 100.039.997 | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| KN 3 | |||
| Molární hmotnost | 81,1184 g / mol | ||
| Vzhled | Bezbarvé krystaly[1] | ||
| Hustota | 2,038 g / cm3 [1] | ||
| Bod tání | 350 ° C (662 ° F; 623 K) (ve vakuu)[1] | ||
| Bod varu | rozkládá se | ||
| 41,4 g / 100 ml (0 ° C) 50,8 g / 100 ml (20 ° C) 105,7 g / 100 ml (100 ° C) | |||
| Rozpustnost | rozpustný v ethanol nerozpustný v éter | ||
| Termochemie | |||
Std entalpie of formace (ΔFH⦵298) | -1,7 kJ / mol | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Vysoce toxický, výbušný při silném zahřátí | ||
| NFPA 704 (ohnivý diamant) | |||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 27 mg / kg (orálně, potkan)[2] | ||
| Související sloučeniny | |||
jiný kationty | Azid sodný, azid měďnatý, azid olovnatý, azid stříbrný | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Azid draselný je anorganická sloučenina mít vzorec KN
3. Je to bílý, ve vodě rozpustný sůl. Používá se jako činidlo v laboratoři.
Bylo zjištěno, že působí jako inhibitor nitrifikace v půdě.[3]
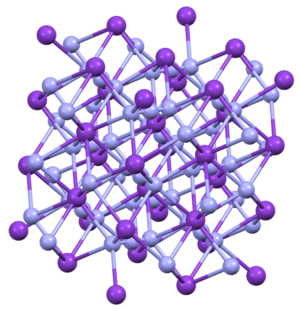
Struktura
KN3, RbN3, CsN3a TlN3 přijmout stejné struktury. Krystalizují v tetragonálním zvyku.[4] Azid je vázán na osm kationů v zatměné orientaci. Kationty jsou vázány na osm terminálních N center.[5]

Syntéza a reakce
KN3 se připravuje zpracováním Uhličitan draselný s kyselina hydrazoová, který je generován in situ.[6] Naproti tomu analogický azid sodný připravuje (průmyslově) „Wislicenus proces, „který probíhá reakcí amidu sodného s oxid dusičitý.[7]
Po zahřátí nebo ozáření ultrafialovým světlem se rozloží na kov draselný a dusík plyn.[8] Teploty rozkladu azidů alkalických kovů jsou: NaN3 (275 ° C), KN3 (355 ° C), RbN3 (395 ° C), CsN3 (390 ° C).[9]
Zdravotní rizika
Jako azid sodný, azid draselný je velmi toxický. The TLV souvisejícího azidu sodného je 0,07 ppm. Toxicita azidů vyplývá z jejich schopnosti inhibovat cytochrom c oxidáza.[7]
Reference
- ^ A b C Dale L. Perry; Sidney L. Phillips (1995). Příručka anorganických sloučenin. CRC Press. str. 301. ISBN 0-8493-8671-3.
- ^ http://chem.sis.nlm.nih.gov/chemidplus/rn/20762-60-1
- ^ T. D. Hughes; L. F. Welch (1970). "Azid draselný jako inhibitor nitrifikace". Agronomy Journal. Americká společnost agronomie. 62: 595–599. doi:10.2134 / agronj1970.00021962006200050013x.
- ^ Khilji, M. Y .; Sherman, W. F .; Wilkinson, G. R. (1982). "Variabilní teplota a tlak Ramanova spektra azidu draselného KN
3". Journal of Raman Spectroscopy. 12 (3): 300–303. Bibcode:1982JRSp ... 12..300K. doi:10.1002 / jrs.1250120319. - ^ Ulrich Müller "Verfeinerung der Kristallstrukturen von KN3, RbN3, CsN3 und TIN3„Zeitschrift für anorganische und allgemeine Chemie 1972, svazek 392, 159–166. doi:10.1002 / zaac.19723920207
- ^ P. W. Schenk „Alkalické azidy z uhličitanů“ v Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. Sv. 1. str. 475.
- ^ A b Horst H. Jobelius, Hans-Dieter Scharff „Kyselina hydrazoová a azidy“ v Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a13_193
- ^ Tompkins, F. C .; Young, D. A. (1982). „Fotochemická a tepelná tvorba barevných center v krystalech azidu draselného“. Sborník královské společnosti v Londýně. Řada A, Matematické a fyzikální vědy. 236 (1204): 10–23.
- ^ E. Dönges „Alkali Metals“ v Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. Sv. 1. str. 475.
Soli a kovalentní deriváty azid ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HN3 | On | ||||||||||||||||||
| LiN3 | Buďte (N3)2 | B (č3)3 | CH3N3, C (č3)4 | N (N3)3, H2N — N3 | Ó | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Hřích3)4 | P | TAK2(N3)2 | ClN3 | Ar | ||||||||||||
| KN3 | Umět3)2 | Sc (č3)3 | Cín3)4 | VO (č3)3 | Cr (č3)3, CrO2(N3)2 | Mn (č3)2 | Fe (N3)2, Fe (N3)3 | Ošidit3)2, Ošidit3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | Tak jako | Se (N3)4 | BrN3 | Kr | ||
| RbN3 | Sr (N3)2 | Y | Zr (N3)4 | Pozn | Mo | Tc | Běh3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (č3)2 | v | Sn | Sb | Te | V3 | Xe (č3)2 | ||
| Čs3 | Zákaz3)2 | Hf | Ta | Ž | Re | Os | Ir (č3)63− | Pt (č3)62− | Au (N3)4− | Hg2(N3)2, Hg (č3)2 | TlN3 | Pb (č3)2 | Zásobník3)3 | Po | Na | Rn | |||
| Fr. | Běžel3)2 | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Los Angeles | Ce (N3)3, Ce (N3)4 | Pr | Nd | Odpoledne | Sm | Eu | Gd (N3)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Čt | Pa | UO2(N3)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||

