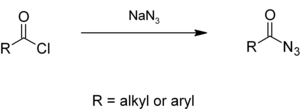Azide - Azide

Azide je anion se vzorcem N−
3. To je konjugovaná báze z kyselina hydrazoová (HN3). N−
3 je lineární aniont, který je izoelektronický s CO2, Poddůstojník−, N2Ó, NE+
2 a NCF. Za teorie valenčních vazeb, azid lze popsat několika rezonanční struktury; důležitá bytost . Azid je také a funkční skupina v organická chemie, RN3.[1]
Dominantní aplikace azidů je jako pohonná hmota v airbagy.
Příprava
Anorganické azidy
Azid sodný se vyrábí průmyslově reakcí oxid dusičitý, N2O s amid sodný v kapalný amoniak jako rozpouštědlo:[2]
- N2O + 2 NaNH2 → NaN3 + NaOH + NH3
Mnoho anorganických azidů lze připravit přímo nebo nepřímo z azidu sodného. Například, azid olovnatý, použito v rozbušky, lze připravit z reakce metateze mezi dusičnan olovnatý a azid sodný. Alternativní cestou je přímá reakce kovu s azid stříbrný rozpuštěný v kapalném amoniaku.[3] Některé azidy se vyrábějí zpracováním uhličitanových solí kyselina hydrazoová.

Organické azidy
Hlavním zdrojem azidové skupiny je azid sodný. Jako pseudohalogen sloučenina, azid sodný obecně vytěsňuje vhodnou odstupující skupinu (např. Br, I, OT) za vzniku azido sloučeniny. Arylazidy mohou být připraveny vytěsněním vhodné diazoniové soli azidem sodným nebo trimethylsilylazid; nukleofilní aromatická substituce je také možné, dokonce is chloridy. Aniliny a aromatické hydraziny podléhají diazotace, stejně jako alkylaminy a hydraziny.[1]
Vhodně funkcionalizované alifatické sloučeniny podléhají nukleofilní substituci azidem sodným. Alifatické alkoholy poskytují azidy prostřednictvím varianty Mitsunobuova reakce, s použitím kyselina hydrazoová.[1] Hydraziny mohou také tvořit azidy reakcí s dusitan sodný:[5]
- PhNHNH2 + NaNO2 → PhN3
Alkyl nebo aryl acylchloridy reagovat s azid sodný ve vodném roztoku acylazidy,[6][7] které dávají isokyanáty v Curtius přesmyk.
Azotransferové sloučeniny, trifluormethansulfonylazid a imidazol-1-sulfonylazid, jsou připraveny také z azidu sodného. Reagují s aminy za vzniku odpovídajících azidů:
- RNH2 → RN3
Dutt – Wormallova reakce
Klasickou metodou pro syntézu azidů je Dutt – Wormallova reakce[8] ve kterém a diazoniová sůl reaguje s a sulfonamid nejprve na diazoaminosulfinát a potom dále hydrolýza azid a a kyselina sírová.[9]
Reakce
Anorganické azidy
Azidové soli se mohou rozkládat s uvolňováním plynného dusíku. Teploty rozkladu azidů alkalických kovů jsou: NaN3 (275 ° C), KN3 (355 ° C), RbN3 (395 ° C) a CsN3 (390 ° C). Tato metoda se používá k výrobě ultračistých alkalických kovů.[10]
Protonace azidových solí je toxická kyselina hydrazoová v přítomnosti silných kyselin:
- H+ + N−
3 → HN3
Azidové soli mohou reagovat s těžkými kovy nebo sloučeninami těžkých kovů za vzniku odpovídajících azidů, které jsou citlivější na nárazy než samotný azid sodný. Po okyselení se rozloží dusitanem sodným. Jedná se o způsob ničení zbytkových azidů před likvidací.[11]
- 2 NaN3 + 2 HNO2 → 3 s2 + 2 NO + 2 NaOH
Bylo popsáno mnoho anorganických kovalentních azidů (např. Chlor, brom a jod azidy).[12]
Azidový anion se chová jako nukleofil; podstoupí to nukleofilní substituce pro alifatické i aromatické systémy. Reaguje s epoxidy a způsobuje otevření kruhu; prochází jako Michael konjugovaný přídavek na 1,4-nenasycené karbonylové sloučeniny.[1]
Azidy lze použít jako prekurzory komplexy kovových nitridů indukcí uvolňování N2, generující kovový komplex v neobvyklých oxidačních stavech (viz vysoce valentní železo ).
Organické azidy
Organické azidy jsou užitečné organické reakce. Koncový dusík je mírně nukleofilní. Azidy snadno vytlačují diatomic dusík, tendence, která je využívána v mnoha reakcích, jako je Staudingerova ligace nebo Curtius přesmyk nebo například při syntéze y-imino-p-enaminoesterů.[13][14]
Azidy mohou být sníženy na aminy podle hydrogenolýza[15] nebo s fosfinem (např. trifenylfosfin ) v Staudingerova reakce. Tato reakce umožňuje, aby azidy sloužily jako chráněný -NH2 synthons, jak dokládá syntéza 1,1,1 -tris (aminomethyl) ethan:
- 3 H2 + CH3C (CH2N3)3 → CH3C (CH2NH2)3 + 3 N.2
V azidalkýn Huisgen cykloadice, organické azidy reagují jako 1,3-dipóly, reagující s alkyny dát substituovaný 1,2,3-triazoly.
Další pravidelný azid je tosylazid zde v reakci s norbornadiene při reakci s vložením dusíku:[16]
Aplikace
Ročně se vyrobí asi 250 tun sloučenin obsahujících azid, přičemž hlavním produktem je azid sodný.[17]
Rozbušky a pohonné hmoty
Azid sodný je hnací látka v automobilu airbagy. Rozkládá se při zahřátí na plynný dusík, který se používá k rychlému rozšíření airbagu:[17]
- 2 NaN3 → 2 Na + 3 N2
Soli těžkých kovů, jako např azid olovnatý, Pb (č3)2, jsou rozbušky citlivé na nárazy, které se rozkládají na odpovídající kov a dusík, například:[18]
- Pb (č3)2 → Pb + 3 N.2
Podobně se používají soli stříbra a barya. Některé organické azidy jsou potenciální raketová paliva, příkladem je 2-dimethylaminoethylazid (DMAZ).
jiný
Kvůli rizikům spojeným s jejich použitím se komerčně používá několik azidů, i když pro výzkumníky vykazují zajímavou reaktivitu. Nízký molekulární váha azidy jsou považovány za zvláště nebezpečné a je jim zabráněno. Ve výzkumné laboratoři jsou azidy prekurzory aminy. Jsou také populární pro svou účast na „reakce kliknutí „a dovnitř Staudingerova ligace. Tyto dvě reakce jsou obecně docela spolehlivé kombinatorická chemie.
Antivirotikum zidovudin (AZT) obsahuje azidovou skupinu. Některé azidy jsou cenné jako bioorthogonální chemické reportéry.
Bezpečnost
- Azidy jsou výbušniny a toxiny.
- Azid sodný je toxický (při orálním podání LD50 27 mg / kg u potkanů) a může být absorbován kůží. Při zahřátí na více než 275 ° C se výbušně rozloží a prudce reaguje s CS2, bróm, kyselina dusičná, dimethylsulfát a řada těžkých kovů, včetně měď a Vést. V reakci s Bronstedovy kyseliny vysoce toxická výbušnina azid vodíku je vydáno.
- Těžký kov azidy, jako např azid olovnatý jsou hlavní vysoce výbušniny detonable při zahřátí nebo otřesu. Azidy těžkých kovů se tvoří, když roztoky azidu sodného nebo HN3 páry přicházejí do styku s těžkými kovy nebo jejich solemi. Azidy těžkých kovů se mohou hromadit za určitých okolností, například v kovových potrubích a na kovových součástech různých zařízení (rotační výparníky, vymrazování zařízení, chladicí pasti, vodní lázně, odpadní potrubí), a tím vést k prudkým výbuchům.
- Některé organické a jiné kovalentní azidy jsou klasifikovány jako vysoce výbušné a toxické: anorganické azidy jako neurotoxiny; azidové ionty jako cytochrom c oxidáza inhibitory.
- Bylo popsáno, že azid sodný a azidová činidla vázaná na polymer reagují s di- a trihalomethany za vzniku di- a triazidomethanu, které jsou nestabilní, aniž by se s nimi zacházelo v roztocích. Během koncentrace reakčních směsí v rotačních odpařovácích byly hlášeny různé výbuchy. Nebezpečí diazidomethanu (a triazidomethanu) jsou dobře zdokumentována.[19][20]
- Pevné halogenidové azidy jsou velmi výbušné a neměly by se připravovat bez přítomnosti rozpouštědla.[21]
Viz také
Reference
- ^ A b C d S. Bräse; C. Gil; K. Knepper; V. Zimmermann (2005). "Organické azidy: explodující rozmanitost jedinečné třídy sloučenin". Angewandte Chemie International Edition. 44 (33): 5188–5240. doi:10.1002 / anie.200400657. PMID 16100733.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. str. 433. ISBN 978-0-08-037941-8.
- ^ Müller, Thomas G .; Karau, Friedrich; Schnick, Wolfgang; Kraus, Florian (2014). „Nová cesta k azidům kovů“. Angewandte Chemie. 53 (50): 13695–13697. doi:10,1002 / anie.201404561.
- ^ I. Bernal, J. Cetrullo, W. G. Jackson (1993). „Fenomén krystalizace konglomerátu v koordinačních sloučeninách. XXIII: Krystalizační chování [cis-Co (en)2(N3)(TAK3)] · 2H2O (I) a [cis-Co (en)2(NE2)(TAK3)] · H2O (II) ". Struct.Chem. 4: 235. doi:10.1007 / BF00673698.CS1 maint: používá parametr autoři (odkaz)
- ^ R. O. Lindsay; C. F. H. Allen (1955). "Fenylazid". Organické syntézy.; Kolektivní objem, 3, str. 710
- ^ C. F. H. Allen; Alan Bell. "Undecyl isokyanát". Organické syntézy.; Kolektivní objem, 3, str. 846
- ^ Jon Munch-Petersen (1963). "m-Nitrobenzazid ". Organické syntézy.; Kolektivní objem, 4, str. 715
- ^ Pavitra Kumar Dutt; Hugh Robinson Whitehead a Arthur Wormall (1921). „CCXLI. — Působení diazosoli na aromatické sulfonamidy. Část I“. J. Chem. Soc., Trans. 119: 2088–2094. doi:10.1039 / CT9211902088.
- ^ Název Reakce: Sbírka podrobných reakčních mechanismů Autor: Jie Jack Li Publikováno 2003 Springer ISBN 3-540-40203-9
- ^ E. Dönges „Alkali Metals“ v Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. Sv. 1. str. 475.
- ^ Výbor pro obezřetné postupy při zacházení, skladování a likvidaci chemických látek v laboratořích, Výbor pro chemické vědy a technologie, Komise pro fyzikální vědy, matematiku a aplikace, Národní rada pro výzkum (1995). Obezřetné postupy v laboratoři: manipulace a likvidace chemikálií. Washington DC.: Press National Academy. ISBN 0-309-05229-7.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ I. C. Tornieporth-Oetting & T. M. Klapötke (1995). "Kovalentní anorganické azidy". Angewandte Chemie International Edition v angličtině. 34 (5): 511–520. doi:10.1002 / anie.199505111.
- ^ Mangelinckx, S .; Van Vooren, P .; De Clerck, D .; Fülöp, F .; De Kimpea, N. (2006). „Efektivní syntéza γ-imino- a γ-amino-β-enaminoesterů“. Arkivoc (iii): 202–209.
- ^ Reakční podmínky: a) azid sodný 4 ekv., aceton, 18 hodin reflux 92% chemický výtěžek b) isopropylamin, chlorid titaničitý, diethylether 14 h reflux 83% výtěžek. Azide 2 se tvoří v a nukleofilní alifatická substituce reakce vytěsňující chlór v 1 azidovým aniontem. The keton reaguje s amin do já těžím který tautomerizuje do enamin v 4. V dalším přesmyková reakce dusík je vyloučen a proton přenesen do 6. Posledním krokem je další tautomerizace s tvorbou enaminu 7 jako směs cis a trans izomery
- ^ https://www.organic-chemistry.org/synthesis/N1H/reductionsazides.shtm
- ^ Damon D. Reed a Stephen C. Bergmeier (2007). "Facile Syntéza polyhydroxylovaného 2-azabicyklo [3.2.1] oktanu". J. Org. Chem. 72 (3): 1024–6. doi:10.1021 / jo0619231. PMID 17253828.
- ^ A b Horst H. Jobelius, Hans-Dieter Scharff „Kyselina hydrazoová a azidy“ v Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a13_193
- ^ Shriver a Atkins. Anorganická chemie (páté vydání). W. H. Freeman and Company, New York, str. 382.
- ^ Alfred S. Hassner (1986). "Syntéza alkyl azidů s polymerním činidlem". Angewandte Chemie International Edition v angličtině. 25 (5): 478–479. doi:10,1002 / anie.198604781.
- ^ A. Hassner; M. Stern; H. E. Gottlieb; F. Frolow (1990). "Syntetické metody. 33. Využití polymerního azidového činidla při tvorbě di- a triazidomethanu. Jejich NMR spektra a rentgenová struktura odvozených triazolů." J. Org. Chem. 55 (8): 2304–2306. doi:10.1021 / jo00295a014.
- ^ L. Marinescu; J. Thinggaard; I. B. Thomsen; M. Bols (2003). "Radikální azidonace aldehydů". J. Org. Chem. 68 (24): 9453–9455. doi:10.1021 / jo035163v. PMID 14629171.
externí odkazy
Soli a kovalentní deriváty azid ion | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HN3 | On | ||||||||||||||||||
| LiN3 | Buďte (N3)2 | B (č3)3 | CH3N3, C (č3)4 | N (N3)3, H2N — N3 | Ó | FN3 | Ne | ||||||||||||
| NaN3 | Mg (N3)2 | Al (N3)3 | Hřích3)4 | P | TAK2(N3)2 | ClN3 | Ar | ||||||||||||
| KN3 | Umět3)2 | Sc (č3)3 | Cín3)4 | VO (č3)3 | Cr (č3)3, CrO2(N3)2 | Mn (č3)2 | Fe (N3)2, Fe (N3)3 | Ošidit3)2, Ošidit3)3 | Ni (N3)2 | CuN3, Cu (N3)2 | Zn (N3)2 | Ga (N3)3 | Ge | Tak jako | Se (N3)4 | BrN3 | Kr | ||
| RbN3 | Sr (N3)2 | Y | Zr (N3)4 | Pozn | Mo | Tc | Běh3)63− | Rh (N3)63− | Pd (N3)2 | AgN3 | Cd (č3)2 | v | Sn | Sb | Te | V3 | Xe (č3)2 | ||
| Čs3 | Zákaz3)2 | Hf | Ta | Ž | Re | Os | Ir (č3)63− | Pt (č3)62− | Au (N3)4− | Hg2(N3)2, Hg (č3)2 | TlN3 | Pb (č3)2 | Zásobník3)3 | Po | Na | Rn | |||
| Fr. | Běžel3)2 | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Los Angeles | Ce (N3)3, Ce (N3)4 | Pr | Nd | Odpoledne | Sm | Eu | Gd (N3)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Čt | Pa | UO2(N3)2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||