Hyponitrit - Hyponitrite
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Hyponitrit | |||
| Systematický název IUPAC Diazenebis (olát) | |||
| Ostatní jména Hyponitrit (2–) | |||
| Identifikátory | |||
3D model (JSmol ) |
| ||
| 3DMet | |||
| ChEBI | |||
| ChemSpider |
| ||
| 130273 | |||
| KEGG | |||
PubChem CID | |||
| |||
| |||
| Vlastnosti | |||
| N 2Ó2− 2 | |||
| Molární hmotnost | 60.012 g · mol−1 | ||
| Konjugovaná kyselina | Kyselina hyponitrous | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
v chemie, hyponitrit může odkazovat na anion N
2Ó2−
2 ([ZAPNUTO = NE])2−), nebo komukoli iontová sloučenina který to obsahuje. v organická chemie, může také odkazovat na skupina −O − N = N − O− nebo jakýkoli organická sloučenina s obecným vzorcem R1−O − N = N − O − R2, kde R1 a R.2 jsou organické skupiny.[1] Na tyto sloučeniny lze pohlížet jako soli a estery resp kyselina hyponitrous H
2N
2Ó
2 nebo HON = NOH.
An kyselý hyponitrit je iontová sloučenina s aniontem HN
2Ó−
2 ([HON = NE])−).
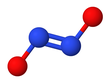
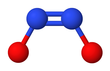
Hyponitritový ion
Hyponitritové exponáty cis – trans izomerismus.[2]
The trans (E) forma se obecně vyskytuje v solích hyponitritů, jako jsou hyponitrit sodný (Na
2N
2Ó
2) a stříbrný (I) hyponitrit (Ag
2N
2Ó
2).
The cis (ZLze získat také formu hyponitritu sodného a je reaktivnější než trans formulář.[2] The cis hyponitritový anion je téměř rovinný a téměř symetrický, s délkami přibližně 140odpoledne pro vazbu N-O a 120 pm pro vazbu N-N a úhly O-N-N asi 119 °.[3]
Reakce
Hyponitritové ionty mohou působit jako bidentate ligand v režimu přemostění nebo chelatace. Existuje přemostění cis-hyponitritová skupina v červené dvoujaderné formě chloridu kobaltnatého nitrosyl pentamminu, [Co (NH3)5NE] Cl2.[4]
Hyponitrit může působit jako redukční činidlo, například redukční jód:[4]
- N
2Ó2−
2 + 3 Já
2 + 3 H
2Ó → NE−
3 + NE−
2 + 6 HI
Estery hyponitritu
Organické trans-hyponitrity R1−O − N = N − O − R2 lze získat reakcí trans stříbrný (I) hyponitrit Ag
2N
2Ó
2 s různými alkylhalogenidy. Například reakce s t-butylchlorid výnosy trans di-tert-butyl hyponitrit.[5][6][7][8]
Mezi další alkylové radikály uváděné v literatuře patří ethyl,[9] a benzyl.[10][11][12] Tyto sloučeniny mohou být zdrojem alkoxylu radikály.[13]
Viz také
- dusičnan, NE−
3 - dusitany, NE−
2 - peroxonitrit, (peroxynitrit), OONO−
- peroxonitrát, HNO−
4 - trioxodinitrát, (hyponitrát), [ZAPNUTO = NE2]2−
- nitroxylát, [O.2N - NE2]4−
- orthonitrate, NE3−
4 - dinitramid, [O.2N − N − NE2]−
- nitrosyl hyponitrite, [ONNONO]−
Reference
- ^ M. N. Hughes (1968), „Hyponitrites“. Quarterly Reviews of the Chemical Society, svazek 22, číslo 1, strany 1–13. doi:10.1039 / QR9682200001.
- ^ A b Egon Wiberg, Arnold Frederick Holleman (2001) Anorganická chemie, Elsevier ISBN 0-12-352651-5
- ^ Claus Feldmann, Martin Jansen (1996), "cis-Sodium Hyponitrite - New Preparative Route and a Crystal Structure Analysis. “Angewandte Chemie International Edition v angličtině, svazek 35, číslo 15, strany 1728–1730. doi:10.1002 / anie.199617281.
- ^ A b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Navamoney Arulsamy; D. Scott Bohle; Jerome A. Imonigie; Elizabeth S. Sagan (2000). "Korelace produktu E/Z Geometrie rámce a O / O vs O / N regioselektivita při dialkylaci hyponitritu ". J. Am. Chem. Soc. 122 (23): 5539–5549. doi:10.1021 / ja994261o.
- ^ H. Kiefer a T. G. Traylor (1966), Tetrahedron Lett., Strana 6163.
- ^ R. L. Huang, T. W. Lee a S. H. Ong (1969), J. Chem. Soc. C, strana 40.
- ^ R. C. Neuman a R. J. Bussey (1970), J. Am. Chem. Soc., Svazek 92, strana 2440.
- ^ J. R. Partington a C. C. Shah (1932), J. Chem. Soc., Strana 2589.
- ^ J. B. Sousa a S. K. Ho (1961), J. Chem. Soc., Strana 1788.
- ^ J. B. Sousa a S. K. Ho (1960), Nature, svazek 186, strana 776.
- ^ N. H. Ray (1960), J. Chem. Soc., Strana 4023.
- ^ Craig A. Ogle; Steven W. Martin; Michael P. Dziobak; Marek W. Urban; G. David Mendenhall (1983). "Rychlost rozkladu, syntéza a spektrální vlastnosti řady alkylhyponitritů". J. Org. Chem. 48 (21): 3728–3733. doi:10.1021 / jo00169a023.