Oxid kobaltnatý (II, III) - Cobalt(II,III) oxide
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC kobalt (II) oxid dikobaltitý | |
| Ostatní jména oxid kobaltu, oxid kobaltu (II, III), oxid kobaltnatý, tetroxid tricobaltový | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.013.780 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Spol3Ó4 CoO.Co2Ó3 | |
| Molární hmotnost | 240,80 g / mol |
| Vzhled | černá pevná látka |
| Hustota | 6,07 g / cm3[2] |
| Bod tání | 895 ° C (1643 ° F; 1168 K) |
| Bod varu | 900 ° C (1650 ° F; 1170 K) (rozkládá se) |
| Nerozpustný | |
| Rozpustnost | rozpustný (s degradací) v kyseliny a zásady |
| +7380·10−6 cm3/ mol | |
| Struktura | |
| krychlový | |
| Fd3m, č. 227[3] | |
| Nebezpečí | |
| Piktogramy GHS |   |
| Signální slovo GHS | Nebezpečí |
| H317, H334, H350, H411 | |
| P261, P273, P284, P304 + 340, P342 + 311 | |
| NFPA 704 (ohnivý diamant) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
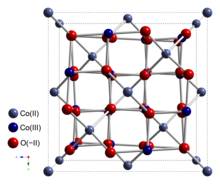
Oxid kobaltnatý (II, III) je anorganická sloučenina s vzorec Spol3Ó4. Je to jeden ze dvou dobře charakterizovaných oxidy kobaltu. Je to černá antiferomagnetický pevný. Jako směsná valenční sloučenina, jeho vzorec je někdy psán jako CoIISpolIII2Ó4 a někdy jako CoO • Co2Ó3.[4]
Struktura
Spol3Ó4 přijímá normální struktura spinelu, s Co.2+ ionty ve čtyřstěnných mezerách a Co3+ ionty v oktaedrických mezerách krychlový zabalený mříž z kysličník anionty.[4]
 | 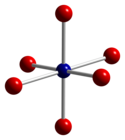 | 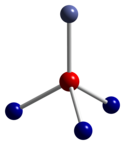 |
| čtyřboká koordinační geometrie Co (II) | zkreslené oktaedrická koordinační geometrie Co (III) | zkreslená čtyřboká koordinační geometrie O |
Syntéza
Oxid kobaltnatý, CoO, převádí na Co3Ó4 při zahřátí na vzduchu asi 600–700 ° C.[4] Při teplotě nad 900 ° C je CoO stabilní.[4][5] Tyto reakce jsou popsány v následující rovnováze:
- 2 spolupracovníci3Ó4 ⇌ 6 CoO + O2
Aplikace
Oxid kobaltu (II, III) se používá jako modré barvivo pro hrnčířství smalt a sklenka, jako alternativa k oxidu kobaltnatému.[6]
U některých se jako elektroda používá oxid kobaltnatý (II, III) lithium-iontové baterie, případně ve formě nanočástice oxidu kobaltu.
Bezpečnost
Sloučeniny kobaltu jsou potenciálně jedovaté ve velkém množství.[7]
Viz také
Reference
- ^ „Oxid kobaltnatý (II, III) 203114“. Sigma-Aldrich.
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87. vydání). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ „mp-18748: Co3O4 (kubický, Fd-3m, 227)“. materialsproject.org. Citováno 2019-12-20.
- ^ A b C d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. p. 1118. ISBN 978-0-08-037941-8.
- ^ Handbook of Preparative Anorganic Chemistry, 2. vyd. Edited by G. Brauer, Academic Press, 1963, NY. p. 1520.
- ^ Frank Hamer, Janet Hamer (2004): Potterův slovník materiálů a technik. University of Pennsylvania Press; 437 stran ISBN 0812238109
- ^ BL[trvalý mrtvý odkaz ]

