Peroxynitrit - Peroxynitrite - Wikipedia
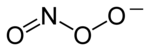 Chemická struktura peroxynitritového aniontu | |
| Jména | |
|---|---|
| Název IUPAC Oxid dusičnan | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| KEGG | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| NÓ3− | |
| Molární hmotnost | 62.005 g · mol−1 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |

Peroxynitrit (někdy nazývané peroxonitrit) je ion se vzorcem ONOO−. Je to nestabilní strukturní izomer z dusičnan, NE−
3. Ačkoli jeho konjugovaná kyselina kyselina peroxynitrous je vysoce reaktivní, peroxynitrit je stabilní v základních roztokech.[1][2] Připravuje se reakcí peroxid vodíku s dusitany:
- H2Ó2 + NE−
2 → ONOO− + H2Ó
Peroxynitrit je oxidant a nitrační činidlo. Díky svým oxidačním vlastnostem může peroxynitrit poškodit širokou škálu molekul buňky, počítaje v to DNA a bílkoviny. Tvorba peroxynitritu in vivo byla připsána reakci volných radikálů superoxid s volnými radikály oxid dusnatý:[3][4]
- Ó•−
2 + NE• → ALE NE−
2
Výsledné spárování těchto dvou volných radikálů vede k peroxynitritu, molekule, která sama o sobě není volným radikálem, ale která je silným oxidantem.
V laboratoři lze připravit roztok peroxynitritu zpracováním okyseleného peroxidu vodíku roztokem dusitanu sodného a následným rychlým přidáním NaOH. Jeho koncentrace je označena absorbance v 302nm (pH 12, ε302 = 1670 M−1 cm−1).[5]
Jako nukleofil
ONOO− reaguje nukleofilně s oxid uhličitý. In vivo, koncentrace oxidu uhličitého je asi 1 mM a jeho reakce s ONOO− dochází rychle. Za fyziologických podmínek tedy reakce ONOO− s oxidem uhličitým nitrosoperoxykarbonát (ONOOCO−
2) je zdaleka převládající cestou pro ONOO−. ONOOCO−
2 homolyzuje za vzniku karbonátového radikálu a oxidu dusičitého, opět jako pár v kleci radikály. Přibližně 66% času se tyto dva radikály rekombinují za vzniku oxidu uhličitého a dusičnanu. Dalších 33% času tyto dva radikály unikají z klece s rozpouštědly a stávají se volnými radikály. Jsou to právě tyto radikály (uhličitanový radikál a oxid dusičitý ), o nichž se předpokládá, že způsobují poškození buněk spojené s peroxynitritem.
Kyselina peroxynitrous
Kyselina peroxynitrous (HNO3) je reaktivní druh obsahující dusík. To je konjugovaná kyselina peroxynitritu. Má to pK.A ~ 6,8.
Viz také
Reference
- ^ Holleman, A. F .; Wiberg, E. Anorganická chemie Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Koppenol, W. H (1998). „Chemie peroxynitritu, biologického toxinu “. Química Nova. 21 (3): 326–331. doi:10.1590 / S0100-40421998000300014.
- ^ Pacher, P; Beckman, J. S; Liaudet, L (2007). "Oxid dusnatý a peroxynitrit ve zdraví a nemoci". Fyziologické recenze. 87 (1): 315–424. doi:10.1152 / physrev.00029.2006. PMC 2248324. PMID 17237348.
- ^ Szabó, C; Ischiropoulos, H; Radi, R (2007). „Peroxynitrite: Biochemie, patofyziologie a vývoj terapeutik“. Recenze přírody Objev drog. 6 (8): 662–80. doi:10.1038 / nrd2222. PMID 17667957.
- ^ Beckman, J. S; Koppenol, W. H (1996). „Oxid dusnatý, superoxid a peroxynitrit: Dobrý, špatný a ošklivý“. American Journal of Physiology. Fyziologie buněk. 271 (5 Pt 1): C1424–37. doi:10.1152 / ajpcell.1996.271.5.C1424. PMID 8944624.
