Oxid skandia - Scandium oxide
 | |
| Jména | |
|---|---|
| Název IUPAC Oxid skandium (III) | |
| Ostatní jména Skandia, oxid skandium | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.031.844 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Sc2Ó3 | |
| Molární hmotnost | 137,910 g / mol |
| Vzhled | bílý prášek |
| Hustota | 3,86 g / cm3 |
| Bod tání | 2,485 ° C (4,505 ° F; 2,758 K) |
| nerozpustný ve vodě | |
| Rozpustnost | rozpustný v horkých kyselinách (reaguje) |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Oxid skandium (III) nebo skandia je anorganická sloučenina se vzorcem Sc2Ó3. Je to jeden z několika oxidy z prvky vzácných zemin s vysokou bod tání. Používá se při přípravě jiných skandium sloučeniny i ve vysokoteplotních systémech (pro svoji odolnost vůči teplu a tepelný šok ), elektronické keramika, a sklenka složení (jako pomocný materiál).
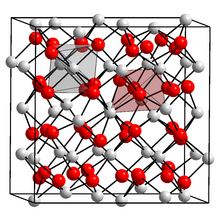
Struktura a fyzikální vlastnosti
Oxid skandia (III) přijímá a krychlový Krystalická struktura (bodová skupina: čtyřboká (T.h), vesmírná skupina: IA3) obsahující 6 souřadnicových kovových center.[1] Prášková difrakce analýza ukazuje vzdálenosti vazby Sc-O 2,159–2,071 Å.[2]
Oxid skandia je izolátor s a mezera v pásmu 6,0 eV.[3]
Výroba
Oxid skandium je primární forma rafinace skandium těžební průmysl. Rudy bohaté na skandium, jako např thortveitite (Sc, Y)2(Si2Ó7) a kolbeckit ScPO4· 2H2O jsou vzácné, avšak stopová množství skandia jsou přítomna v mnoha dalších minerálech. Oxid skandium se proto převážně vyrábí jako vedlejší produkt při extrakci dalších prvků.
Reakce
Oxid skandium je primární forma rafinace skandium produkovaný těžebním průmyslem, což z něj činí výchozí bod pro veškerou chemii skandia.
Oxid skandia reaguje po zahřátí s většinou kyselin, aby vytvořil očekávané množství hydratovaný produkt. Například zahřívání v přebytku ve vodě HCl vyrábí hydratované ScCl3·nH2Ó. Toto lze zbavit bezvodého odpařením do sucha za přítomnosti NH4Cl, přičemž směs se poté čistí odstraněním NH4Cl od sublimace při 300-500 ° C.[4] Přítomnost NH4Cl je vyžadován jako hydratovaný ScCl3·nH2Ó jinak by vznikl smíšený oxychlorid po vysušení.
Podobně se přeměňuje na hydratované skandium (III) triflát (Sc (OTf)3·nH2O) reakcí s kyselina triflová.[5]
Kovové skandium je průmyslově vyráběno snížení oxidu skandia; toto probíhá převodem na skandium fluorid následuje redukce metalízou vápník. Tento proces je v některých ohledech podobný procesu Krollov proces pro výrobu kovů titan.
Oxid skandium tvoří skandátové soli s alkáliemi, na rozdíl od vyšších homologů oxid yttritý a oxid lanthanitý (ale jako oxid lutecia ), například formování K.3Sc (OH)6 s KOH. V tomto vykazuje oxid skandium větší podobnost s oxid hlinitý.
Přirozený výskyt
Přírodní skandál, i když je nečistý, se vyskytuje jako minerál kangit.[6]
Reference
- ^ Wells A.F. (1984) Strukturní anorganická chemie 5. vydání Oxford Science Publications ISBN 0-19-855370-6
- ^ Knop, Osvald; Hartley, Jean M. (15. dubna 1968). "Zpřesnění krystalové struktury oxidu skandia". Canadian Journal of Chemistry. 46 (8): 1446–1450. doi:10.1139 / v68-236.
- ^ Emeline, A. V .; Kataeva, G. V .; Ryabchuk, V. K .; Serpone, N. (1. října 1999). „Fotostimulovaná tvorba defektů a povrchových reakcí na řadě širokopásmových mezer mezi kovy-oxidy“. The Journal of Physical Chemistry B. 103 (43): 9190–9199. doi:10.1021 / jp990664z.
- ^ Stotz, Robert W .; Melson, Gordon A. (1. července 1972). "Příprava a mechanismus tvorby bezvodého chloridu a bromidu skandia (III)". Anorganická chemie. 11 (7): 1720–1721. doi:10.1021 / ic50113a058.
- ^ McCleverty, J.A. a Meyer, T.J., Komplexní koordinační chemie II, 2003, Elsevier Science, ISBN 0-08-043748-6, Sv. 3, s. 99 [„Refluxní oxid skandia s kyselinou triflovou vede k izolaci hydratovaného triflátu skandia“]
- ^ Mindat, http://www.mindat.org/min-42879.html

