Oxid uraničitý - Uranium dioxide
 | |
| Jména | |
|---|---|
| Názvy IUPAC Oxid uraničitý Oxid uraničitý | |
| Ostatní jména Urania Oxid uranu | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.014.273 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| UO2 | |
| Molární hmotnost | 270,03 g / mol |
| Vzhled | Černý prášek |
| Hustota | 10,97 g / cm3 |
| Bod tání | 2,865 ° C (5,189 ° F; 3,138 K) |
| nerozpustný | |
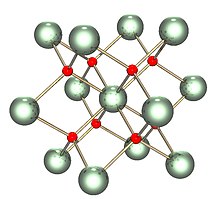
| Struktura | |
| Fluorit (krychlový), cF12 | |
| Fm3m, č. 225 | |
A = 547,1 hod [1] | |
| Čtyřboká (O.2−); kubický (UIV) | |
| Termochemie | |
Std molární entropie (S | 78 J · mol−1· K.−1[2] |
Std entalpie of formace (ΔFH⦵298) | -1084 kJ · mol−1[2] |
| Nebezpečí | |
| Bezpečnostní list | ICSC 1251 |
| Piktogramy GHS |    |
| Signální slovo GHS | Nebezpečí |
| H300, H330, H373, H400, H410, H411 | |
| P260, P264, P270, P271, P273, P284, P301 + 310, P304 + 340, P310, P314, P320, P321, P330, P391, P403 + 233, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | N / A |
| Související sloučeniny | |
| Oxid triuranitý Oxid uranový | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Oxid uraničitý nebo oxid uranitý (UÓ2), také známý jako urania nebo oxid uranový, je kysličník z uran a je černý, radioaktivní, krystalický prášek, který se přirozeně vyskytuje v minerálu uraninit. Používá se v jaderné palivo tyče dovnitř jaderné reaktory. Směs uranu a plutonium dioxidy se používají jako MOX palivo. Před rokem 1960 byl používán jako žlutá a černá barva v keramické glazury a sklo.
Výroba
Oxid uraničitý produkuje snižování oxid uranový s vodík.
- UO3 + H2 → UO2 + H2O při 700 ° C (973 K)
Tato reakce hraje důležitou roli při tvorbě jaderné palivo přes jaderné přepracování a obohacování uranu.
Chemie
Struktura
Pevná látka je izostrukturální s (má stejnou strukturu jako) fluorit (fluorid vápenatý ), kde každé U je obklopeno osmi O nejbližšími sousedy v kubickém uspořádání. Kromě toho dioxidy cer, thorium, plutonium a neptunium mají stejné struktury. Žádné jiné elementární dioxidy nemají fluoritovou strukturu. Po roztavení se naměřená průměrná koordinace U-O sníží z 8 v krystalické pevné látce (UO8 kostky), až 6,7 ± 0,5 (při 3270 K) v tavenině.[3] Modely v souladu s těmito měřeními ukazují, že tavenina sestává hlavně z UO6 a UO7 polyedrické jednotky, kde zhruba2⁄3 spojení mezi mnohostěnem je sdílení rohů a1⁄3 jsou sdílení hran.[3]

Oxid uraničitý

Slinutá peleta z oxidu uraničitého
Oxidace
Oxid uraničitý je oxidovaný v kontaktu s kyslík do triuran oktaoxid.
- 3 UO2 + O.2 → U3Ó8 při 700 ° C (970 K)
The elektrochemie oxidu uraničitého byla podrobně zkoumána jako galvanická koroze oxidu uraničitého řídí rychlost, jakou se používá jaderné palivo rozpouští se. Vidět vyhořelé jaderné palivo pro další detaily. Voda zvyšuje rychlost oxidace plutonium a uran kovy.[4][5]
Karbonizace
Oxid uraničitý je karbonizovaný v kontaktu s uhlík, formování karbid uranu a kysličník uhelnatý.
UO2 + 4 ° C → UC2 + 2 CO
Tento proces musí být proveden v rámci inertní plyn tak jako karbid uranu se snadno oxiduje zpět do oxid uranu.
Použití
Jaderné palivo
UO2 se používá hlavně jako jaderné palivo, konkrétně jako UO2 nebo jako směs UO2 a PuO2 (oxid plutoničitý ) nazývaný směsný oxid (MOX palivo ), ve formě palivové tyče v jaderné reaktory.
Všimněte si, že tepelná vodivost oxidu uraničitého je ve srovnání s uran, nitrid uranu, karbid uranu a zirkonium obkladový materiál. Tato nízká tepelná vodivost může mít za následek lokální přehřátí ve střediscích palivových pelet. Níže uvedený graf ukazuje různé teplotní gradienty v různých palivových sloučeninách. U těchto paliv je tepelná hustota energie stejná a průměr všech pelet stejný.[Citace je zapotřebí ]

Palivová peleta z oxidu uranu

Kontejnery na výchozí materiál pro výrobu pelet na palivo z oxidu uraničitého v závodě v Rusku

Tepelná vodivost kovu zirkonia a oxidu uraničitého jako funkce teploty
Barva pro sklokeramickou glazuru
Oxid uranu (urania) se před druhou světovou válkou používal k barvení skla a keramiky, a dokud nebyly objeveny aplikace radioaktivity, bylo to jeho hlavní použití. V roce 1958 armáda v USA i v Evropě znovu povolila své komerční využití jako ochuzený uran a jeho používání začalo znovu v omezenějším měřítku. Keramické glazury na bázi Urania jsou tmavě zelené nebo černé, když jsou vypalovány v redukci nebo při UO2 se používá; častěji se při oxidaci používá k výrobě jasně žlutých, oranžových a červených glazur.[6] Oranžově zbarvené Fiestaware je známým příkladem produktu s glazurou v uranské barvě. Uranové sklo je světle zelená až žlutá a často má silné fluorescenční vlastnosti. Urania se také používá ve formulacích smalt a porcelán. Je možné určit pomocí a Geigerův počítač pokud glazura nebo sklo vyrobené před rokem 1958 obsahuje uranii.
Jiné použití
Před realizací škodlivosti záření byl uran zahrnut do falešných zubů a zubních náhrad, protože jeho mírná fluorescence způsobovala, že se zubní náhrady v různých světelných podmínkách podobaly spíše skutečným zubům.
Vyčerpaný UO2 (DUO2) lze použít jako materiál pro radiační stínění. Například, DUCRETE je „těžký beton "materiál kde štěrk je nahrazen agregátem oxidu uraničitého; tento materiál je zkoumán pro použití pro sudy pro radioaktivní odpad. Sudy mohou být také vyrobeny z DUO2-ocel cermet, a Kompozitní materiál vyrobeno z agregát oxidu uraničitého sloužícího jako ochrana před zářením, grafit a / nebo karbid křemíku slouží jako neutronové záření absorbér a moderátor a ocel jako matrice, jejíž vysoká tepelná vodivost umožňuje snadné odvádění rozkladného tepla.[Citace je zapotřebí ]
Ochuzený oxid uraničitý lze také použít jako a katalyzátor, např. pro degradaci těkavé organické sloučeniny v plynné fázi, oxidace z metan na methanolu a odstranění síra z ropa. Má vysokou účinnost a dlouhodobou stabilitu při použití ke zničení těkavých organických látek ve srovnání s některými komerčními katalyzátory, jako drahé kovy, TiO2, a Spol3Ó4 katalyzátory. V této oblasti se provádí mnoho výzkumů, DU je zvýhodněný pro uranovou složku kvůli jeho nízké radioaktivitě.[7]
Použití oxidu uraničitého jako materiálu pro nabíjecí baterie je vyšetřován. Baterie mohou mít vysokou kapacitu hustota výkonu a potenciál 4,7 V na buňku. Další vyšetřovaná aplikace je v fotoelektrochemické články pro solární výrobu vodíku, kde UO2 se používá jako fotoanoda. V dřívějších dobách se oxid uraničitý používal také jako tepelný vodič pro omezení proudu (rezistor URDOX), což bylo první využití jeho polovodičových vlastností.[Citace je zapotřebí ]
Oxid uraničitý je také nejsilnějším známým piezomagnetickým v antiferomagnetickém stavu pozorovaným při kryogenních teplotách pod 30 kelvinů. UO2 zobrazuje lineární magnetostrikci, která mění znaménko se znaménkem aplikovaného magnetického pole, a přepínání magnetoelastické paměti na magnetických polích poblíž 180 000 Oe.[8]
Polovodičové vlastnosti
The mezera v pásmu oxidu uraničitého je srovnatelný s obsahem oxidu uraničitého křemík a galium arsenid, v blízkosti optima pro účinnost vs křivka pásma pásma pro absorpci slunečního záření, což naznačuje jeho možné použití pro velmi efektivní solární články na základě Schottkyho dioda struktura; absorbuje také na pěti různých vlnových délkách, včetně infračerveného, což dále zvyšuje jeho účinnost. Jeho vnitřní vodivost při pokojové teplotě je přibližně stejná jako monokrystal křemík.[9]
The dielektrická konstanta oxidu uraničitého je asi 22, což je téměř dvakrát více než u křemíku (11,2) a GaAs (14,1). To je výhoda oproti Si a GaAs při konstrukci integrované obvody, protože může umožňovat integraci vyšší hustoty s vyšší poruchová napětí a s nižší náchylností k CMOS tunelování zhroutit se.
The Seebeckův koeficient oxidu uraničitého při pokojové teplotě je asi 750 µV / K, což je hodnota výrazně vyšší než 270 µV / K telurid thalium (Tl2SnTe5) a thallium germanium telurid (Tl2GeTe5) a vizmut -telur slitiny, jiné materiály slibné pro výroba termoelektrické energie aplikace a Peltierovy prvky.
The radioaktivní rozpad dopad 235U a 238U jeho polovodičových vlastností nebyl měřen od roku 2005[Aktualizace]. Vzhledem k pomalé rychlosti rozpadu těchto izotopů by nemělo významně ovlivňovat vlastnosti solárních článků a termoelektrických zařízení na bázi oxidu uraničitého, ale může se stát důležitým faktorem pro VLSI bramborové hranolky. Použití ochuzený uran oxid je z tohoto důvodu nezbytný. Zachycení alfa částic emitovaných během radioaktivního rozpadu jako atomy helia v krystalové mřížce může také způsobit postupné dlouhodobé změny jeho vlastností.[Citace je zapotřebí ]
The stechiometrie materiálu dramaticky ovlivňuje jeho elektrické vlastnosti. Například elektrická vodivost UO1.994 je řádově nižší při vyšších teplotách než vodivost UO2.001.
Oxid uraničitý, jako U3Ó8, je keramický materiál schopný odolat vysokým teplotám (asi 2300 ° C, ve srovnání s maximálně 200 ° C pro křemík nebo GaAs), takže je vhodný pro vysokoteplotní aplikace, jako jsou termofotovoltaická zařízení.
Oxid uraničitý je také odolný vůči záření poškození, což je užitečné pro rad tvrdě zařízení pro speciální vojenské a letecký a kosmický průmysl aplikace.
A Schottkyho dioda z U3Ó8 a a p-n-p tranzistor UO2 byly úspěšně vyrobeny v laboratoři.[10]
Toxicita
Je známo, že oxid uraničitý je absorbován fagocytóza v plicích.[11]
Viz také
Reference
- ^ Leinders, Gregory; Cardinaels, Thomas; Binnemans, Koen; Verwerft, Marc (2015). „Přesné měření parametrů mřížky stechiometrického oxidu uraničitého“. Journal of Nuclear Materials. 459: 135–42. Bibcode:2015JNuM..459..135L. doi:10.1016 / j.jnucmat.2015.01.029.
- ^ A b Zumdahl, Steven S. (2009). Chemické principy 6. vydání. Společnost Houghton Mifflin. str. A23. ISBN 978-0-618-94690-7.
- ^ A b Skinner, L. B .; Benmore, C. J .; Weber, J. K. R .; Williamson, M. A .; Tamalonis, A .; Hebden, A .; Wiencek, T .; Alderman, O. L. G .; Guthrie, M .; Leibowitz, L .; Parise, J. B. (2014). "Roztavená struktura a dynamika oxidu uraničitého". Věda. 346 (6212): 984–7. Bibcode:2014Sci ... 346..984S. doi:10.1126 / science.1259709. OSTI 1174101. PMID 25414311.
- ^ Haschke, John M; Allen, Thomas H; Morales, Luis A (1999). „Reakce oxidu plutonného s vodou a směsí kyslíku a vodíku: mechanismy koroze uranu a plutonia“ (PDF). Citováno 2009-06-06.
- ^ Haschke, John M; Allen, Thomas H; Morales, Luis A (2001). "Reakce plutonium dioxidu s vodou a směsmi vodíku a kyslíku: Mechanismy pro korozi uranu a plutonia". Journal of Alloys and Compounds. 314 (1–2): 78–91. doi:10.1016 / S0925-8388 (00) 01222-6.
- ^ Örtel, Stefane. Uran in der Keramik. Geschichte - Technik - Hersteller.
- ^ Hutchings, Graham J .; Heneghan, Catherine S .; Hudson, Ian D .; Taylor, Stuart H. (1996). „Katalyzátory na bázi oxidu uranu pro destrukci těkavých chlorovaných organických sloučenin“. Příroda. 384 (6607): 341–3. Bibcode:1996 Natur.384..341H. doi:10.1038 / 384341a0.
- ^ M. Jaime a kol. (2017), Piezomagnetismus a magnetoelastická paměť v oxidu uraničitém. Příroda komunikace 8, 99.
- ^ An, Yong Q .; Taylor, Antoinette J .; Conradson, Steven D .; Trugman, Stuart A .; Durakiewicz, Tomasz; Rodriguez, George (2011). "Ultrarychlá dynamika skákání 5F Elektrony v Mott Insulator UO2 Studováno Femtosekundovou spektroskopií typu Pump-Probe “. Dopisy o fyzické kontrole. 106 (20): 207402. Bibcode:2011PhRvL.106t7402A. doi:10.1103 / PhysRevLett.106.207402. PMID 21668262.
- ^ Pokorný, Thomas T .; von Roedern, B. (2008). "Polovodičová zařízení vyrobená z oxidů aktinidů". Vakuum. 83 (1): 226–8. Bibcode:2008Vacuu..83..226M. doi:10.1016 / j.vacuum.2008.04.005.
- ^ Principy biochemické toxikologie. Timbrell, Johne. PA 2008 ISBN 0-8493-7302-6[stránka potřebná ]
Další čtení
- Barrett, S. A .; Jacobson, A. J .; Tofield, B. C .; Fender, B. E. F. (1982). "Příprava a struktura oxidu barnatého a uranového BaUO3 + x". Acta Crystallographica oddíl B. 38 (11): 2775. doi:10.1107 / S0567740882009935.
externí odkazy
- Polovodičové vlastnosti oxidů uranu
- Výpis slovníku zdarma pro oxid uranový
- The Oxid uraničitý International Bio-Analytical Industries, Inc.







