Oxid arzenitý - Arsenic pentoxide
 | |
| Jména | |
|---|---|
| Ostatní jména Oxid arsenitý (V) Oxid arsenitý Anhydrid arsenu | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.013.743 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 1559 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Tak jako2Ó5 | |
| Molární hmotnost | 229,8402 g / mol |
| Vzhled | bílý hygroskopický prášek |
| Hustota | 4,32 g / cm3 |
| Bod tání | 315 ° C (599 ° F; 588 K) (rozkládá se) |
| 59,5 g / 100 ml (0 ° C) 65,8 g / 100 ml (20 ° C) 8,20 g / 100 ml (100 ° C) | |
| Rozpustnost | rozpustný v alkohol |
| Kyselost (strK.A) | 7 |
| Nebezpečí | |
| Piktogramy GHS |    |
| Signální slovo GHS | Nebezpečí |
| H301, H331, H350, H400, H410 | |
| P201, P202, P261, P264, P270, P271, P273, P281, P301 + 310, P304 + 340, P308 + 313, P311, P321, P330, P391, P403 + 233, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 8 mg / kg (potkan, orálně) |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | TWA 0,010 mg / m3[1] |
REL (Doporučeno) | Ca C 0,002 mg / m3 [15 minut][1] |
IDLH (Okamžité nebezpečí) | Ca [5 mg / m3 (jako As)][1] |
| Související sloučeniny | |
jiný kationty | Oxid fosforečný Oxid antimonitý |
Související sloučeniny | Oxid arsenitý Kyselina arsenová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Oxid arzenitý je anorganická sloučenina se vzorcem As2Ó5.[2] Tento skelný, bílý, rozmělněný pevná látka je relativně nestabilní, což odpovídá vzácnosti oxidačního stavu As (V). Častější a komerčně mnohem důležitější je oxid arzenitý (Tak jako2Ó3). Všechny sloučeniny arsenu jsou vysoce toxické, a proto nacházejí jen omezené komerční využití.
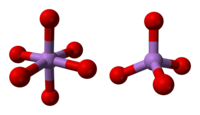
Struktura
Struktura se skládá z čtyřbokého {AsO4} a osmistěn {AsO6} centra propojená sdílením rohů.[3] Struktura se liší od struktury odpovídající oxid fosforečný (V); ve výsledku, i když stále existuje pevný roztok s tímto oxidem, postupuje pouze do ekvimolárního bodu, kdy fosfor nahradil arsen ve všech jeho čtyřboká místech. Podobně se oxid arzenitý může také rozpouštět až do ekvimolárního množství oxid antimonitý, jako náhrada antimonu za arsen pouze v oktaedrických lokalitách.[4]
 |  |  |
Syntéza
Historický
Paracelsus Macquer našel krystalizovatelnou sůl, kterou nazval „sel neutre arsenical“. Tato sůl byla zbytek získaný po destilaci kyselina dusičná ze směsi dusičnan draselný a oxid arzenitý. Dříve Paracelsus zahříval směs oxidu arzenitého a dusičnanu draselného. Na výrobek použil výraz „arsenicum fixum“. A. Libavius stejný produkt nazvaný „butyrum arsenici“ (máslo arsenu), ačkoli se tento výraz ve skutečnosti používal pro chlorid arsenitý. Výrobky, které Paracelsus a Libavius našli, byly všechny nečisté alkalické arzeničnany.[5] Scheele připravil řadu arzeničnanů působením kyseliny arsenové na alkálie. Jedním z arzeničnanů, které připravil, byl oxid arzenitý.[6] Voda v zásadách se odpařila při 180 ° C a oxid arzenitý byl stabilní pod 400 ° C.[5]
Moderní metody
Oxid arzenitý lze krystalizovat zahřátím As2Ó3 pod kyslíkem. Tato reakce je reverzibilní:[3]
- Tak jako2Ó5 ⇌ Jako2Ó3 + O.2
Silný oxidační činidla jako ozón, peroxid vodíku, a kyselina dusičná převést oxid arzenitý na oxid pentoxidový.
Kyselina arsenová může být generována rutinním zpracováním sloučenin arsenu, včetně oxidace arsenu a minerálů obsahujících arsen ve vzduchu. Ilustrativní je pražení nerost, typická ruda sirníku arsenitého:[7]
- 2 As2S3 + 11 O.2 → 2 As2Ó5 + 6 SO2
Bezpečnost
Jako všechny sloučeniny arsenu je i oxid pentoxidový vysoce toxický. Jeho redukovaný derivát arsenit, který je sloučeninou As (III), je ještě toxičtější, protože má vysokou afinitu k thiolovým skupinám cystein zbytky v proteinech.
Je klasifikován jako extrémně nebezpečná látka ve Spojených státech, jak je definováno v oddíle 302 USA Nouzové plánování a zákon o právu na znalost komunity (42 U.S.C. 11002) a podléhá přísným požadavkům na hlášení ze strany zařízení, která je vyrábějí, skladují nebo používají ve významných množstvích.[8]
Reference
- ^ A b C NIOSH Kapesní průvodce chemickými nebezpečími. "#0038". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ A b Martin Jansen (1977). "Krystalová struktura As2Ó5". Angewandte Chemie International Edition v angličtině. 16 (5): 314–315. doi:10,1002 / anie.197703142.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ A b J. W. Mellor. „Komplexní pojednání o anorganické a teoretické chemii“. Archivovány od originál dne 2012-05-11. Citováno 2013-03-30.
- ^ C.W. Zenger; et al. „Arsen 149“. Archivovány od originál dne 4. 4. 2013.
- ^ Grund, S. C .; Hanusch, K .; Wolf, H. U. „Arsen a sloučeniny arsenu“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a03_113.pub2.
- ^ „40 C.F.R .: Dodatek A k části 355 - Seznam extrémně nebezpečných látek a jejich mezní hodnoty pro plánování“ (PDF) (1. července 2008 ed.). Vládní tiskárna. Archivovány od originál (PDF) 25. února 2012. Citováno 29. října 2011. Citovat deník vyžaduje
| deník =(Pomoc)
externí odkazy
- NIOSH Kapesní průvodce chemickými nebezpečími
- Monografie IARC - Arsen a sloučeniny arsenu
- Zpráva NTP o karcinogenech - anorganické sloučeniny arsenu
- ESIS: Evropský informační systém o chemických látkách
- Linstrom, Peter J .; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, Národní institut pro standardy a technologii, Gaithersburg (MD), http://webbook.nist.gov

