Nitrosylazid - Nitrosylazide - Wikipedia
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Vlastnosti | |
| N4Ó | |
| Molární hmotnost | 72.027 g · mol−1 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Nitrosylazid je velmi nestabilní oxid dusíku s chemickým vzorcem N4Ó.
Syntéza
Nitrosylazid lze syntetizovat následující reakcí sloučeniny azid sodný a nitrosylchlorid při nízkých teplotách:
Vlastnosti
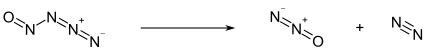
Pod -50 ° C existuje nitrosylazid ve formě světle žluté pevné látky. Nad touto teplotou se rozkládá na oxid dusičitý (N2O) a molekulární dusík (N2):[1]
Charakterizace sloučeniny s IR a Ramanova spektroskopie ukázat absorpční pásma, která dobře odpovídají vypočteným hodnotám pro a trans-struktura.[1][2] Kvantově chemické výpočty ukazují a cis-forma vyšší v energii o 4,2 kJ · mol−1 a forma aromatického kruhu, která je stabilnější vůči 205 kJ · mol−1. Avšak cyklizace do kruhové formy by musela překročit 205 kJ · mol−1 bariéra aktivační energie vyžaduje ohnutí azidové skupiny, což by mohlo vysvětlovat, proč je nitrosylazid dostatečně stabilní, aby mohl být izolován při nízké teplotě.[1]
Reference
- ^ A b C Schulz, Axel; Tornieporth-Oetting, Inis C .; Klapötke, Thomas M. (1993). „Nitrosyl Azide, N4O, jiskrově nestabilní oxid dusíku“. Angewandte Chemie International Edition v angličtině. 32 (11): 1610–1612. doi:10.1002 / anie.199316101. ISSN 0570-0833.
- ^ Lucien, Harold W. (1958). "Příprava a vlastnosti nitrosyl azidu". Journal of the American Chemical Society. 80 (17): 4458–4460. doi:10.1021 / ja01550a004. ISSN 0002-7863.
- Cotton, F. Albert a Geoffrey Wilkinson (1999). Pokročilá anorganická chemie (6. vydání). New York: John Wiley & Sons. str. 331. ISBN 0-471-19957-5.