Vést - Lead - Wikipedia
 | ||||||||||||||||||||||||||
| Vést | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Výslovnost | /ˈlɛd/ | |||||||||||||||||||||||||
| Vzhled | šedá metalíza | |||||||||||||||||||||||||
| Standardní atomová hmotnost Ar, std(Pb) | 207.2(1)[1] | |||||||||||||||||||||||||
| Olovo v periodická tabulka | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Protonové číslo (Z) | 82 | |||||||||||||||||||||||||
| Skupina | skupina 14 (uhlíková skupina) | |||||||||||||||||||||||||
| Doba | období 6 | |||||||||||||||||||||||||
| Blok | p-blok | |||||||||||||||||||||||||
| Kategorie prvku | Jiný kov | |||||||||||||||||||||||||
| Konfigurace elektronů | [Xe ] 4f14 5 d10 6 s2 6p2 | |||||||||||||||||||||||||
| Elektrony na skořápku | 2, 8, 18, 32, 18, 4 | |||||||||||||||||||||||||
| Fyzikální vlastnosti | ||||||||||||||||||||||||||
| Fáze naSTP | pevný | |||||||||||||||||||||||||
| Bod tání | 600.61 K. (327,46 ° C, 621,43 ° F) | |||||||||||||||||||||||||
| Bod varu | 2022 K (1749 ° C, 3180 ° F) | |||||||||||||||||||||||||
| Hustota (ur.t.) | 11,34 g / cm3 | |||||||||||||||||||||||||
| když kapalina (přit.t.) | 10,66 g / cm3 | |||||||||||||||||||||||||
| Teplo fúze | 4.77 kJ / mol | |||||||||||||||||||||||||
| Odpařovací teplo | 179,5 kJ / mol | |||||||||||||||||||||||||
| Molární tepelná kapacita | 26,650 J / (mol · K) | |||||||||||||||||||||||||
Tlak páry
| ||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||
| Oxidační stavy | −4, −2, −1, +1, +2, +3, +4 (anamfoterní kysličník) | |||||||||||||||||||||||||
| Elektronegativita | Paulingova stupnice: 1,87 (+2) | |||||||||||||||||||||||||
| Ionizační energie |
| |||||||||||||||||||||||||
| Atomový poloměr | empirické: 175odpoledne | |||||||||||||||||||||||||
| Kovalentní poloměr | 146 ± 17 hodin | |||||||||||||||||||||||||
| Van der Waalsův poloměr | 202 hodin | |||||||||||||||||||||||||
| Další vlastnosti | ||||||||||||||||||||||||||
| Přirozený výskyt | prvotní | |||||||||||||||||||||||||
| Krystalická struktura | obličejově centrovaný kubický (FCC) | |||||||||||||||||||||||||
| Rychlost zvuku tenká tyč | 1190 m / s (přir.t.) (žíhaný) | |||||||||||||||||||||||||
| Teplotní roztažnost | 28,9 µm / (m · K) (při 25 ° C) | |||||||||||||||||||||||||
| Tepelná vodivost | 35,3 W / (m · K) | |||||||||||||||||||||||||
| Elektrický odpor | 208 nΩ · m (při 20 ° C) | |||||||||||||||||||||||||
| Magnetické objednávání | diamagnetický | |||||||||||||||||||||||||
| Magnetická susceptibilita | −23.0×10−6 cm3/ mol (při 298 K)[2] | |||||||||||||||||||||||||
| Youngův modul | 16 GPa | |||||||||||||||||||||||||
| Tažný modul | 5,6 GPa | |||||||||||||||||||||||||
| Hromadný modul | 46 GPa | |||||||||||||||||||||||||
| Poissonův poměr | 0.44 | |||||||||||||||||||||||||
| Mohsova tvrdost | 1.5 | |||||||||||||||||||||||||
| Brinellova tvrdost | 38–50 MPa | |||||||||||||||||||||||||
| Číslo CAS | 7439-92-1 | |||||||||||||||||||||||||
| Dějiny | ||||||||||||||||||||||||||
| Objev | v střední východ (7000 př ) | |||||||||||||||||||||||||
| Hlavní izotopy olova | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Množství izotopů se velmi liší podle vzorku | ||||||||||||||||||||||||||
Vést je chemický prvek s symbol Pb (z latinský olovo) a protonové číslo 82. Je to těžký kov to je hustší než většina běžných materiálů. Olovo je měkký a tvárný, a také má relativně nízkou hodnotu bod tání. Když je čerstvě řezané, olovo je stříbřité s nádechem modré; to zakalí při vystavení vzduchu matně šedé barvě. Olovo má nejvyšší atomové číslo ze všech stabilní prvek a tři z jeho izotopů jsou koncovými body hlavní jaderné energie rozpadové řetězy těžších prvků.
Olovo je relativně nereaktivní post-přechodový kov. Jeho slabý kovový charakter ilustruje jeho amfoterní Příroda; olovo a oxidy olova reagovat s kyseliny a základny a má tendenci se tvořit kovalentní vazby. Sloučeniny olova se obvykle nacházejí v +2 oxidační stav spíše než +4 stát společný s lehčími členy uhlíková skupina. Výjimky jsou většinou omezeny na organické sloučeniny olova. Stejně jako lehčí členové skupiny má olovo tendenci vazba sama se sebou; může tvořit řetězce a mnohostěnné struktury.
Olovo se z něj snadno extrahuje rudy; prehistoričtí lidé v západní Asii věděl o tom. Galenit je hlavní ruda olova, která často nese stříbrný. Zájem o stříbro pomohl zahájit rozsáhlou těžbu a používání olova v starověký Řím. Produkce olova po roce klesla pád Říma a srovnatelné úrovně dosáhla až do Průmyslová revoluce. V roce 2014 činila roční celosvětová produkce olova přibližně deset milionů tun, z čehož více než polovina pocházela z recyklace. Olovo má vysokou hustotu, nízkou teplotu tání, kujnost a relativní inertnost vůči oxidace aby to bylo užitečné. Tyto vlastnosti v kombinaci s relativním množstvím a nízkými náklady vedly k jeho rozsáhlému použití ve stavebnictví, instalatérské práce, baterie, kulky a výstřel, závaží, pájky, cíny, tavitelné slitiny, bílé barvy, olovnatý benzín, a radiační stínění.
Pozdě 19. století, toxicita olova byl uznán a jeho použití bylo od té doby vyřazeno z mnoha aplikací. Mnoho zemí však stále umožňuje prodej produktů, které vystavují lidi vedoucímu postavení, včetně některých typů barev a střel. Olovo je a neurotoxin který se hromadí v měkkých tkáních a kostech; poškozuje to nervový systém a zasahuje do funkce biologické enzymy, způsobující neurologické poruchy, jako je poškození mozku a problémy s chováním.
Fyzikální vlastnosti
Atomový
Vodítko atom má 82 elektrony, uspořádané v elektronová konfigurace z [Xe ] 4f145 d106 s26p2. Součet prvního a druhého olova ionizační energie - celková energie potřebná k odstranění dvou 6p elektronů - je blízká energii cín, horní soused olova v uhlíková skupina. To je neobvyklé; ionizační energie obecně klesají směrem dolů po skupině, protože vnější elektrony prvku se stávají vzdálenějšími od jádro, a více stíněné menšími orbitály.
Podobnost ionizačních energií je způsobena lanthanoidová kontrakce —Úbytek prvku poloměry z lanthan (atomové číslo 57) až lutetium (71) a relativně malé poloměry prvků z hafnium (72) a dále. To je způsobeno špatným stíněním jádra pomocí lanthanid 4f elektrony. Součet prvních čtyř ionizačních energií olova převyšuje cín,[3] na rozdíl od čeho periodické trendy předpovídá. Relativistické účinky, které se stávají významnými pro těžší atomy, přispívají k tomuto chování.[A] Jedním z takových efektů je efekt inertního páru: 6s elektrony olova se zdráhají účastnit se vazby, čímž se vzdálenost mezi nejbližšími atomy v krystalický vést neobvykle dlouho.[5]
Lehčí uhlíková skupina olova kongenery tvoří stabilní nebo metastabilní allotropes s čtyřboká koordinována a kovalentně vázané diamant krychlový struktura. Energetické úrovně jejich vnější s- a p-orbitaly jsou dostatečně blízko, aby umožnily smíchání do čtyř hybridní sp3 orbitaly. U olova účinek inertního páru zvyšuje oddělení mezi jeho s- a p-orbitalem a mezeru nelze překonat energií, která by byla uvolněna extra vazbami po hybridizaci.[6] Namísto diamantové kubické struktury se tvoří olovo kovové vazby ve kterém jsou delokalizovány a sdíleny pouze P-elektrony mezi Pb2+ ionty. Olovo má následně a obličejově centrovaný kubický struktura[7] jako podobně velké[8] dvojmocný kovy vápník a stroncium.[9][b][C][d]
Hromadně
Čisté olovo má jasný, stříbřitý vzhled s nádechem modré barvy.[14] Zakalí se při kontaktu s vlhkým vzduchem a získá matný vzhled, jehož odstín závisí na převládajících podmínkách. Mezi charakteristické vlastnosti olova patří vysoké hustota, tvárnost, tažnost a vysoká odolnost vůči koroze kvůli pasivace.[15]

Olověná těsně zabalená kubická struktura zaměřená na obličej a vysoká atomová hmotnost mají za následek hustotu[16] 11,34 g / cm3, který je větší než u běžných kovů, jako je žehlička (7,87 g / cm3), měď (8,93 g / cm3), a zinek (7,14 g / cm3).[17] Tato hustota je původem idiomu přejít jako olověný balón.[18][19][E] Některé vzácnější kovy jsou hustší: wolfram a zlato jsou oba na 19,3 g / cm3, a osmium - nejhustší známý kov - má hustotu 22,59 g / cm3, téměř dvakrát vyšší než u olova.[20]
Olovo je velmi měkký kov s a Mohsova tvrdost 1,5; může být poškrábán nehtem.[21] Je docela tvárná a poněkud tvárná.[22][F] The objemový modul olova - míra jeho snadnosti stlačitelnosti - je 45,8GPa. Ve srovnání s tím je hliník 75,2 GPa; měď 137,8 GPa; a měkká ocel 160–169 GPa.[23] Olovo pevnost v tahu při 12–17 MPa je nízká (hliník je 6krát vyšší, měď 10krát a měkká ocel 15krát vyšší); může být posílena přidáním malého množství mědi nebo antimon.[24]
Bod tání olova - při 327,5 ° C (621,5 ° F)[25]—Je ve srovnání s většinou kovů velmi nízký.[16][G] Své bod varu 1749 ° C (3180 ° F)[25] je nejnižší mezi prvky uhlíkové skupiny. The Elektrický odpor olova při 20 ° C je 192 nanoohm -metrů, téměř řádově vyšší než u ostatních průmyslových kovů (měď při 15,43 nΩ · m; zlato 20,51 nΩ · m; a hliník při 24,15 nΩ · m).[27] Olovo je a supravodič při teplotách nižších než 7,19K.;[28] toto je nejvyšší kritická teplota ze všech supravodiče typu I a třetí nejvyšší z elementárních supravodičů.[29]
Množství izotopů se velmi liší podle vzorku | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní atomová hmotnost Ar, standardní(Pb) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Izotopy
Přírodní olovo se skládá ze čtyř stájí izotopy s hromadnými čísly 204, 206, 207 a 208,[30] a stopy pěti krátkotrvajících radioizotopů.[31] Vysoký počet izotopů je v souladu s olovem protonové číslo být vyrovnaný.[h] Olovo má a magické číslo protonů (82), pro které model jaderného pláště přesně předpovídá obzvláště stabilní jádro.[32] Lead-208 má 126 neutronů, další magické číslo, což může vysvětlovat, proč je lead-208 mimořádně stabilní.[32]
Díky vysokému atomovému číslu je olovo nejtěžším prvkem, jehož přírodní izotopy jsou považovány za stabilní; lead-208 je nejtěžší stabilní jádro. (Tento rozdíl dříve spadl na vizmut s atomovým číslem 83, dokud nebude jediné prvotní izotop Bylo zjištěno, že vizmut-209 se v roce 2003 rozpadal velmi pomalu.)[i] Čtyři stabilní izotopy olova by teoreticky mohly podstoupit rozpad alfa na izotopy z rtuť s uvolněním energie, ale u žádného z nich to nebylo pozorováno; jejich předpokládané poločasy se pohybují od 1035 do 10189 let[35] (minimálně 1025 krát současný věk vesmíru).
Tři ze stabilních izotopů se nacházejí ve třech ze čtyř hlavních rozpadové řetězy: olovo-206, olovo-207 a olovo-208 jsou konečné produkty rozpadu uranu-238, uranu-235 a thoria-232.[36] Tyto rozpadové řetězce se nazývají uranový řetězec, aktiniový řetězec a thoriový řetězec.[37] Jejich izotopové koncentrace ve vzorku přírodní horniny velmi závisí na přítomnosti těchto tří mateřských izotopů uranu a thoria. Například relativní množství olova-208 se může pohybovat od 52% v normálních vzorcích do 90% v thoriových rudách;[38] z tohoto důvodu je standardní atomová hmotnost olova dána pouze na jedno desetinné místo.[39] Jak čas plyne, poměr olova-206 a olova-207 k olovu-204 se zvyšuje, protože první dva jsou doplněny radioaktivním rozpadem těžších prvků, zatímco druhý není; to umožňuje lead-lead dating. Jak se uran rozpadá na olovo, mění se jejich relativní množství; to je základ pro seznamka uran – olovo.[40] Olovo - 207 exponátů nukleární magnetická rezonance vlastnost, která byla použita ke studiu jejích sloučenin v roztoku a v pevném stavu,[41][42] včetně v lidském těle.[43]

Kromě stabilních izotopů, které tvoří téměř všechno olovo, které existuje přirozeně, existují stopová množství několika radioaktivních izotopů. Jedním z nich je olovo-210; i když má poločas rozpadu pouze 22,3 let,[30] v přírodě se vyskytují malá množství, protože olovo-210 je produkováno dlouhou rozpadovou řadou, která začíná uranem-238 (který je na Zemi přítomen miliardy let). Olovo-211, -212 a -214 je přítomno v řetězcích rozpadu uranu-235, thoria-232 a uranu-238, takže stopy všech tří těchto izotopů olova se nacházejí přirozeně. Minutové stopy olova-209 vznikají z velmi vzácných rozpad kazu radia 223, jeden z dceřiné produkty přírodního uranu-235 a rozpadový řetězec neptunia-237, jehož stopy jsou produkovány zachycení neutronů v uranových rudách. Olovo-210 je zvláště užitečné pro pomoc při identifikaci stáří vzorků měřením jeho poměru k olovu-206 (oba izotopy jsou přítomny v jediném rozpadovém řetězci).[44]
Celkem bylo syntetizováno 43 izotopů olova s hromadným počtem 178–220.[30] Lead-205 je nejstabilnější radioizotop s poločasem rozpadu kolem 1,73×107 let.[j] Druhým nejstabilnějším je olovo-202, které má poločas asi 52 500 let, delší než kterýkoli z přírodních stopových radioizotopů.[30]
Chemie

Sypké olovo vystavené vlhkému vzduchu vytváří ochrannou vrstvu různého složení. Uhličitan olovnatý (II) je běžnou složkou;[46][47][48] the síran nebo chlorid mohou být také přítomny v městském nebo námořním prostředí.[49] Díky této vrstvě je objemné olovo ve vzduchu účinně chemicky inertní.[49] Jemně práškované olovo, stejně jako u mnoha kovů, je samozápalný,[50] a hoří modrobílým plamenem.[51]
Fluor reaguje s olovem při pokojové teplotě a tvoří se fluorid olovnatý. Reakce s chlór je podobný, ale vyžaduje zahřátí, protože výsledná chloridová vrstva snižuje reaktivitu prvků.[49] Roztavené olovo reaguje s chalkogeny za vzniku chalkogenidů olova (II).[52]
Olovnatý kov odolává sírová a kyselina fosforečná ale ne chlorovodíková nebo kyselina dusičná; výsledek závisí na nerozpustnosti a následné pasivaci produktové soli.[53] Organické kyseliny, jako např octová kyselina, rozpusťte olovo v přítomnosti kyslíku.[49] Koncentrovaný zásady rozpustí olovo a formu plumbity.[54]
Anorganické sloučeniny
Olovo ukazuje dva hlavní oxidační stavy: +4 a +2. The čtyřmocný stav je společný pro uhlíkovou skupinu. Dvojmocný stav je vzácný uhlík a křemík, minoritní pro germanium, důležitý (ale nepřekračující) pro cín, a je důležitější ze dvou oxidačních stavů pro olovo.[49] To lze přičíst relativistické efekty, konkrétně efekt inertního páru, což se projeví, když je velký rozdíl v elektronegativita mezi olovem a kysličník, halogenid nebo nitrid anionty, což vede k významnému částečnému kladnému náboji na olovu. Výsledkem je silnější kontrakce orbitálu olova 6s, než je tomu u orbitálu 6p, což je v iontových sloučeninách spíše inertní. Efekt inertního páru je méně použitelný pro sloučeniny, ve kterých olovo tvoří kovalentní vazby s prvky podobné elektronegativity, jako je uhlík v organoolových sloučeninách. V těchto orbitálech 6s a 6p zůstávají podobně velké a sp3 hybridizace je stále energeticky příznivá. Olovo, jako uhlík, je v těchto sloučeninách převážně čtyřmocné.[55]
Existuje relativně velký rozdíl v elektronegativitě olova (II) při 1,87 a olova (IV) při 2,33. Tento rozdíl značí zvrat v trendu zvyšování stability oxidačního stavu +4 klesajícího k uhlíkové skupině; cín má pro srovnání hodnoty 1,80 ve stavu oxidace +2 a 1,96 ve stavu +4.[56]
Olovo (II)
Sloučeniny olova (II) jsou charakteristické pro anorganickou chemii olova. Dokonce silný oxidační činidla jako fluor a chlor reagují s olovem za vzniku pouze PbF2 a PbCl2.[49] Olovnaté (II) ionty jsou obvykle bezbarvé v roztoku,[57] a částečně hydrolyzovat za vzniku Pb (OH)+ a nakonec [Pb4(ACH)4]4+ (ve kterém hydroxyl ionty působí jako přemosťující ligandy ),[58][59] ale nejsou redukční činidla jako jsou ionty cínu (II). Techniky pro identifikaci přítomnosti Pb2+ ionty ve vodě se obecně spoléhají na srážení chloridu olovitého pomocí zředěné kyseliny chlorovodíkové. Protože je chloridová sůl těžce rozpustná ve vodě, ve velmi zředěných roztocích se srážením sulfidu olovnatého dosahuje probubláváním sirovodík prostřednictvím řešení.[60]
Oxid olovnatý existuje ve dvou polymorfy, litarge α-PbO (červená) a masicot β-PbO (žlutý), přičemž druhý je stabilní pouze nad přibližně 488 ° C. Litharge je nejčastěji používaná anorganická sloučenina olova.[61] Neexistuje žádný hydroxid olovnatý; zvyšování pH roztoků solí olova (II) vede k hydrolýze a kondenzaci.[62]Olovo běžně reaguje s těžšími chalkogeny. Sulfid olovnatý je a polovodič, a fotovodič a velmi citlivý detektor infračerveného záření. Další dva chalkogenidy, selenid olovnatý a olovo telurid, jsou rovněž fotovodivé. Jsou neobvyklé v tom, že jejich barva zesvětluje skupinu.[63]

Dihalogenidy olova jsou dobře charakterizovány; to zahrnuje diastatid[64] a smíšené halogenidy, jako je PbFCl. Relativní nerozpustnost posledně jmenovaného tvoří užitečný základ pro gravimetrické stanovení fluoru. Difluorid byl první pevná látka iontově vodivý sloučenina, která má být objevena (v roce 1834, Michael Faraday ).[65] Ostatní dihalogenidy se rozkládají při vystavení ultrafialovému nebo viditelnému světlu, zejména diiodidu.[66] Mnoho olova (II) pseudohalogenidy jsou známé, například kyanid, kyanát, a thiokyanát.[63][67] Olovo (II) tvoří širokou škálu halogenidů koordinační komplexy, jako je [PbCl4]2−, [PbCl6]4−a [Pb2Cl9]n5n− řetězový anion.[66]
Síran olovnatý (II) je nerozpustný ve vodě, jako sírany jiných těžkých dvojmocných látek kationty. Dusičnan olovnatý a octan olovnatý jsou velmi rozpustné a to se využívá při syntéze dalších sloučenin olova.[68]
Olovo (IV)
Je známo málo anorganických sloučenin olova (IV). Vznikají pouze ve vysoce oxidačních roztocích a za standardních podmínek normálně neexistují.[69] Oxid olovnatý poskytuje směsný oxid při další oxidaci, Pb3Ó4. Je popsán jako oxid olovnatý (II, IV) nebo strukturně 2PbO · PbO2a je nejznámější směsnou valenční sloučeninou olova. Oxid olovnatý je silné oxidační činidlo, schopné oxidovat kyselinu chlorovodíkovou na plynný chlor.[70] Je to proto, že očekávaný PbCl4 který by byl produkován, je nestabilní a spontánně se rozkládá na PbCl2 a Cl2.[71] Analogicky k oxid olovnatý, oxid olovnatý je schopen se tvořit instalatér anionty. Disulfid olovnatý[72] a olovo diselenid[73] jsou stabilní pouze při vysokých tlacích. Tetrafluorid olovnatý, žlutý krystalický prášek, je stabilní, ale méně než difluorid. Chlorid olovnatý (žlutý olej) se rozkládá při pokojové teplotě, tetrabromid olovnatý je stále méně stabilní a existence tetrajodidu olovnatého je sporná.[74]

Jiné oxidační stavy
Některé sloučeniny olova existují ve formálních oxidačních stavech jiných než +4 nebo +2. Olovo (III) lze získat jako meziprodukt mezi olovem (II) a olovem (IV) ve větších organoolových komplexech; tento oxidační stav není stabilní, protože jak olovnatý (III) iont, tak větší komplexy, které jej obsahují, jsou radikály.[76][77][78] Totéž platí pro olovo (I), které lze nalézt u takových radikálních druhů.[79]
Je známa řada směsných oxidů olovnatých (II, IV). Když PbO2 zahřívá se na vzduchu a stává se Pb12Ó19 při 293 ° C, Pb12Ó17 při 351 ° C, Pb3Ó4 při 374 ° C a nakonec PbO při 605 ° C. Další sesquioxide, Pb2Ó3, lze získat za vysokého tlaku spolu s několika nestechiometrickými fázemi. Mnoho z nich vykazuje vady fluorit struktury, ve kterých jsou některé atomy kyslíku nahrazeny volnými místy: PbO lze považovat za struktury s takovou strukturou, přičemž chybí každá alternativní vrstva atomů kyslíku.[80]
Negativní oxidační stavy mohou nastat jako Zintl fáze, buď jako volné anionty olova, jako v Ba2Pb, přičemž olovo je formálně olovo (−IV),[81] nebo v kyslík citlivých prstencovitých nebo polyedrických shlukových iontech, jako je trigonální bipyramidální Pb52− iont, kde dva atomy olova jsou olovo (−I) a tři jsou olovo (0).[82] V takových aniontech je každý atom na polyedrickém vrcholu a přispívá dvěma elektrony ke každé kovalentní vazbě podél okraje od jejich sp3 hybridní orbitaly, další dva jsou externí osamělý pár.[58] Mohou být vyrobeny v kapalný amoniak prostřednictvím snížení olova o sodík.[83]

Organolead
Může se tvořit olovo vícenásobně vázané řetězce, vlastnost, kterou sdílí se svým zapalovačem homology ve skupině uhlíku. Jeho kapacita je mnohem menší, protože Pb – Pb energie vazby je více než třikrát a půlkrát nižší než u vazby C – C.[52] Olovo samo o sobě může vytvářet vazby kov-kov řádu až tří.[84] S uhlíkem tvoří olovo organické sloučeniny olova podobné, ale obecně méně stabilní než typické organické sloučeniny[85] (vzhledem k poměrně slabé vazbě Pb – C).[58] To dělá organokovová chemie olova mnohem méně širokého než olovo.[86] Olovo tvoří převážně organolové (IV) sloučeniny, i když začíná anorganickými reaktanty olova (II); je známo velmi málo organoolových sloučenin (II). Nejvíce dobře charakterizovanými výjimkami jsou Pb [CH (SiMe3)2]2 a Pb (η5-C5H5)2.[86]
Olověný analog nejjednoduššího organická sloučenina, metan, je plumbane. Plumban lze získat při reakci mezi kovovým olovem a atomový vodík.[87] Dva jednoduché deriváty, tetramethyllead a tetraethyllead, jsou nejznámější organolový sloučeniny. Tyto sloučeniny jsou relativně stabilní: tetraethyllead se začíná rozkládat až zahřátím[88] nebo pokud je vystaven slunečnímu záření nebo ultrafialovému světlu.[89][k] S kovem sodným olovo snadno tvoří ekvimolární slitinu, s níž reaguje alkylhalogenidy tvořit organokovový sloučeniny, jako je tetraethyllead.[90] Oxidační povaha mnoha organoolových sloučenin se užitečně využívá: tetraacetát olovnatý je důležité laboratorní činidlo pro oxidaci v organické syntéze.[91] Tetraethyllead, jakmile se přidá k benzínu, se vyrábí ve větším množství než jakákoli jiná organokovová sloučenina.[86] Jiné organolové sloučeniny jsou chemicky méně stabilní.[85] Pro mnoho organických sloučenin analog olova neexistuje.[87]
Původ a výskyt
| Atomový číslo | Živel | Relativní množství |
|---|---|---|
| 42 | Molybden | 0.798 |
| 46 | Palladium | 0.440 |
| 50 | Cín | 1.146 |
| 78 | Platina | 0.417 |
| 80 | Rtuť | 0.127 |
| 82 | Vést | 1 |
| 90 | Thorium | 0.011 |
| 92 | Uran | 0.003 |
Ve vesmíru
Hojnost olova na částice v Sluneční Soustava je 0,121 ppb (části na miliardu).[92][l] Toto číslo je dvakrát a půlkrát vyšší než číslo Platina, osmkrát více než rtuť a sedmnáctkrát více než zlato.[92] Množství olova v vesmír se pomalu zvyšuje[93] protože většina těžších atomů (všechny jsou nestabilní) se postupně rozpadají a vedou.[94] Hojnost olova ve sluneční soustavě od jejího vzniku před 4,5 miliardami let vzrostla přibližně o 0,75%.[95] Tabulka hojnosti sluneční soustavy ukazuje, že olovo je navzdory svému relativně vysokému atomovému číslu častější než většina ostatních prvků s atomovým číslem vyšším než 40.[92]
Prvotní olovo - které zahrnuje izotopy olovo-204, olovo-206, olovo-207 a olovo-208 - bylo většinou vytvořeno jako výsledek opakujících se procesů zachycování neutronů vyskytujících se ve hvězdách. Dva hlavní režimy snímání jsou: s- a r-procesy.[96]
V procesu s (s je pro „pomalý“) jsou zachycení oddělena roky nebo desetiletími, což umožňuje podstoupit méně stabilní jádra rozpad beta.[97] Stabilní jádro thallium-203 může zachytit neutron a stát se thalliem-204; toto prochází beta rozpadem za vzniku stabilního olova-204; při zachycení dalšího neutronu se stane olovem-205, jehož poločas rozpadu je přibližně 15 milionů let. Další zachycení vedou k olovu-206, olovu-207 a olovu-208. Při zachycení dalšího neutronu se olovo-208 stává olovem-209, které se rychle rozpadá na vizmut-209. Při zachycení dalšího neutronu se z bismutu-209 stane bismut-210 a tato beta se rozpadá na polonium-210, které se alfa rozpadá na olovo-206. Cyklus tedy končí u olova-206, olova-207, olova-208 a bismutu-209.[98]

V procesu r (r je pro „rychlý“) dochází k zachycení rychleji, než se jádra mohou rozpadnout.[99] K tomu dochází v prostředích s vysokou hustotou neutronů, jako je a supernova nebo sloučení dvou neutronové hvězdy. Tok neutronů může být řádově 1022 neutrony na čtvereční centimetr za sekundu.[100] R-proces netvoří tolik vedení jako s-proces.[101] Má tendenci zastavovat se, jakmile jádra bohatá na neutrony dosáhnou 126 neutronů.[102] V tomto bodě jsou neutrony uspořádány v úplných skořápkách v atomovém jádru a je těžší energeticky pojmout více z nich.[103] Když neutronový tok ustoupí, tato jádra beta se rozpadají na stabilní izotopy osmium, iridium a platina.[104]
Na Zemi
Olovo je klasifikováno jako a chalkofil pod Goldschmidt klasifikace, což znamená, že se obvykle vyskytuje v kombinaci se sírou.[105] Zřídka se vyskytuje v jeho rodák, kovová forma.[106] Mnoho olovnatých minerálů je relativně lehkých a v průběhu historie Země zůstalo v kůra místo aby se ponořil hlouběji do nitra Země. To odpovídá relativně vysoké hodnotě olova hojnost kůry 14 ppm; je to 38. nejvíce hojný prvek v kůře.[107][m]
Hlavním minerálem s obsahem olova je galenit (PbS), který se většinou vyskytuje u zinkových rud.[109] Většina ostatních minerálů olova nějakým způsobem souvisí s galenitem; boulangerit, Pb5Sb4S11, je směsný sulfid odvozený od galenitu; anglesit, PbSO4, je produktem oxidace galenitu; a cerussit nebo bílá olověná ruda, PbCO3, je produkt rozkladu galenitu. Arsen, cín, antimon, stříbrný, zlato, měď a vizmut jsou běžné nečistoty v olovnatých minerálech.[109]

Světové vedoucí zdroje přesahují dvě miliardy tun. Významné vklady se nacházejí v Austrálii, Číně, Irsku, Mexiku, Peru, Portugalsku, Rusku a Spojených státech. Globální rezervy - zdroje, které je ekonomicky možné vytěžit - dosáhly v roce 2016 celkem 88 milionů tun, z toho Austrálie měla 35 milionů, Čína 17 milionů a Rusko 6,4 milionu.[110]
Typické základní koncentrace olova nepřesahují 0,1 μg / m3 v atmosféře; 100 mg / kg v půdě; a 5 μg / l ve sladké a mořské vodě.[111]
Etymologie
Moderní anglické slovo „lead“ má germánský původ; pochází z Střední angličtina leed a Stará angličtina Vést (s macron nad „e“, což znamená, že samohláska tohoto dopisu je dlouhá).[112] Staré anglické slovo je odvozeno z hypotetického rekonstruovaného Proto-germánský *lauda- ("Vést").[113] Podle lingvistické teorie neslo toto slovo potomky ve více germánských jazycích přesně stejného významu.[113]
Neexistuje shoda ohledně původu proto-germánského *lauda-. Jedna hypotéza naznačuje, že je odvozena z Protoindoevropský *lAudh- („olovo“; velká písmena samohlásky jsou ekvivalentní makronům).[114] Další hypotéza naznačuje, že je vypůjčena Proto-keltský *ɸloud-io- ("Vést"). Toto slovo souvisí s latinský olovo, který dal prvku jeho chemický symbol Pb. Slovo *ɸloud-io- je považován za původ proto-germánského *bliwa- (což také znamená „olovo“), ze kterého vycházel Němec Blei.[115]
Název chemického prvku nesouvisí se slovesem stejného pravopisu, které je odvozeno od proto-germánského *layijan- ("vést").[116]
Dějiny
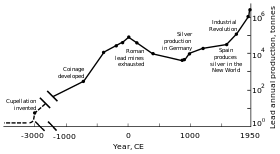
Pravěk a raná historie
Kovové olověné korálky sahá až do 7000–6500 př. n. l byly nalezeny v Malá Asie a může představovat první příklad kovu tavení.[118] V té době mělo olovo kvůli své měkkosti a matnému vzhledu jen málo (pokud vůbec) aplikací.[118] Hlavním důvodem šíření produkce olova bylo jeho spojení se stříbrem, které lze získat spalováním galenitu (běžného olovnatého minerálu).[119] The Starověcí Egypťané jako první používali minerály olova v kosmetice, aplikaci, která se rozšířila do Starověké Řecko a za;[120] Egypťané možná použili olovo pro potápěče v rybářských sítích, glazury, brýle, emaily a na ozdoby.[119] Různé civilizace Úrodný půlměsíc používal olovo jako psací materiál, jako měnu a jako stavební materiál.[119] Olovo bylo použito v Starověký Číňan královský dvůr jako a povzbuzující,[119] jako měna,[121] a jako antikoncepční;[122] the Civilizace v údolí Indu a Mesoamericans[119] použil jej k výrobě amuletů; a východní a jihoafrický národ používaly olovo tažení drátu.[123]
Klasická éra
Protože stříbro bylo značně používáno jako dekorativní materiál a výměnné médium, ložiska olova se začala zpracovávat v Malé Asii od roku 3000 př. později byla v Olově vytvořena ložiska olova Egejské moře a Laurion. Tyto tři regiony společně dominovaly produkci vytěženého olova do c. 1200 př. N. L.[124] Od roku 2000 př. N. L Féničané zpracované vklady v Pyrenejský poloostrov; do roku 1600 př. n. l. existovala těžba olova Kypr, Řecko a Sardinie.[125]

Řím Územní expanze v Evropě a ve Středomoří a její rozvoj těžby vedly k tomu, že se v průběhu EU stala největším producentem olova klasická éra, s odhadovanou roční produkcí vrcholící na 80 000 tunách. Stejně jako jejich předchůdci získali Římané olovo hlavně jako vedlejší produkt při tavení stříbra.[117][127] Těžba olova došlo v Střední Evropa, Británie, Balkán, Řecko, Anatolie, a Hispania, přičemž druhý představuje 40% světové produkce.[117]
Olověné tablety se běžně používaly jako materiál pro dopisy.[128] Olověné rakve, odlévané do plochých pískových forem s vyměnitelnými motivy, aby vyhovovaly víře zesnulého, byly použity ve starověku Judea.[129] Z olova se vyráběly prakové kulky z 5. století před naším letopočtem. V římských dobách byly olověné prakové střely hojně používány a byly účinné na vzdálenost 100 až 150 metrů. Baleárští prakovníci, kteří se používali jako žoldáci v kartáginské a římské armádě, byli známí svou střeleckou vzdáleností a přesností.[130]
K výrobě se používalo olovo vodovodní potrubí v římská říše; the latinský slovo pro kov, olovo, je původ anglického slova „instalatérské práce Jeho snadná práce a odolnost proti korozi[131] zajistil jeho široké použití v jiných aplikacích, včetně farmaceutických, střešních, měnových a válečných.[132][133][134] Spisovatelé té doby, jako např Cato starší, Columella, a Plinius starší, doporučené olověné (nebo olovem potažené) nádoby pro přípravu sladidla a konzervační látky přidáno k vínu a jídlu. Olovo udělovalo příjemnou chuť díky tvorbě „cukru olova“ (octan olovnatý (II)), zatímco měď nebo bronz nádoby by mohly propůjčit hořkou příchuť měděnka formace.[135]
Heinz Eschnauer a Markus Stoeppler
„Víno - banka enologických vzorků“, 1992[136]
Římský autor Vitruvius hlásil zdravotní rizika olova[137] a moderní autoři navrhli, že otrava olovem hrála hlavní roli při úpadku římské říše.[138][139][n] Jiní vědci kritizovali taková tvrzení a poukazovali například na to, že ne všechny bolesti břicha jsou způsobeny otravou olovem.[141][142] Podle archeologických výzkumů, Roman olověné trubky zvýšené hladiny olova ve vodě z vodovodu, ale takový účinek byl „nepravděpodobný, že by byl skutečně škodlivý“.[143][144] Když došlo k otravě olovem, obětem se říkalo „saturnine“, temné a cynické, po strašidelném otci bohů, Saturn. Podle asociace bylo olovo považováno za otce všech kovů.[145] Jeho status v římské společnosti byl nízký, protože byl snadno dostupný[146] a levné.[147]

Zmatek s cínem a antimonem
Během klasické éry (a dokonce až do 17. století) se cín často nerozlišoval od olova: Římané se nazývali olovo plumbum nigrum („černé olovo“) a cín plumbum candidum („jasný vodič“). Sdružení olova a cínu lze vidět v jiných jazycích: ve slově olovo v čeština překládá se do „olova“, ale v ruština, své příbuzný олово (olovo) znamená „cín“.[148] Aby se zmatek přidal, olovo mělo úzký vztah k antimonu: oba prvky se běžně vyskytují jako sulfidy (galenit a stibnite ), často společně. Plinius nesprávně napsal, že stibnit by vedl k ohřevu namísto antimonu.[149] V zemích, jako je Turecko a Indie, původně perský název surma přišel se odkazovat na sulfid antimonitý nebo sulfid olovnatý,[150] a v některých jazycích, například v ruštině, pojmenoval antimon (сурьма).[151]
Středověk a renesance
Těžba olova v západní Evropě poklesla po pádu Západořímská říše, s Arabská Iberia je jediným regionem s významnou produkcí.[152][153] K největší produkci olova došlo v jižní a východní Asii, zejména v Číně a Indii, kde těžba olova rychle rostla.[153]

V Evropě se produkce olova začala zvyšovat v 11. a 12. století, kdy se znovu používala jako střešní krytina a potrubí. Počínaje 13. stoletím se k výrobě používalo olovo vitráže.[155] V evropský a arabský tradice alchymie, olovo (symbol ![]() v evropské tradici)[156] byl považován za nečistý obecný kov který by se oddělením, čištěním a vyvážením jeho podstatných podstat mohl přeměnit na čisté a neporušitelné zlato.[157] V tomto období se olovo stále více využívalo pro falšování víno. Použití tohoto vína bylo zakázáno pro použití v křesťanských obřadech a papežský býk v roce 1498, ale nadále se vstřebával a vyústil v hromadné otravy až do konce 18. století.[152][158] Olovo bylo klíčovým materiálem v některých částech EU tiskařský lis a olověný prach byl běžně vdechován tiskovými pracovníky, což způsobilo otravu olovem.[159] Přestože bylo olovo dražší než železo, stalo se také hlavním materiálem pro výrobu střel do střelných zbraní. To bylo méně škodlivé pro železné zbraně, mělo vyšší hustotu (což umožňovalo lepší zadržení rychlosti) a jeho nižší teplota tání usnadňovala výrobu střel, protože je bylo možné vyrábět pomocí dřevěného ohně.[160] Olovo ve formě Benátská ceruse, byl západoevropskou aristokracií značně používán v kosmetice, protože bělené tváře byly považovány za známku skromnosti.[161][162] Tato praxe se později rozšířila na bílé paruky a oční víčka a vybledla pouze s francouzská revoluce na konci 18. století. Podobná móda se objevila v Japonsku v 18. století se vznikem gejši, praxe, která pokračovala dlouho do 20. století. Bílé tváře žen „začaly představovat svou ženskou ctnost jako japonské ženy“,[163] s olovem běžně používaným v bělidle.[164]
v evropské tradici)[156] byl považován za nečistý obecný kov který by se oddělením, čištěním a vyvážením jeho podstatných podstat mohl přeměnit na čisté a neporušitelné zlato.[157] V tomto období se olovo stále více využívalo pro falšování víno. Použití tohoto vína bylo zakázáno pro použití v křesťanských obřadech a papežský býk v roce 1498, ale nadále se vstřebával a vyústil v hromadné otravy až do konce 18. století.[152][158] Olovo bylo klíčovým materiálem v některých částech EU tiskařský lis a olověný prach byl běžně vdechován tiskovými pracovníky, což způsobilo otravu olovem.[159] Přestože bylo olovo dražší než železo, stalo se také hlavním materiálem pro výrobu střel do střelných zbraní. To bylo méně škodlivé pro železné zbraně, mělo vyšší hustotu (což umožňovalo lepší zadržení rychlosti) a jeho nižší teplota tání usnadňovala výrobu střel, protože je bylo možné vyrábět pomocí dřevěného ohně.[160] Olovo ve formě Benátská ceruse, byl západoevropskou aristokracií značně používán v kosmetice, protože bělené tváře byly považovány za známku skromnosti.[161][162] Tato praxe se později rozšířila na bílé paruky a oční víčka a vybledla pouze s francouzská revoluce na konci 18. století. Podobná móda se objevila v Japonsku v 18. století se vznikem gejši, praxe, která pokračovala dlouho do 20. století. Bílé tváře žen „začaly představovat svou ženskou ctnost jako japonské ženy“,[163] s olovem běžně používaným v bělidle.[164]
Mimo Evropu a Asii
V Nový svět, produkce olova byla zaznamenána brzy po příchodu evropských osadníků. Nejstarší záznam se datuje rokem 1621 v angličtině Kolonie Virginie čtrnáct let po založení.[165] V Austrálii byl první důl otevřený kolonisty na kontinentu olověný důl v roce 1841.[166] V Africe byla v EU známá těžba a tavení olova Benue Trough[167] a nižší Konžská pánev, kde se olovo používalo pro obchod s Evropany a jako měna do 17. století,[168] dobře před tahanice o Afriku.

Průmyslová revoluce
Ve druhé polovině 18. století zažila Británie, později kontinentální Evropa a USA Průmyslová revoluce. Bylo to poprvé, kdy produkce olova převyšovala míru výroby v Římě.[117] Británie byla vedoucím producentem, který tento status ztratil do poloviny 19. století vyčerpáním dolů a rozvojem těžby olova v Německu, Španělsku a Spojených státech.[169] Do roku 1900 byly USA lídrem v celosvětové produkci olova a další mimoevropské národy - Kanada, Mexiko a Austrálie - zahájily významnou produkci; výroba mimo Evropu překročila produkci uvnitř.[170] Velká část poptávky po olovu pocházela z instalatérství a malířství -barvy na olovo byly pravidelně používány.[171] V této době bylo více (dělnické třídy) vystaveno kovům a případy otravy olovem se stupňovaly. To vedlo k výzkumu účinků příjmu olova. Ukázalo se, že olovo je nebezpečnější ve formě dýmu než ve formě pevného kovu. Otrava olovem a dna byly propojeny; Britský lékař Alfred Baring Garrod poznamenal, že třetina jeho pacientů s dnou byli instalatéři a malíři. V 19. století byly studovány také účinky chronického požití olova, včetně duševních poruch. První zákony zaměřené na snížení otravy olovem v továrnách byly přijaty během 70. a 80. let ve Velké Británii.[171]

Moderní éra
Další důkazy o hrozbě, kterou olovo představuje pro člověka, byly objeveny na konci 19. a na počátku 20. století. Mechanismy újmy byly lépe pochopeny, byla dokumentována slepota olova a tento prvek byl vyřazen z veřejného použití ve Spojených státech a Evropě. Spojené království zavedlo povinné tovární inspekce v roce 1878 a jmenovalo prvního lékařského inspektora továren v roce 1898; v důsledku toho bylo hlášeno 25násobné snížení počtu případů otravy olovem od roku 1900 do roku 1944.[172] Většina evropských zemí zakázala použití olovnatých barev - běžně používaných kvůli neprůhlednosti a voděodolnosti[173]—Pro interiéry do roku 1930.[174]
Poslední hlavní expozicí člověka olovu bylo přidání tetraethylleadu do benzínu jako protiblokovací prostředek, a practice that originated in the United States in 1921. It was phased out in the United States and the Evropská unie by 2000.[171]
In the 1970s, the United States and Western European countries introduced legislation to reduce lead air pollution.[175][176] The impact was significant: while a study conducted by the Centra pro kontrolu a prevenci nemocí in the United States in 1976–1980 showed that 77.8% of the population had elevated hladiny olova v krvi, in 1991–1994, a study by the same institute showed the share of people with such high levels dropped to 2.2%.[177] The main product made of lead by the end of the 20th century was the lead–acid battery.[178]
From 1960 to 1990, lead output in the Západní blok grew by about 31%.[179] The share of the world's lead production by the Východní blok increased from 10% to 30%, from 1950 to 1990, with the Sovětský svaz being the world's largest producer during the mid-1970s and the 1980s, and China starting major lead production in the late 20th century.[180] Unlike the European communist countries, China was largely unindustrialized by the mid-20th century; in 2004, China surpassed Australia as the largest producer of lead.[181] As was the case during European industrialization, lead has had a negative effect on health in China.[182]
Výroba

As of 2014, production of lead is increasing worldwide due to its use in lead–acid batteries.[183] There are two major categories of production: primary from mined ores, and secondary from scrap. In 2014, 4.58 million metric tons came from primary production and 5.64 million from secondary production. The top three producers of mined lead concentrate in that year were China, Australia, and the United States.[110] The top three producers of refined lead were China, the United States, and India.[184] Podle Panel mezinárodních zdrojů je Metal Stocks in Society report of 2010, the total amount of lead in use, stockpiled, discarded, or dissipated into the environment, on a global basis, is 8 kg per capita. Much of this is in more developed countries (20–150 kg per capita) rather than less developed ones (1–4 kg per capita).[185]
The primary and secondary lead production processes are similar. Some primary production plants now supplement their operations with scrap lead, and this trend is likely to increase in the future. Given adequate techniques, lead obtained via secondary processes is indistinguishable from lead obtained via primary processes. Scrap lead from the building trade is usually fairly clean and is re-melted without the need for smelting, though refining is sometimes needed. Secondary lead production is therefore cheaper, in terms of energy requirements, than is primary production, often by 50% or more.[186]
Hlavní
Most lead ores contain a low percentage of lead (rich ores have a typical content of 3–8%) which must be concentrated for extraction.[187] During initial processing, ores typically undergo crushing, dense-medium separation, grinding, pěnová flotace, and drying. The resulting concentrate, which has a lead content of 30–80% by mass (regularly 50–60%),[187] is then turned into (impure) lead metal.
There are two main ways of doing this: a two-stage process involving roasting followed by blast furnace extraction, carried out in separate vessels; or a direct process in which the extraction of the concentrate occurs in a single vessel. The latter has become the most common route, though the former is still significant.[188]
| Země | Výstup (thousand tons) |
|---|---|
| 2,400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| Ostatní země | 170 |
Two-stage process
First, the sulfide concentrate is pražený in air to oxidize the lead sulfide:[189]
- 2 PbS(s) + 3 O2(g) → 2 PbO(s) + 2 SO2(g)↑
As the original concentrate was not pure lead sulfide, roasting yields not only the desired lead(II) oxide, but a mixture of oxides, sulfates, and silicates of lead and of the other metals contained in the ore.[190] This impure lead oxide is reduced in a Kola -fired blast furnace to the (again, impure) metal:[191]
- 2 PbO(s) + C(s) → 2 Pb(s) + CO2(g)↑
Impurities are mostly arsenic, antimony, bismuth, zinc, copper, silver, and gold. Typically they are removed in a series of pyrometallurgical processes. The melt is treated in a reverberatory furnace with air, steam, and sulfur, which oxidizes the impurities except for silver, gold, and bismuth. Oxidized contaminants float to the top of the melt and are skimmed off.[192][193] Metallic silver and gold are removed and recovered economically by means of the Parkes process, in which zinc is added to lead. Zinc, which is immiscible in lead, dissolves the silver and gold. The zinc solution can be separated from the lead, and the silver and gold retrieved.[193][194] De-silvered lead is freed of bismuth by the Betterton–Kroll process, treating it with metallic calcium and hořčík. The resulting bismuth dross can be skimmed off.[193]
Alternatively to the pyrometallurgical processes, very pure lead can be obtained by processing smelted lead electrolytically using the Betts process. Anodes of impure lead and cathodes of pure lead are placed in an electrolyte of lead fluorosilicate (PbSiF6). Once electrical potential is applied, impure lead at the anode dissolves and plates onto the cathode, leaving the majority of the impurities in solution.[193][195] This is a high-cost process and thus mostly reserved for refining bullion containing high percentages of impurities.[196]
Direct process
In this process, lead bullion and struska is obtained directly from lead concentrates. The lead sulfide concentrate is melted in a furnace and oxidized, forming lead monoxide. Carbon (as coke or svítiplyn[p]) is added to the molten charge along with fluxing agents. The lead monoxide is thereby reduced to metallic lead, in the midst of a slag rich in lead monoxide.[188]
If the input is rich in lead, as much as 80% of the original lead can be obtained as bullion; the remaining 20% forms a slag rich in lead monoxide. For a low-grade feed, all of the lead can be oxidized to a high-lead slag.[188] Metallic lead is further obtained from the high-lead (25–40%) slags via submerged fuel combustion or injection, reduction assisted by an electric furnace, or a combination of both.[188]
Alternativy
Research on a cleaner, less energy-intensive lead extraction process continues; a major drawback is that either too much lead is lost as waste, or the alternatives result in a high sulfur content in the resulting lead metal. Hydrometallurgical extraction, in which anodes of impure lead are immersed into an elektrolyt and pure lead is deposited onto a cathode, is a technique that may have potential, but is not currently economical except in cases where electricity is very cheap.[197]
Sekundární
Smelting, which is an essential part of the primary production, is often skipped during secondary production. It is only performed when metallic lead has undergone significant oxidation.[186] The process is similar to that of primary production in either a vysoká pec nebo a rotační pec, with the essential difference being the greater variability of yields: blast furnaces produce hard lead (10% antimony) while reverberatory and rotary kiln furnaces produced semisoft lead (3–4% antimony).[198] The Isasmelt process is a more recent smelting method that may act as an extension to primary production; battery paste from spent lead–acid batteries (containing lead sulfate and lead oxides) has its sulfate removed by treating it with alkali, and is then treated in a coal-fueled furnace in the presence of oxygen, which yields impure lead, with antimony the most common impurity.[199] Refining of secondary lead is similar to that of primary lead; some refining processes may be skipped depending on the material recycled and its potential contamination.[199]
Of the sources of lead for recycling, lead–acid batteries are the most important; lead pipe, sheet, and cable sheathing are also significant.[186]
Aplikace

Contrary to popular belief, pencil leads in wooden pencils have never been made from lead. When the pencil originated as a wrapped graphite writing tool, the particular type of grafit used was named plumbago (doslovně, act for lead nebo lead mockup).[201]
Elemental form
Lead metal has several useful mechanical properties, including high density, low melting point, ductility, and relative inertness. Many metals are superior to lead in some of these aspects but are generally less common and more difficult to extract from parent ores. Lead's toxicity has led to its phasing out for some uses.[202]
Lead has been used for kulky since their invention in the Middle Ages. It is inexpensive; its low melting point means small arms ammunition and shotgun pellets can be cast with minimal technical equipment; and it is denser than other common metals, which allows for better retention of velocity. It remains the main material for bullets, alloyed with other metals as hardeners.[160] Concerns have been raised that lead bullets used for hunting can damage the environment.[q]
Lead's high density and resistance to corrosion have been exploited in a number of related applications. It is used as zátěž in sailboat keels; its density allows it to take up a small volume and minimize water resistance, thus counterbalancing the heeling effect of wind on the sails.[204] Používá se v potápění weight belts to counteract the diver's buoyancy.[205] In 1993, the base of the Šikmá věž v Pise was stabilized with 600 tonnes of lead.[206] Because of its corrosion resistance, lead is used as a protective sheath for underwater cables.[207]

Lead has many uses in the construction industry; lead sheets are used as architectural metals in roofing material, opláštění, flashing, žlaby and gutter joints, and on roof parapets.[208][209] Lead is still used in statues and sculptures,[r] včetně pro armatury.[211] In the past it was often used to balance the wheels of cars; for environmental reasons this use is being phased out in favor of other materials.[110]
Lead is added to copper alloys, such as mosaz and bronze, to improve obrobitelnost and for its lubricating vlastnosti. Being practically insoluble in copper the lead forms solid globules in imperfections throughout the alloy, such as grain boundaries. In low concentrations, as well as acting as a lubricant, the globules hinder the formation of swarf as the alloy is worked, thereby improving machinability. Copper alloys with larger concentrations of lead are used in ložiska. The lead provides lubrication, and the copper provides the load-bearing support.[212]
Lead's high density, atomic number, and formability form the basis for use of lead as a barrier that absorbs sound, vibration, and radiation.[213] Lead has no natural resonance frequencies;[213] as a result, sheet-lead is used as a sound deadening layer in the walls, floors, and ceilings of sound studios.[214] Varhanní píšťaly are often made from a lead alloy, mixed with various amounts of tin to control the tone of each pipe.[215][216] Lead is an established stínění materiál z záření v jaderná věda a v rentgen pokoje[217] due to its denseness and high attenuation coefficient.[218] Molten lead has been used as a coolant pro lead-cooled fast reactors.[219]
The largest use of lead in the early 21st century is in lead–acid batteries. The lead in batteries undergoes no direct contact with humans, so there are fewer toxicity concerns.[s] People who work in battery production plants may be exposed to lead dust and inhale it.[221]} The reactions in the battery between lead, lead dioxide, and sulfuric acid provide a reliable source of Napětí.[t] Superkondenzátory incorporating lead–acid batteries have been installed in kilowatt and megawatt scale applications in Australia, Japan, and the United States in frequency regulation, solar smoothing and shifting, wind smoothing, and other applications.[223] These batteries have lower energy density and charge-discharge efficiency than lithium-iontové baterie, but are significantly cheaper.[224]
Lead is used in high voltage power cables as sheathing material to prevent water diffusion into insulation; this use is decreasing as lead is being phased out.[225] Jeho použití v pájka for electronics is also being phased out by some countries to reduce the amount of environmentally hazardous odpad.[226] Lead is one of three metals used in the Oddy test for museum materials, helping detect organic acids, aldehydes, and acidic gases.[227][228]
Sloučeniny
In addition to being the main application for lead metal, lead-acid batteries are also the main consumer of lead compounds. The energy storage/release reaction used in these devices involves lead sulfate a lead dioxide:
- Pb(s) + PbO
2(s) + 2H
2TAK
4(aq) → 2PbSO
4(s) + 2H
2Ó(l)
Other applications of lead compounds are very specialized and often fading. Lead-based coloring agents are used in ceramic glazes and glass, especially for red and yellow shades.[229] While lead paints are phased out in Europe and North America, they remain in use in less developed countries such as China,[230] Indie,[231] or Indonesia.[232] Lead tetraacetate and lead dioxide are used as oxidizing agents in organic chemistry. Lead is frequently used in the polyvinyl chlorid coating of electrical cords.[233][234] It can be used to treat candle wicks to ensure a longer, more even burn. Because of its toxicity, European and North American manufacturers use alternatives such as zinc.[235][236] Lead glass is composed of 12–28% lead oxide, changing its optical characteristics and reducing the transmission of ionizing radiation.[237] Lead-based polovodiče such as lead telluride and lead selenide are used in fotovoltaické cells and infračervený detektory.[238]
Biologické účinky
| Nebezpečí | |
|---|---|
| Piktogramy GHS |    |
| Signální slovo GHS | Nebezpečí |
| H302, H332, H351, H360Df, H373, H410 | |
| P201, P261, P273, P304, P340, P312, P308, P313, P391[239] | |
| NFPA 704 (ohnivý diamant) | |
Lead has no confirmed biological role, and there is no confirmed safe level of lead exposure.[240] A 2009 Canadian–American study concluded that even at levels that are considered to pose little to no risk, lead may cause "adverse mental health outcomes".[241] Its prevalence in the human body—at an adult average of 120 mg[u]—is nevertheless exceeded only by zinc (2500 mg) and iron (4000 mg) among the heavy metals.[243] Vést soli are very efficiently absorbed by the body.[244] A small amount of lead (1%) is stored in bones; the rest is excreted in urine and feces within a few weeks of exposure. Only about a third of lead is excreted by a child. Continual exposure may result in the bioakumulace olova.[245]
Toxicita
Lead is a highly poisonous metal (whether inhaled or swallowed), affecting almost every organ and system in the human body.[246] At airborne levels of 100 mg/m3, to je bezprostředně nebezpečné pro život a zdraví.[247] Most ingested lead is absorbed into the bloodstream.[248] The primary cause of its toxicity is its predilection for interfering with the proper functioning of enzymes. It does so by binding to the sulfhydrylové skupiny found on many enzymes,[249] or mimicking and displacing other metals which act as kofaktory in many enzymatic reactions.[250] Among the essential metals that lead interacts with are calcium, iron, and zinc.[251] High levels of calcium and iron tend to provide some protection from lead poisoning; low levels cause increased susceptibility.[244]
Účinky
Lead can cause severe damage to the brain and kidneys and, ultimately, death. By mimicking calcium, lead can cross the hematoencefalická bariéra. It degrades the myelin pochvy z neurony, reduces their numbers, interferes with neurotransmise routes, and decreases neuronal growth.[249] In the human body, lead inhibits porphobilinogen synthase a ferrochelatase, preventing both porfobilinogen formation and the incorporation of žehlička do protoporfyrin IX, the final step in heme syntéza. This causes ineffective heme synthesis and mikrocytární anémie.[252]
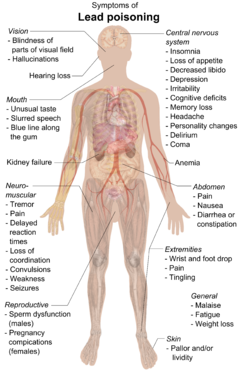
Symptoms of lead poisoning include nefropatie, kolika -like abdominal pains, and possibly weakness in the fingers, wrists, or ankles. Small blood pressure increases, particularly in middle-aged and older people, may be apparent and can cause anémie. Several studies, mostly cross-sectional, found an association between increased lead exposure and decreased heart rate variability.[253] In pregnant women, high levels of exposure to lead may cause miscarriage. Chronic, high-level exposure has been shown to reduce fertility in males.[254]
In a child's developing brain, lead interferes with synapse formation in the mozková kůra, neurochemical development (including that of neurotransmitters), and the organization of iontové kanály.[255] Early childhood exposure has been linked with an increased risk of sleep disturbances and excessive daytime drowsiness in later childhood.[256] High blood levels are associated with delayed puberty in girls.[257] The rise and fall in exposure to airborne lead from the combustion of tetraethyl lead in gasoline during the 20th century has been linked with historical increases and decreases in crime levels, a hypotéza which is not universally accepted.[258]
Exposure sources
Lead exposure is a global issue since lead mining and smelting, and battery manufacturing/disposal/recycling, are common in many countries. Lead enters the body via inhalation, ingestion, or skin absorption. Almost all inhaled lead is absorbed into the body; for ingestion, the rate is 20–70%, with children absorbing a higher percentage than adults.[259]
Poisoning typically results from ingestion of food or water contaminated with lead, and less commonly after accidental ingestion of contaminated soil, dust, or lead-based paint.[260] Seawater products can contain lead if affected by nearby industrial waters.[261] Fruit and vegetables can be contaminated by high levels of lead in the soils they were grown in. Soil can be contaminated through particulate accumulation from lead in pipes, lead paint, and residual emissions from leaded gasoline.[262]
The use of lead for water pipes is a problem in areas with soft or acidic water.[263] Hard water forms insoluble layers in the pipes whereas soft and acidic water dissolves the lead pipes.[264] Rozpuštěno oxid uhličitý in the carried water may result in the formation of soluble lead hydrogenuhličitan; oxygenated water may similarly dissolve lead as lead(II) hydroxide. Drinking such water, over time, can cause health problems due to the toxicity of the dissolved lead. The harder the water více hydrogenuhličitan vápenatý a síran it will contain, and the more the inside of the pipes will be coated with a protective layer of lead carbonate or lead sulfate.[265]

Ingestion of applied lead-based paint is the major source of exposure for children:a direct source is chewing on old painted window sills. Alternatively, as the applied dry paint deteriorates, it peels, is pulverized into dust and then enters the body through hand-to-mouth contact or contaminated food, water, or alcohol. Ingesting certain home remedies may result in exposure to lead or its compounds.[266]
Inhalation is the second major exposure pathway, affecting smokers and especially workers in lead-related occupations.[248] Cigaretový kouř contains, among other toxic substances, radioactive lead-210.[267]
Skin exposure may be significant for people working with organic lead compounds. The rate of skin absorption is lower for inorganic lead.[268]
Léčba
Treatment for lead poisoning normally involves the administration of dimercaprol a succimer.[269] Acute cases may require the use of disodium calcium edetate, the calcium chelátovat, and the disodium salt of ethylenediaminetetraacetic acid (EDTA ). It has a greater affinity for lead than calcium, with the result that lead chelate is formed by exchange and excreted in the urine, leaving behind harmless calcium.[270]
Účinky na životní prostředí

The extraction, production, use, and disposal of lead and its products have caused significant contamination of the Earth's soils and waters. Atmospheric emissions of lead were at their peak during the Industrial Revolution, and the leaded gasoline period in the second half of the twentieth century. Lead releases originate from natural sources (i.e., concentration of the naturally occurring lead), industrial production, incineration and recycling, and mobilization of previously buried lead.[271] Elevated concentrations of lead persist in soils and sediments in post-industrial and urban areas; industrial emissions, including those arising from uhlí burning,[272] continue in many parts of the world, particularly in the developing countries.[273]
Lead can accumulate in soils, especially those with a high organic content, where it remains for hundreds to thousands of years. Environmental lead can compete with other metals found in and on plants surfaces potentially inhibiting fotosyntéza and at high enough concentrations, negatively affecting plant growth and survival. Contamination of soils and plants can allow lead to ascend the food chain affecting microorganisms and animals. In animals, lead exhibits toxicity in many organs, damaging the nervous, ledvin, reproductive, krvetvorné, and cardiovascular systems after ingestion, inhalation, or skin absorption.[274] Fish uptake lead from both water and sediment;[275] bioaccumulation in the food chain poses a hazard to fish, birds, and sea mammals.[276]
Anthropogenic lead includes lead from výstřel a sinkers. These are among the most potent sources of lead contamination along with lead production sites.[277] Lead was banned for shot and sinkers in the United States in 2017,[278] although that ban was only effective for a month,[279] and a similar ban is being considered in the European Union.[280]
Analytical methods for the determination of lead in the environment include spektrofotometrie, Rentgenová fluorescence, atomová spektroskopie a electrochemical methods. A specific iontově selektivní elektroda has been developed based on the ionophore S,S'-methylenebis (N,N-diisobutyldithiocarbamate ).[281] An important biomarker assay for lead poisoning is δ-aminolevulinic acid levels in plasma, serum, and urine.[282]
Restriction and remediation

By the mid-1980s, there was significant decline in the use of lead in industry. In the United States, environmental regulations reduced or eliminated the use of lead in non-battery products, including gasoline, paints, solders, and water systems. Particulate control devices were installed in uhelné elektrárny to capture lead emissions.[272] In 1992, U.S. Congress required the Environmental Protection Agency to reduce the blood lead levels of the country's children.[283] Lead use was further curtailed by the European Union's 2003 Směrnice o omezení nebezpečných látek.[284] A large drop in lead deposition occurred in the Netherlands after the 1993 national ban on use of lead shot for hunting and sport shooting: from 230 tonnes in 1990 to 47.5 tonnes in 1995.[285]
Ve Spojených státech přípustný limit expozice for lead in the workplace, comprising metallic lead, inorganic lead compounds, and lead soaps, was set at 50 μg/m3 over an 8-hour workday, and the hladina olova v krvi limit at 5 μg per 100 g of blood in 2012.[286] Lead may still be found in harmful quantities in stoneware,[287] vinyl[288] (such as that used for tubing and the insulation of electrical cords), and Chinese brass.[proti] Old houses may still contain lead paint.[288] White lead paint has been withdrawn from sale in industrialized countries, but specialized uses of other pigments such as yellow chroman olovnatý zůstat.[173] Stripping old paint by sanding produces dust which can be inhaled.[290] Lead abatement programs have been mandated by some authorities in properties where young children live.[291]
Lead waste, depending on the jurisdiction and the nature of the waste, may be treated as household waste (in order to facilitate lead abatement activities),[292] or potentially hazardous waste requiring specialized treatment or storage.[293] Lead is released to the wildlife in shooting places and a number of lead management practices, such as stewardship of the environment and reduced public scrutiny, have been developed to counter the lead contamination.[294] Lead migration can be enhanced in acidic soils; to counter that, it is advised soils be treated with lime to neutralize the soils and prevent leaching of lead.[295]
Research has been conducted on how to remove lead from biosystems by biological means: Fish bones are being researched for their ability to bioremediate lead in contaminated soil.[296][297] Houba Aspergillus versicolor is effective at absorbing lead ions from industrial waste before being released to water bodies.[298] Several bacteria have been researched for their ability to remove lead from the environment, including the bakterie snižující síran Desulfovibrio a Desulfotomaculum, both of which are highly effective in aqueous solutions.[299]
Viz také
- Thomas Midgley Jr. – discovered that the addition of tetraethyllead to gasoline prevented "knocking" v vnitřní spalovací motory
Poznámky
- ^ Asi 10% lanthanide contraction bylo připsáno relativistické efekty.[4]
- ^ The tetrahedral allotrope of tin is called α- or gray tin and is stable only at or below 13.2 °C (55.8 °F). The stable form of tin above this temperature is called β- or white tin and has a distorted face centered cubic (tetragonal) structure which can be derived by compressing the tetrahedra of gray tin along their cubic axes. White tin effectively has a structure intermediate between the regular tetrahedral structure of gray tin, and the regular face centered cubic structure of lead, consistent with the general trend of increasing metallic character going down any representative group.[10]
- ^ A quasicrystalline tenký film allotrope of lead, with pentagonal symmetry, was reported in 2013. The allotrope was obtained by depositing lead atoms on the surface of an icosahedral silver-indium -yterbium quasicrystal. Its conductivity was not recorded.[11][12]
- ^ Diamond cubic structures with lattice parameters around the lattice parameter of silicon exists both in thin lead and tin films, and in massive lead and tin, freshly solidified in vacuum of ~5 x 10−6 Torr. Experimental evidence for almost identical structures of at least three oxide types is presented, demonstrating that lead and tin behave like silicon not only in the initial stages of crystallization, but also in the initial stages of oxidation.[13]
- ^ Britská angličtina: to go down like a lead balloon.
- ^ Malleability describes how easily it deforms under compression, whereas ductility means its ability to stretch.
- ^ A (wet) finger can be dipped into molten lead without risk of a burning injury.[26]
- ^ An even number of either protons or neutrons generally increases the nuclear stability of isotopes, compared to isotopes with odd numbers. No elements with odd atomic numbers have more than two stable isotopes; even-numbered elements have multiple stable isotopes, with tin (element 50) having the highest number of isotopes of all elements, ten.[30] Vidět Even and odd atomic nuclei Více podrobností.
- ^ The half-life found in the experiment was 1.9×1019 let.[33] A kilogram of natural bismuth would have an activity value of approximately 0.003 becquerels (decays per second). For comparison, the activity value of natural radiation in the human body is around 65 becquerels per kilogram of body weight (4500 becquerels on average).[34]
- ^ Lead-205 decays solely via elektronový záchyt, which means when there are no electrons available and lead is fully ionized with all 82 electrons removed it cannot decay. Fully ionized thallium-205, the isotope lead-205 would decay to, becomes unstable and can decay into a bound state of lead-205.[45]
- ^ Tetraphenyllead is even more thermally stable, decomposing at 270 °C.[86]
- ^ Abundances in the source are listed relative to silicon rather than in per-particle notation. The sum of all elements per 106 parts of silicon is 2.6682×1010 parts; lead comprises 3.258 parts.
- ^ Elemental abundance figures are estimates and their details may vary from source to source.[108]
- ^ Skutečnost, že Julius Caesar fathered only one child, as well as the alleged sterility of his successor, Caesar Augustus, have been attributed to lead poisoning.[140]
- ^ The nápis reads: "Made when the Emperor Vespasianus was consul for the ninth term and the Emperor Titus was consul for the seventh term, when Gnaeus Iulius Agricola was imperial governor (of Britain)."
- ^ Gaseous by-product of the coking process, containing kysličník uhelnatý, hydrogen and metan; used as a fuel.
- ^ Kalifornie began banning lead bullets for hunting on that basis in July 2015.[203]
- ^ For example, a firm "...producing quality [lead] garden ornament from our studio in West London for over a century".[210]
- ^ Potential injuries to regular users of such batteries are not related to lead's toxicity.[220]
- ^ Vidět[222] for details on how a lead–acid battery works.
- ^ Rates vary greatly by country.[242]
- ^ An alloy of mosaz (copper and zinc) with lead, iron, tin, and sometimes antimony.[289]
Reference
- ^ A b Meija et al. 2016.
- ^ Weast, Astle & Beyer 1983, str. E110.
- ^ Lide 2005, str. 10-179.
- ^ Pyykkö 1988, pp. 563–94.
- ^ Norman 1996, str. 36.
- ^ Greenwood & Earnshaw 1998, pp. 226–27, 374.
- ^ Christensen 2002, str. 867.
- ^ Slater 1964.
- ^ Considine & Considine 2013, pp. 501, 2970.
- ^ Parthé 1964, str. 13.
- ^ Sharma et al. 2013.
- ^ Sharma et al. 2014, str. 174710.
- ^ Peneva, Djuneva & Tsukeva 1981.
- ^ Greenwood & Earnshaw 1998, str. 372.
- ^ Greenwood & Earnshaw 1998, str. 372–73.
- ^ A b Thornton, Rautiu & Brush 2001, str. 6.
- ^ Lide 2005, pp. 12-35, 12-40.
- ^ Brenner 2003, str. 396.
- ^ Jones 2014, str. 42.
- ^ Lide 2005, pp. 4-13, 4-21, 4-33.
- ^ Vogel & Achilles 2013, str. 8.
- ^ Anderson 1869, str. 341–43.
- ^ Gale & Totemeier 2003, pp. 15–2–15–3.
- ^ Thornton, Rautiu & Brush 2001, str. 8.
- ^ A b Lide 2005, str. 12-219.
- ^ Willey 1999.
- ^ Lide 2005, str. 12-45.
- ^ Blakemore 1985, str. 272.
- ^ Webb, Marsiglio & Hirsch 2015.
- ^ A b C d E IAEA - Nuclear Data Section 2017.
- ^ University of California Nuclear Forensic Search Project.
- ^ A b Stone 1997.
- ^ de Marcillac et al. 2003, pp. 876–78.
- ^ World Nuclear Association 2015.
- ^ Beeman et al. 2013.
- ^ Radioactive Decay Series 2012.
- ^ Výbor pro hodnocení pokynů EPA pro expozici přirozeně se vyskytujícím radioaktivním materiálům a kol. 1999.
- ^ Smirnov, Borisevich a Sulaberidze 2012.
- ^ Greenwood & Earnshaw 1998, str. 368.
- ^ Levin 2009, s. 40–41.
- ^ Webb 2000, str. 115.
- ^ Wrackmeyer & Horchler 1990.
- ^ Cangelosi & Pecoraro 2015.
- ^ Fiorini 2010, s. 7–8.
- ^ Takahashi a kol. 1987.
- ^ Thürmer, Williams & Reutt-Robey 2002, str. 2033–35.
- ^ Tétreault, Sirois & Stamatopoulou 1998, s. 17–32.
- ^ Thornton, Rautiu & Brush 2001, s. 10–11.
- ^ A b C d E F Greenwood & Earnshaw 1998, str. 373.
- ^ Bretherick 2016, str. 1442.
- ^ Harbison, Bourgeois & Johnson 2015, str. 132.
- ^ A b Greenwood & Earnshaw 1998, str. 374.
- ^ Thornton, Rautiu & Brush 2001, s. 11–12.
- ^ Polyanskiy 1986, str. 20.
- ^ Kaupp 2014, s. 9–10.
- ^ Dieter & Watson 2009, str. 509.
- ^ Lov 2014, str. 215.
- ^ A b C Král 1995, str. 43–63.
- ^ Bunker a Casey 2016, str. 89.
- ^ Whitten, Gailey & David 1996, str. 904–5.
- ^ Greenwood & Earnshaw 1998, str. 384.
- ^ Greenwood & Earnshaw 1998, str. 387.
- ^ A b Greenwood & Earnshaw 1998, str. 389.
- ^ Zuckerman & Hagen 1989, str. 426.
- ^ Funke 2013.
- ^ A b Greenwood & Earnshaw 1998, str. 382.
- ^ Bharara & Atwood 2006, str. 4.
- ^ Greenwood & Earnshaw 1998, str. 388.
- ^ Toxikologický profil pro olovo 2007, str. 277.
- ^ Downs & Adams 2017, str. 1128.
- ^ Brescia 2012, str. 234.
- ^ Macintyre 1992, str. 3775.
- ^ Silverman 1966, str. 2067–69.
- ^ Greenwood & Earnshaw 1998, str. 381.
- ^ Yong, Hoffmann & Fässler 2006, str. 4774–78.
- ^ Becker a kol. 2008, str. 9965–78.
- ^ Mosseri, Henglein a Janata 1990, str. 2722–26.
- ^ Konu & Chivers 2011, str. 391–92.
- ^ Hadlington 2017, str. 59.
- ^ Greenwood & Earnshaw 1998, str. 384–86.
- ^ Röhr 2017.
- ^ Alsfasser 2007, str. 261–63.
- ^ Greenwood & Earnshaw 1998, str. 393.
- ^ Stabenow, Saak & Weidenbruch 2003.
- ^ A b Polyanskiy 1986, str. 43.
- ^ A b C d Greenwood & Earnshaw 1998, str. 404.
- ^ A b Wiberg, Wiberg & Holleman 2001, str. 918.
- ^ Toxikologický profil pro olovo 2007, str. 287.
- ^ Polyanskiy 1986, str. 44.
- ^ Windholz 1976.
- ^ Zýka 1966, str. 569.
- ^ A b C d Lodders 2003, s. 1222–23.
- ^ Roederer a kol. 2009, s. 1963–80.
- ^ Lochner, Rohrbach & Cochrane 2005, str. 12.
- ^ Lodders 2003, str. 1224.
- ^ Burbidge a kol. 1957, str. 608–615.
- ^ Burbidge a kol. 1957, str. 551.
- ^ Burbidge a kol. 1957, str. 608–609.
- ^ Burbidge a kol. 1957, str. 553.
- ^ Frebel 2015, str. 114–15.
- ^ Burbidge a kol. 1957, str. 608–610.
- ^ Burbidge a kol. 1957, str. 595.
- ^ Burbidge a kol. 1957, str. 596.
- ^ Burbidge a kol. 1957, str. 582, 609–615.
- ^ Langmuir & Broecker 2012, s. 183–184.
- ^ Davidson a kol. 2014, s. 4–5.
- ^ Emsley 2011, str. 286, passim.
- ^ Cox 1997, str. 182.
- ^ A b Davidson a kol. 2014, str. 4.
- ^ A b C d USA geologická služba 2017, str. 97.
- ^ Rieuwerts 2015, str. 225.
- ^ Merriam-Webster.
- ^ A b Kroonen 2013, * lauda-.
- ^ Nikolayev 2012.
- ^ Kroonen 2013, * bliwa- 2.
- ^ Kroonen 2013, * položiljan-.
- ^ A b C d Hong a kol. 1994, str. 1841–1843.
- ^ A b Rich 1994, str. 4.
- ^ A b C d E Winder 1993b.
- ^ Dějiny kosmetiky.
- ^ Yu a Yu 2004, str. 26.
- ^ Muzeum v Torontu zkoumá rok 2003.
- ^ Bisson & Vogel 2000, str. 105.
- ^ Rich 1994, str. 5.
- ^ United States Geological Survey 1973.
- ^ Olověná smyčka.
- ^ de Callataÿ 2005, str. 361–72.
- ^ Ceccarelli 2013, str. 35.
- ^ Kostnice a sarkofágy.
- ^ Calvo Rebollar, Miguel (2019). Construyendo la Tabla Periódica. Zaragoza, Španělsko: Prames. p. 45. ISBN 978-84-8321-908-9.
- ^ Rich 1994, str. 6.
- ^ Thornton, Rautiu & Brush 2001, str. 179–84.
- ^ Bisel & Bisel 2002, str. 459–60.
- ^ Retief & Cilliers 2006, str. 149–51.
- ^ Spárovací hmota 2017.
- ^ Eschnauer & Stoeppler 1992, str. 58.
- ^ Hodge 1981, str. 486–91.
- ^ Gilfillan 1965, str. 53–60.
- ^ Nriagu 1983, str. 660–63.
- ^ Frankenburg 2014, str. 16.
- ^ Scarborough 1984.
- ^ Waldron 1985, str. 107–08.
- ^ Reddy & Braun 2010, str. 1052.
- ^ Delile et al. 2014, str. 6594–99.
- ^ Prst 2006, str. 184.
- ^ Lewis 1985, str. 15.
- ^ Thornton, Rautiu & Brush 2001, str. 183.
- ^ Polyanskiy 1986, str. 8.
- ^ Thomson 1830, str. 74.
- ^ Oxfordský anglický slovník, surma.
- ^ Vasmer 1950, сурьма.
- ^ A b Winder 1993a.
- ^ A b Rich 1994, str. 7.
- ^ Kellett 2012, str. 106–07.
- ^ Rich 1994, str. 8.
- ^ Ede & Cormack 2016, str. 54.
- ^ Cotnoir 2006, str. 35.
- ^ Samson 1885, str. 388.
- ^ Sinha a kol. 1993.
- ^ A b Ramage 1980, str. 8.
- ^ Tungate 2011, str. 14.
- ^ Donnelly 2014, s. 171–172.
- ^ Ashikari 2003, str. 65.
- ^ Nakashima a kol. 1998, str. 59.
- ^ Rabinowitz 1995, str. 66.
- ^ Gill & Libraries Board of South Australia 1974, str. 69.
- ^ Bisson & Vogel 2000, str. 85.
- ^ Bisson & Vogel 2000, str. 131–32.
- ^ Těžba olova.
- ^ Rich 1994, str. 11.
- ^ A b C Riva a kol. 2012, s. 11–16.
- ^ Hernberg 2000, str. 246.
- ^ A b Vrána 2007.
- ^ Markowitz a Rosner 2000, str. 37.
- ^ More et al. 2017.
- ^ Americká geofyzikální unie 2017.
- ^ Centers for Disease Control and Prevention 1997.
- ^ Rich 1994, str. 117.
- ^ Rich 1994, str. 17.
- ^ Rich 1994, str. 91–92.
- ^ United States Geological Survey 2005.
- ^ Zhang a kol. 2012, str. 2261–73.
- ^ Tolliday 2014.
- ^ Guberman 2016, s. 42,14–15.
- ^ Graedel 2010.
- ^ A b C Thornton, Rautiu & Brush 2001, str. 56.
- ^ A b Davidson a kol. 2014, str. 6.
- ^ A b C d Davidson a kol. 2014, str. 17.
- ^ Thornton, Rautiu & Brush 2001, str. 51.
- ^ Davidson a kol. 2014, s. 11–12.
- ^ Thornton, Rautiu & Brush 2001, str. 51–52.
- ^ Davidson a kol. 2014, str. 25.
- ^ A b C d Rafinace primárního olova.
- ^ Pauling 1947.
- ^ Davidson a kol. 2014, str. 34.
- ^ Davidson a kol. 2014, str. 23.
- ^ Thornton, Rautiu & Brush 2001, str. 52–53.
- ^ United States Environmental Protection Agency 2010, str. 1.
- ^ A b Thornton, Rautiu & Brush 2001, str. 57.
- ^ Street & Alexander 1998, str. 181.
- ^ Evans 1908, str. 133–79.
- ^ Baird & Cann 2012, str. 537–38, 543–47.
- ^ Kalifornské ministerstvo pro ryby a divokou zvěř.
- ^ Parker 2005, str. 194–95.
- ^ Krestovnikoff & Halls 2006, str. 70.
- ^ Street & Alexander 1998, str. 182.
- ^ Jensen 2013, str. 136.
- ^ Think Lead research.
- ^ Zvětrávání na parapety.
- ^ Olověné zahradní ozdoby 2016.
- ^ Putnam 2003, str. 216.
- ^ Sdružení pro rozvoj mědi.
- ^ A b Rich 1994, str. 101.
- ^ Guruwamy 2000, str. 31.
- ^ Audsley 1965, str. 250–51.
- ^ Palmieri 2006, str. 412–13.
- ^ Národní rada pro radiační ochranu a měření 2004, s. 16.
- ^ Thornton, Rautiu & Brush 2001, str. 7.
- ^ Tuček, Carlsson & Wider 2006, str. 1590.
- ^ Univerzita Concordia 2016.
- ^ Toxikologický profil pro olovo 2007, s. 5–6.
- ^ Progressive Dynamics, Inc..
- ^ Olinsky-Paul 2013.
- ^ Gulbinska 2014.
- ^ Rich 1994, str. 133–34.
- ^ Zhao 2008, str. 440.
- ^ Beiner a kol. 2015.
- ^ Szczepanowska 2013, str. 84–85.
- ^ Burleson 2001, s. 23.
- ^ Insight Explorer a IPEN 2016.
- ^ Singh 2017.
- ^ Ismawati a kol. 2013, str. 2.
- ^ Zweifel 2009, str. 438.
- ^ Wilkes a kol. 2005, str. 106.
- ^ Randerson 2002.
- ^ Nriagu & Kim 2000, str. 37–41.
- ^ Amstock 1997, str. 116–19.
- ^ Rogalski 2010, str. 485–541.
- ^ „Olovo 695912“.
- ^ Světová zdravotnická organizace 2018.
- ^ Bouchard a kol. 2009.
- ^ Světová zdravotnická organizace 2000, str. 149–53.
- ^ Emsley 2011, str. 280, 621, 255.
- ^ A b Luckey & Venugopal 1979, str. 177–78.
- ^ Portál toxických látek.
- ^ United States Food and Drug Administration 2015, str. 42.
- ^ Národní institut pro bezpečnost a ochranu zdraví při práci.
- ^ A b Správa bezpečnosti a ochrany zdraví při práci.
- ^ A b Rudolph a kol. 2003, str. 369.
- ^ Dart, Hurlbut & Boyer-Hassen 2004, str. 1426.
- ^ Kosnett 2006, str. 238.
- ^ Cohen, Trotzky a Pincus 1981, str. 904–06.
- ^ Sokol 2005, str. 133, passim.
- ^ Mycyk, Hryhorczuk a Amitai 2005, str. 462.
- ^ Liu a kol. 2015, str. 1869–74.
- ^ Schoeters a kol. 2008, str. 168–75.
- ^ Casciani 2014.
- ^ Tarragó 2012, str. 16.
- ^ Toxikologický profil pro olovo 2007, str. 4.
- ^ Bremner 2002, str. 101.
- ^ Agentura pro toxické látky a registr nemocí.
- ^ Thornton, Rautiu & Brush 2001, str. 17.
- ^ Moore 1977, str. 109–15.
- ^ Wiberg, Wiberg & Holleman 2001, str. 914.
- ^ Tarragó 2012, str. 11.
- ^ Centra pro kontrolu a prevenci nemocí 2015.
- ^ Wani, Ara & Usman 2015, str. 57, 58.
- ^ Prasad 2010, str. 651–52.
- ^ Masters, Trevor a Katzung 2008, str. 481–83.
- ^ Program OSN pro životní prostředí 2010, str. 4.
- ^ A b Emise stopových prvků 2012.
- ^ Program OSN pro životní prostředí 2010, str. 6.
- ^ Assi a kol. 2016.
- ^ Světová zdravotnická organizace 1995.
- ^ UK Marine SACs Project 1999.
- ^ Program OSN pro životní prostředí 2010, str. 9.
- ^ McCoy 2017.
- ^ Cama 2017.
- ^ Layton 2017.
- ^ Hauser 2017, str. 49–60.
- ^ Lauwerys & Hoet 2001, str. 115, 116–117.
- ^ Auer a kol. 2016, str. 4.
- ^ Petzel, Juuti a Sugimoto 2004, s. 122–124.
- ^ Deltares a nizozemská organizace pro aplikovaný vědecký výzkum 2016.
- ^ Agentura pro toxické látky a registr nemocí 2017.
- ^ Grandjean 1978, str. 303–21.
- ^ A b Levin a kol. 2008, str. 1288.
- ^ Duda 1996, str. 242.
- ^ Marino a kol. 1990, str. 1183–85.
- ^ Schoch 1996, str. 111.
- ^ United States Environmental Protection Agency 2000.
- ^ Lead in Waste 2016.
- ^ United States Environmental Protection Agency 2005, str. I-1.
- ^ United States Environmental Protection Agency 2005, str. III-5 – III-6.
- ^ Freeman 2012, str. a20 – a21.
- ^ Mladý 2012.
- ^ Acton 2013, str. 94–95.
- ^ Park et al. 2011, s. 162–74.
Bibliografie
![]() Tento článek byl odeslán na adresu WikiJournal of Science pro externí akademické vzájemné hodnocení v roce 2019 (zprávy recenzenta ). Aktualizovaný obsah byl znovu integrován na stránku Wikipedie pod a CC-BY-SA-3.0 licence (2018 ). Verze záznamu v revidovaném znění je: Michail Boldyrev; et al. (3. července 2018), „Potenciální zákazníci: vlastnosti, historie a aplikace“ (PDF), WikiJournal of Science, 1 (2): 7, doi:10.15347 / WJS / 2018.007, ISSN 2470-6345, Wikidata Q56050531
Tento článek byl odeslán na adresu WikiJournal of Science pro externí akademické vzájemné hodnocení v roce 2019 (zprávy recenzenta ). Aktualizovaný obsah byl znovu integrován na stránku Wikipedie pod a CC-BY-SA-3.0 licence (2018 ). Verze záznamu v revidovaném znění je: Michail Boldyrev; et al. (3. července 2018), „Potenciální zákazníci: vlastnosti, historie a aplikace“ (PDF), WikiJournal of Science, 1 (2): 7, doi:10.15347 / WJS / 2018.007, ISSN 2470-6345, Wikidata Q56050531
- Acton, Q. A., ed. (2013). Problémy v globálním prostředí - znečištění a nakládání s odpady: vydání 2012. ScholarlyEditions. ISBN 978-1-4816-4665-9.
- Agentura pro toxické látky a registr nemocí. „Informace pro komunitu: Toxicita olova“ (MP4 webcast, 82 MB). Citováno 11. února 2017.
- Agentura pro toxické látky a registr nemocí (2017). „Toxicita olova. Jaké jsou americké standardy pro úrovně olova?“. Citováno 12. června 2018.
- Alsfasser, R. (2007). Moderne anorganische Chemie [Moderní anorganická chemie] (v němčině). Walter de Gruyter. ISBN 978-3-11-019060-1.
- Americká geofyzikální unie (2017). „Lidská činnost znečišťuje evropské ovzduší již 2000 let“. Eos Science News.
- Amstock, J. S. (1997). Příručka skla ve stavebnictví. McGraw-Hill Professional. ISBN 978-0-07-001619-4.
- Anderson, J. (1869). „Tvařitelnost a tažnost kovů“. Scientific American. 21 (22): 341–43. doi:10.1038 / scientificamerican11271869-341.
- Ashikari, M. (2003). „Vzpomínka na bílé tváře žen: japonská jedinečnost a ideální obraz žen“. Japonské fórum. 15 (1): 55–79. doi:10.1080/0955580032000077739. S2CID 144510689.
- Assi, M. A .; Hezmee, M. N. M .; Haron, A. W .; et al. (2016). „Škodlivé účinky olova na zdraví lidí a zvířat“. Veterinární svět. 9 (6): 660–671. doi:10.14202 / vetworld.2016.660-671. ISSN 0972-8988. PMC 4937060. PMID 27397992.
- Auer, Charles M .; Kover, Frank D .; Aidala, James V .; Greenwood, Mark (1. března 2016). Toxické látky: půl století pokroku (PDF) (Zpráva). Asociace absolventů EPA. Citováno 1. ledna 2019.
- Audsley, G. A. (1965). Umění stavět varhany. 2. Kurýr. ISBN 978-0-486-21315-6.
- Baird, C .; Cann, N. (2012). Chemie životního prostředí (5. vydání). W. H. Freeman and Company. ISBN 978-1-4292-7704-4.
- Becker, M .; Förster, C .; Franzen, C .; et al. (2008). "Trvalé radikály trojmocného cínu a olova". Anorganická chemie. 47 (21): 9965–78. doi:10.1021 / ic801198p. PMID 18823115.
- Beeman, J. W .; Bellini, F .; Cardani, L .; et al. (2013). "Nové experimentální limity pro α rozpad izotopů olova ". Evropský fyzický deník A. 49 (50): 50. arXiv:1212.2422. Bibcode:2013EPJA ... 49 ... 50B. doi:10.1140 / epja / i2013-13050-7. S2CID 119280082.
- Beiner, G. G .; Lavi, M .; Seri, H .; et al. (2015). „Oddy Tests: Adding the Analytical Dimension“. Fórum pro sběr. 29 (1–2): 22–36. doi:10.14351/0831-4985-29.1.22. ISSN 0831-4985.
- Bharara, M. S .; Atwood, D. A. (2006). „Lead: Anorganic Chemistry Založeno částečně na článku Lead: Anorganic Chemistry od Philipa G. Harrisona, který vyšel v Encyclopedia of Anorganic Chemistry, první vydání“. Vedení: Anorganická chemie. doi:10.1002 / 0470862106.ia118. ISBN 978-0470860786.
- Bisel, S. C.; Bisel, J. F. (2002). "Zdraví a výživa v Herculaneum". In Jashemski, W. F .; Meyer, F. G. (eds.). Přírodní historie Pompejí. Cambridge University Press. 451–75. ISBN 978-0-521-80054-9.
- Bisson, M. S .; Vogel, J. O. (2000). Ancient African Metallurgy: The Sociocultural Context. Rowman & Littlefield. ISBN 978-0-7425-0261-1.
- Blakemore, J. S. (1985). Fyzika pevných látek. Cambridge University Press. ISBN 978-0-521-31391-9.
- Bouchard, M. F .; Bellinger, D. C .; Weuve, J .; et al. (2009). „Úrovně olova v krvi a velká depresivní porucha, panická porucha a generalizovaná úzkostná porucha u mladých dospělých v USA“. Archiv obecné psychiatrie. 66 (12): 1313–9. doi:10.1001 / archgenpsychiatry.2009.164. ISSN 0003-990X. PMC 2917196. PMID 19996036.
- Bremner, H. A. (2002). Otázky bezpečnosti a kvality při zpracování ryb. Elsevier. ISBN 978-1-85573-678-8.
- Brenner, G. A. (2003). Příručka Webster's New World American Idioms Handbook. John Wiley & Sons. ISBN 978-0-7645-2477-6.
- Brescia, F. (2012). Základy chemie: moderní úvod. Elsevier. ISBN 978-0-323-14231-1.
- Bretherick, L. (2016). Bretherick's Handbook of Reactive Chemical Hazard. Elsevier. ISBN 978-1-4831-6250-8.
- Bunker, B. C .; Casey, W. H. (2016). Vodná chemie oxidů. Oxford University Press. ISBN 978-0-19-938425-9.
- Burbidge, E. M .; Burbidge, G. R .; Fowler, W. A .; et al. (1957). "Syntéza prvků ve hvězdách" (PDF). Recenze moderní fyziky. 29 (4): 547–654. Bibcode:1957RvMP ... 29..547B. doi:10.1103 / RevModPhys.29.547.
- Burleson, M. (2001). Příručka Keramická glazura: Materiály, techniky, vzorce. Sterling. ISBN 9781579904395.
- Kalifornské ministerstvo pro ryby a divokou zvěř. „Bezolovnatá munice v Kalifornii“. www.wildlife.ca.gov. Citováno 17. května 2017.
- de Callata, F. (2005). „Řecko-římská ekonomika ve velmi dlouhodobém horizontu: olovo, měď a vraky lodí“. Journal of Roman Archaeology. 18: 361–72. doi:10.1017 / S104775940000742X.
- Cama, T. (2017). „Ministr vnitra zrušil zákaz olověných střel“. Kopec. Citováno 30. května 2018.
- Cangelosi, V. M .; Pecoraro, V. L. (2015). "Vést". V Roduner, E. (ed.). Nanoskopické materiály: jevy závislé na velikosti a principy růstu. Royal Society of Chemistry. str. 843–875. ISBN 978-1-78262-494-3.
- Casciani, D. (2014). „Vyvolalo odstranění olova z benzínu pokles kriminality?“. BBC novinky. Citováno 30. ledna 2017.
- Ceccarelli, P. (2013). Starogrécké psaní dopisů: Kulturní historie (600 př. N. L. - 150 př. N. L.). OUP Oxford. ISBN 978-0-19-967559-3.
- Centra pro kontrolu a prevenci nemocí (1997). „Aktualizace: hladiny olova v krvi - USA, 1991–1994“. Týdenní zpráva o nemocnosti a úmrtnosti. 46 (7): 141–146. ISSN 0149-2195. PMID 9072671.
- Centra pro kontrolu a prevenci nemocí (2015). „Radiace a vaše zdraví“. Citováno 28. února 2017.
- Christensen, N. E. (2002). „Relativistická teorie pevných látek“. V Schwerdtfeger, P. (ed.). Teorie relativistické elektronické struktury - základy. Teoretická a výpočetní chemie. 11. Elsevier. str. 867–68. doi:10.1016 / s1380-7323 (02) 80041-3. ISBN 978-0-08-054046-7.
- Cohen, A. R .; Trotzky, M. S .; Pincus, D. (1981). „Přehodnocení mikrocytární anémie otravy olovem“. Pediatrie. 67 (6): 904–906. PMID 7232054.
- Výbor pro hodnocení pokynů EPA pro expozici přirozeně se vyskytujícím radioaktivním materiálům; Komise pro biologické vědy; Divize Země a životních studií; Národní rada pro výzkum (1999). Vyhodnocení pokynů pro expozice technologicky vylepšeným přirozeně se vyskytujícím radioaktivním materiálům. Národní akademie Press. 26, 30–32. ISBN 978-0-309-58070-0.
- Concordia University (2016). Olověné baterie (PDF) (Zpráva). Citováno 17. února 2019.
- Considine, D. M .; Considine, G. D. (2013). Van Nostrandova vědecká encyklopedie. Springer Science & Business Media. ISBN 978-1-4757-6918-0.
- Sdružení pro rozvoj mědi. „Olovnaté mědi“. Copper.org. Citováno 10. července 2016.
- Cotnoir, B. (2006). Weiser Stručný průvodce po alchymii. Weiser knihy. ISBN 978-1-57863-379-1.
- Cox, P. A. (1997). Prvky: jejich původ, hojnost a distribuce. Oxford University Press. ISBN 978-0-19-855298-7.
- Crow, J. M. (2007). „Proč používat olovo v barvách?“. Chemický svět. Royal Society of Chemistry. Citováno 22. února 2017.
- Dart, R. C .; Hurlbut, K. M .; Boyer-Hassen, L. V. (2004). "Vést". V Dart, R. C. (ed.). Lékařská toxikologie (3. vyd.). Lippincott Williams & Wilkins. p. 1426. ISBN 978-0-7817-2845-4.
- Davidson, A .; Ryman, J .; Sutherland, C. A .; et al. (2014). "Vést". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a15_193.pub3. ISBN 978-3-527-30673-2.
- de Marcillac, Pierre; Coron, Noël; Dambier, Gérard; et al. (2003). "Experimentální detekce α-částic z radioaktivního rozpadu přírodního vizmutu". Příroda. 422 (6934): 876–78. Bibcode:2003 Natur.422..876D. doi:10.1038 / nature01541. PMID 12712201. S2CID 4415582.
- Delile, H .; Blichert-Toft, J .; Goiran, J.-P .; et al. (2014). „Olovo ve vodách starověkého Říma“. Sborník Národní akademie věd. 111 (18): 6594–99. Bibcode:2014PNAS..111.6594D. doi:10.1073 / pnas.1400097111. ISSN 0027-8424. PMC 4020092. PMID 24753588.
- Deltares; Nizozemská organizace pro aplikovaný vědecký výzkum (2016). Dveřní jachta Lood en zinkemissies [Emise olova a zinku z lovu] (PDF) (Zpráva) (v holandštině). Citováno 18. února 2017.
- Dieter, R. K .; Watson, R. T. (2009). „Transmetalační reakce produkující organo měděné sloučeniny“. V Rappoport, Z .; Marek, I. (eds.). The Chemistry of Organocopper Compounds. 1. John Wiley & Sons. 443–526. ISBN 978-0-470-77296-6.
- Donnelly, J. (2014). Tmavě modrá. Dětská skupina Hachette. ISBN 978-1-4449-2119-9.
- Downs, A. J .; Adams, C. J. (2017). The Chemistry of Chlor, Bromine, Jod and Astatine: Pergamon Texts in Anorganic Chemistry. Elsevier. ISBN 978-1-4831-5832-7.
- Duda, M. B. (1996). Tradiční čínská přepíná: protizávaží a kouzla. Vydání Didier Millet. ISBN 978-981-4260-61-9.
- Ede, A .; Cormack, L. B. (2016). A History of Science in Society, Volume I: From the Ancient Greeks to the Scientific Revolution, Third Edition. University of Toronto Press. ISBN 978-1-4426-3503-6.
- Emsley, J. (2011). Nature's Building Blocks: A-Z Guide to the Elements. Oxford University Press. ISBN 978-0-19-960563-7.
- „Encyclopedia Judaica: Ossuaries and Sarcophagi“. www.jewishvirtuallibrary.org. Citováno 14. července 2018.
- Eschnauer, H. R .; Stoeppler, M. (1992). „Víno - enologická banka vzorků“. V Stoeppler, M. (ed.). Nebezpečné materiály v životním prostředí. Elsevierova věda. str. 49–72 (58). doi:10.1016 / s0167-9244 (08) 70103-3. ISBN 978-0-444-89078-8.
- Evans, J. W. (1908). „V.— Významy a synonyma slova plumbago“. Transakce filologické společnosti. 26 (2): 133–79. doi:10.1111 / j.1467-968X.1908.tb00513.x.
- Finger, S. (2006). Lékař Franklin's Medicine. University of Pennsylvania Press. ISBN 978-0-8122-3913-3.
- Fiorini, E. (2010). „2 000 let starý římský vedoucí pro fyziku“ (PDF). ASPERA: 7–8. Citováno 29. října 2016.
- Frankenburg, F. R. (2014). Lupiči mozku: Jak alkohol, kokain, nikotin a opiáty změnily historii člověka. ABC-CLIO. ISBN 978-1-4408-2932-1.
- Frebel, A. (2015). Hledání nejstarších hvězd: starověké relikvie z raného vesmíru. Univerzita Princeton. ISBN 978-0-691-16506-6.
- Freeman, K. S. (2012). „Sanace půdního olova rybími kostmi“. Perspektivy zdraví a životního prostředí. 120 (1): a20 – a21. doi:10,1289 / ehp.120-a20a. PMC 3261960. PMID 22214821.
- Funke, K. (2013). „Solid State Ionics: od Michaela Faradaye po zelenou energii - evropský rozměr“. Věda a technologie pokročilých materiálů. 14 (4): 1–50. Bibcode:2013STAdM..14d3502F. doi:10.1088/1468-6996/14/4/043502. PMC 5090311. PMID 27877585.
- Gale, W. F .; Totemeier, T. C. (2003). Smithells Metals Reference Book. Butterworth-Heinemann. ISBN 978-0-08-048096-1.
- Gilfillan, S. C. (1965). „Otrava olovem a pád Říma“. Journal of Occupational Medicine. 7 (2): 53–60. ISSN 0096-1736. PMID 14261844.
- Gill, T .; Rada knihoven jižní Austrálie (1974). Historie a topografie Glen Osmonda, s mapou a ilustracemi. Knihovní rada jižní Austrálie.
- Graedel, T. E.; et al. (2010). Zásoby kovů ve společnosti - vědecká syntéza (PDF) (Zpráva). Panel mezinárodních zdrojů. p. 17. ISBN 978-92-807-3082-1. Citováno 18. dubna 2017.
- Grandjean, P. (1978). "Rozšiřující se perspektivy toxicity olova". Výzkum životního prostředí. 17 (2): 303–21. Bibcode:1978ER ..... 17..303G. doi:10.1016/0013-9351(78)90033-6. PMID 400972.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Grout, J. (2017). „Otrava olovem a Řím“. Encyclopaedia Romana. Citováno 15. února 2017.
- Guberman, D. E. (2016). "Vést" (PDF). Ročenka minerálů 2014 (zpráva). Geologický průzkum Spojených států. Citováno 8. května 2017.
- Gulbinska, M. K. (2014). Materiály a technika pro lithium-iontové baterie: Aktuální témata a problémy z hlediska výroby. Springer. p. 96. ISBN 978-1-4471-6548-4.
- Guruswamy, S. (2000). Technické vlastnosti a aplikace slitin olova. Marcel Dekker. ISBN 978-0-8247-8247-4.
- Hadlington, T. J. (2017). O katalytické účinnosti komplexů skupiny 14 s nízkou oxidací. Springer. ISBN 978-3-319-51807-7.
- Harbison, R. D .; Bourgeois, M. M .; Johnson, G. T. (2015). Hamiltonova a Hardyova průmyslová toxikologie. John Wiley & Sons. ISBN 978-0-470-92973-5.
- Hauser, P. C. (2017). "Analytické metody pro stanovení olova v životním prostředí". In Astrid, S .; Helmut, S .; Sigel, R. K. O. (eds.). Olovo: jeho účinky na životní prostředí a zdraví. Kovové ionty v biologických vědách. 17. de Gruyter. str. 49–60. doi:10.1515/9783110434330-003. ISBN 9783110434330. PMID 28731296.
- Hernberg, S. (2000). „Otrava olovem v historické perspektivě“ (PDF). American Journal of Industrial Medicine. 38 (3): 244–54. doi:10.1002 / 1097-0274 (200009) 38: 3 <244 :: AID-AJIM3> 3.0.CO; 2-F. PMID 10940962. Citováno 1. března 2017.
- „Historie kosmetiky od starověku“. Kosmetické informace. Citováno 18. července 2016.
- Hodge, T. A. (1981). "Vitruvius, olověné trubky a otrava olovem". American Journal of Archaeology. 85 (4): 486–91. doi:10.2307/504874. JSTOR 504874.
- Hong, S .; Candelone, J.-P .; Patterson, C. C .; et al. (1994). „Grónské ledové důkazy o znečištění polokoulí olovem před dvěma tisíci lety řeckými a římskými civilizacemi“ (PDF). Věda. 265 (5180): 1841–43. Bibcode:1994Sci ... 265.1841H. doi:10.1126 / science.265.5180.1841. PMID 17797222. S2CID 45080402.
- Hunt, A. (2014). Slovník chemie. Routledge. ISBN 978-1-135-94178-9.
- IAEA - Sekce jaderných dat (2017). "Livechart - Tabulka nuklidů - Jaderná struktura a data rozpadu". www-nds.iaea.org. Mezinárodní agentura pro atomovou energii. Citováno 31. března 2017.
- Průzkumník Insight; IPEN (2016). Nová studie uvádí, že úrovně olova u většiny barev překračují čínskou regulaci a neměly by být na pultech obchodů (PDF) (Zpráva). Citováno 3. května 2018.
- Ismawati, Yuyun; Primanti, Andita; Brosché, Sara; Clark, Clark; Weinberg, Jack; Denney, Valerie (2013). Timbal dalam Cat Enamel Rumah Tangga di Indonésie (PDF) (Zpráva) (v indonéštině). BaliFokus a IPEN. Citováno 26. prosince 2018.
- Jensen, C. F. (2013). Online lokalizace poruch na AC kabelech v podzemním přenosu. Springer. ISBN 978-3-319-05397-4.
- Jones, P. A. (2014). Jedburgh Justice and Kentish Fire: The Origins of English in Ten Phrases and Expressions. Strážník. ISBN 978-1-47211-389-4.
- Kaupp, M. (2014). "Chemická vazba prvků hlavní skupiny" (PDF). In Frenking, G .; Shaik, S. (eds.). Chemická vazba: Chemická vazba napříč periodickou tabulkou. John Wiley & Sons. s. 1–24. doi:10.1002 / 9783527664658.ch1. ISBN 9783527664658. S2CID 17979350.
- Kellett, C. (2012). Jed a otrava: Kompendium případů, katastrof a zločinů. Přízvuk Stiskněte. ISBN 978-1-909335-05-9.
- King, R. B. (1995). Anorganická chemie prvků hlavní skupiny. Vydavatelé VCH. ISBN 978-1-56081-679-9.
- Konu, J .; Chivers, T. (2011). "Stabilní radikály těžkých prvků p-bloku". V Hicks, R. G. (ed.). Stabilní radikály: Základy a aplikované aspekty lichých elektronových sloučenin. John Wiley & Sons. doi:10.1002 / 9780470666975.ch10. ISBN 978-0-470-77083-2.
- Kosnett, M. J. (2006). "Vést". V Olson, K. R. (ed.). Otrava a předávkování drogami (5. vydání). McGraw-Hill Professional. p. 238. ISBN 978-0-07-144333-3.
- Krestovnikoff, M .; Halls, M. (2006). Potápění. Dorling Kindersley. ISBN 978-0-7566-4063-7.
- Kroonen, G. (2013). Etymologický slovník proto-germánský. Leiden Indo-European Etymological Dictionary Series. 11. Brill. ISBN 978-90-04-18340-7.
- Langmuir, C.H .; Broecker, W. S. (2012). Jak vybudovat obyvatelnou planetu: Příběh Země od velkého třesku po lidstvo. Princeton University Press. ISBN 978-0-691-14006-3.
- Lauwerys, R. R .; Hoet, P. (2001). Průmyslová chemická expozice: Pokyny pro biologické monitorování, třetí vydání. CRC Press. ISBN 978-1-4822-9383-8.
- Layton, M. (2017). „Vedení čelí hrozbě nového zákazu eura“. shootuk.co.uk. Citováno 30. května 2018.
- „Kulka olověného závěsu; mandlový tvar; okřídlená blesk na jedné straně a na druhé straně, s vysokým reliéfem, nápis DEXAI“ Chyťte!"". Britské muzeum. Citováno 30. dubna 2012.
- "Olověné zahradní ozdoby". H. Crowther Ltd.. 2016. Citováno 20. února 2017.
- „Olovo v likvidaci odpadu“. Agentura pro ochranu životního prostředí Spojených států. 2016. Citováno 28. února 2017.
- „Těžba olova“. Severní ozvěna. Citováno 16. února 2016.
- Levin, H. L. (2009). Země v čase. John Wiley & Sons. ISBN 978-0-470-38774-0.
- Levin, R .; Brown, M. J .; Kashtock, M. E.; et al. (2008). „Hlavní expozice u dětí v USA, 2008: Důsledky pro prevenci“. Perspektivy zdraví a životního prostředí. 116 (10): 1285–93. doi:10,1289 / ehp.11241. PMC 2569084. PMID 18941567.
- Lewis, J. (1985). „Otrava olovem: historická perspektiva“. EPA Journal. 11 (4): 15–18. Citováno 31. ledna 2017.
- Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (85. vydání). CRC Press. ISBN 978-0-8493-0484-2.
- Liu, J .; Liu, X .; Pak, V .; et al. (2015). „Časné hladiny olova v krvi a poruchy spánku v předplavectví“. Spát. 38 (12): 1869–74. doi:10,5655 / spánek.5230. PMC 4667382. PMID 26194570.
- Lochner, J. C .; Rohrbach, G .; Cochrane, K. (2005). „Jaké je vaše kosmické spojení s elementy?“ (PDF). Goddardovo vesmírné středisko. Archivovány od originál (PDF) dne 29. prosince 2016. Citováno 2. července 2017.
- Lodders, K. (2003). „Množství sluneční soustavy a teploty kondenzace prvků“ (PDF). Astrofyzikální deník. 591 (2): 1220–47. Bibcode:2003ApJ ... 591.1220L. doi:10.1086/375492. ISSN 0004-637X.
- Luckey, T. D .; Venugopal, B. (1979). Fyziologické a chemické základy toxicity kovů. Plenum Press. ISBN 978-1-4684-2952-7.
- Macintyre, J. E. (1992). Slovník anorganických sloučenin. CRC Press. ISBN 978-0-412-30120-9.
- Marino, P.E .; Landrigan, P. J .; Graef, J .; et al. (1990). „Případová zpráva o otravě olověnými barvami během renovace viktoriánského statku“. American Journal of Public Health. 80 (10): 1183–85. doi:10,2105 / AJPH.80.10.1183. PMC 1404824. PMID 2119148.
- Markowitz, G.; Rosner, D. (2000). ""Stravování dětem ": role vedoucího odvětví v tragédii veřejného zdraví, 1900–1955". American Journal of Public Health. 90 (1): 36–46. doi:10.2105 / ajph.90.1.36. PMC 1446124. PMID 10630135.
- Masters, S. B .; Trevor, A. J .; Katzung, B. G. (2008). Farmakologie společnosti Katzung & Trevor: Zkouška a přezkoumání komisí (8. vydání). McGraw-Hill Medical. ISBN 978-0-07-148869-3.
- McCoy, S. (2017). „Konec vedení? Federální vláda nezakazuje zakázky, munice“. GearJunkie. Citováno 30. května 2018.
- Meija, Juris; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)“. Čistá a aplikovaná chemie. 88 (3): 265–91. doi:10.1515 / pac-2015-0305.
- Merriam-Webster. „Definice LEAD“. www.merriam-webster.com. Citováno 12. srpna 2016.
- Moore, M. R. (1977). „Olovo v pitné vodě v oblastech s měkkou vodou - zdravotní rizika“. Věda o celkovém prostředí. 7 (2): 109–15. Bibcode:1977ScTEn ... 7..109M. doi:10.1016 / 0048-9697 (77) 90002-X. PMID 841299.
- Více, A. F .; Spaulding, N.E .; Bohleber, P .; et al. (2017). „Technologie nové generace ledového jádra odhaluje skutečnou minimální přirozenou hladinu olova (Pb) v atmosféře: Insights from the Black Death“ (PDF). GeoHealth. 1 (4): 211–219. doi:10.1002 / 2017GH000064. ISSN 2471-1403. PMC 7007106. PMID 32158988.
- Mosseri, S .; Henglein, A .; Janata, E. (1990). „Trojmocné olovo jako meziprodukt při oxidaci olova (II) a snižování obsahu olova (IV)“. Journal of Physical Chemistry. 94 (6): 2722–26. doi:10.1021 / j100369a089.
- Mycyk, M .; Hryhorczuk, D .; Amitai, Y .; et al. (2005). "Vést". In Erickson, T. B .; Ahrens, W. R .; Aks, S. (eds.). Pediatrická toxikologie: Diagnostika a léčba otráveného dítěte. McGraw-Hill Professional. ISBN 978-0-07-141736-5.
- Nakashima, T .; Hayashi, H .; Tashiro, H .; et al. (1998). „Pohlaví a hierarchické rozdíly v japonské kosti kontaminované olovem z období Edo“. Journal of Occupational Health. 40 (1): 55–60. doi:10,1539 / joh.40,55.
- Národní rada pro radiační ochranu a měření (2004). Návrh strukturálního stínění pro lékařské rentgenové zobrazovací zařízení. ISBN 978-0-929600-83-3.
- Národní institut pro bezpečnost a ochranu zdraví při práci. „NIOSH Kapesní průvodce chemickými nebezpečími - olovo“. www.cdc.gov. Citováno 18. listopadu 2016.
- Navas-Acien, A. (2007). „Expozice olovu a kardiovaskulární onemocnění - systematický přehled“. Perspektivy zdraví a životního prostředí. 115 (3): 472–482. doi:10,1289 / ehp.9785. PMC 1849948. PMID 17431501.
- Nikolayev, S., ed. (2012). „* lAudh-“. Indoevropská etymologie. špaček.rinet.ru. Citováno 21. srpna 2016.
- Norman, N. C. (1996). Periodicita a prvky s- a p-bloku. Oxford University Press. ISBN 978-0-19-855961-0.
- Nriagu, J. O. (1983). „Saturnská dna mezi římskými aristokraty - přispěla otrava olovem k pádu Impéria?“. The New England Journal of Medicine. 308 (11): 660–63. doi:10.1056 / NEJM198303173081123. PMID 6338384.
- Nriagu, J. O .; Kim, M-J. (2000). „Emise olova a zinku ze svíček s knoty s kovovým jádrem“. Věda o celkovém prostředí. 250 (1–3): 37–41. Bibcode:2000ScTEn.250 ... 37N. doi:10.1016 / S0048-9697 (00) 00359-4. PMID 10811249.
- Správa bezpečnosti a ochrany zdraví při práci. "Datový list látky pro expozici olovu na pracovišti". www.osha.gov. Archivovány od originál dne 16. března 2018. Citováno 1. července 2017.
- Olinsky-Paul, T. (2013). „Webinář o případové studii instalace baterií East Penn a Ecoult“ (PDF). Aliance států čisté energie. Citováno 28. února 2017.
- Palmieri, R., ed. (2006). Varhany. Psychologie Press. ISBN 978-0-415-94174-7.
- „surma“. Oxfordský anglický slovník (2. vyd.). Oxford University Press. 2009.
- Park, J. H .; Bolan, N .; Meghara, M .; et al. (2011). „Bakteriální imobilizace olova v půdě: důsledky pro sanaci“ (PDF). Pediatr: 162–74. Archivovány od originál (PDF) dne 26. listopadu 2015.
- Parker, R. B. (2005). Nová stavba lodí formovaná za studena: Od Loftingu po zahájení provozu. Knihy WoodenBoat. ISBN 978-0-937822-89-0.
- Parthé, E. (1964). Krystalová chemie čtyřbokých struktur. CRC Press. ISBN 978-0-677-00700-7.
- Pauling, L. (1947). Obecná chemie. W. H. Freeman and Company. ISBN 978-0-486-65622-9.
- Peneva, S.K .; Djuneva, K. D .; Tsukeva, E. A. (1981). "RHEED studie počátečních fází krystalizace a oxidace olova a cínu". Journal of Crystal Growth. 53 (2): 382–396. Bibcode:1981JCrGr..53..382P. doi:10.1016/0022-0248(81)90088-9. ISSN 0022-0248.
- Petzel, S .; Juuti, M .; Sugimoto, Yu. (2004). „Správcovství v oblasti životního prostředí s regionálními perspektivami a faktory vedoucí k bezolovnatému problému“. In Puttlitz, K. J .; Stalter, K.A. (eds.). Příručka bezolovnaté pájecí technologie pro mikroelektronické sestavy. CRC Press. ISBN 978-0-8247-5249-1.
- Polyanskiy, N. G. (1986). Fillipova, N. A (ed.). Аналитическая химия элементов: Свинец [Analytická chemie prvků: Olovo] (v Rusku). Nauka.
- Prasad, P. J. (2010). Koncepční farmakologie. Univerzity Press. ISBN 978-81-7371-679-9. Citováno 21. června 2012.
- „Technické poznámky k rafinaci primárního olova“. LDA International. Archivovány od originál dne 22. března 2007. Citováno 7. dubna 2007.
- Progressive Dynamics, Inc. „Jak fungují olověné baterie: základy baterií“. progressivedyn.com. Archivovány od originál dne 19. listopadu 2018. Citováno 3. července 2016.
- Putnam, B. (2003). The Sculptor's Way: A Guide to Modeling and Sculpture. Dover Publications. ISBN 978-0-486-42313-5.
- Pyykkö, P. (1988). "Relativistické účinky ve strukturní chemii". Chemické recenze. 88 (3): 563–94. doi:10.1021 / cr00085a006.
- Rabinowitz, M. B. (1995). „Vyčítání zdrojů olova z poměru izotopů olova v krvi“. In Beard, M. E .; Allen Iske, S. D. (eds.). Olovo v barvách, půdě a prachu: zdravotní rizika, studie expozice, kontrolní opatření, metody měření a zajištění kvality. ASTM. str. 63–75. doi:10,1520 / stp12967s. ISBN 978-0-8031-1884-3.
- "Série radioaktivního rozpadu" (PDF). Jaderná systematika. MIT OpenCourseWare. 2012. Citováno 28. dubna 2018.
- Ramage, C. K., ed. (1980). Lyman Cast Bullet Handbook (3. vyd.). Lyman Products Corporation.
- Randerson, J. (2002). "Znečištění svíčkami". Nový vědec (2348). Citováno 7. dubna 2007.
- Reddy, A .; Braun, C. L. (2010). „Olovo a Římané“. Journal of Chemical Education. 87 (10): 1052–55. Bibcode:2010JChEd..87.1052R. doi:10.1021 / ed100631y.
- Retief, F .; Cilliers, L. P. (2006). „Otrava olovem ve starém Římě“. Acta Theologica. 26 (2): 147–64 (149–51). doi:10,4314 / actat.v26i2,52570.
- Rich, V. (1994). Mezinárodní olověný obchod. Woodhead Publishing. ISBN 978-0-85709-994-5.
- Rieuwerts, J. (2015). Prvky znečištění životního prostředí. Routledge. ISBN 978-0-415-85919-6.
- Riva, M. A .; Lafranconi, A .; d'Orso, M. I .; et al. (2012). „Otrava olovem: Historické aspekty paradigmatického“ onemocnění z povolání a životního prostředí"". Bezpečnost a ochrana zdraví při práci. 3 (1): 11–16. doi:10.5491 / SHAW.2012.3.1.11. PMC 3430923. PMID 22953225.
- Roederer, I.U .; Kratz, K.-L .; Frebel, A .; et al. (2009). „Konec nukleosyntézy: Produkce olova a thoria v časné galaxii“. Astrofyzikální deník. 698 (2): 1963–80. arXiv:0904.3105. Bibcode:2009ApJ ... 698.1963R. doi:10.1088 / 0004-637X / 698/2/1963. S2CID 14814446.
- Rogalski, A. (2010). Infračervené detektory (2. vyd.). CRC Press. ISBN 978-1-4200-7671-4. Citováno 19. listopadu 2016.
- Röhr, C. (2017). „Binare Zintl-Phasen“ [Binární Zintl fáze]. Intermetallische Phasen [Intermetalické fáze] (v němčině). Universitat Freiburg. Citováno 18. února 2017.
- Rudolph, A. M .; Rudolph, C. D .; Hostetter, M. K .; et al. (2003). "Vést". Rudolphova pediatrie (21. vydání). McGraw-Hill Professional. p. 369. ISBN 978-0-8385-8285-5.
- Samson, G. W. (1885). Božský zákon o vínech. J. B. Lippincott & Co.
- Scarborough, J. (1984). „Mýtus o otravě olovem mezi Římany: recenze eseje“. Journal of the History of Medicine and Allied Sciences. 39 (4): 469–475. doi:10.1093 / jhmas / 39.4.469. PMID 6389691.
- Schoch, R. M. (1996). Případové studie ve vědě o životním prostředí. West Publishing. ISBN 978-0-314-20397-7.
- Schoeters, G .; Den Hond, E .; Dhooge, W .; et al. (2008). "Endokrinní disruptory a abnormality pubertálního vývoje" (PDF). Základní a klinická farmakologie a toxikologie. 102 (2): 168–175. doi:10.1111 / j.1742-7843.2007.00180.x. hdl:1854 / LU-391408. PMID 18226071.
- Sharma, H. R.; Nozawa, K .; Smerdon, J. A .; et al. (2013). „Templated trojrozměrný růst kvazikrystalického olova“. Příroda komunikace. 4: 2715. Bibcode:2013NatCo ... 4.2715S. doi:10.1038 / ncomms3715. PMID 24185350.
- Sharma, H. R.; Smerdon, J. A .; Nugent, P. J .; et al. (2014). „Krystalické a kvazikrystalické allotropy Pb vytvořené na pětinásobném povrchu ikosaedrického Ag-In-Yb“. The Journal of Chemical Physics. 140 (17): 174710. Bibcode:2014JChPh.140q4710S. doi:10.1063/1.4873596. PMID 24811658.
- Silverman, M. S. (1966). „Vysokotlaká (70 k) syntéza nových krystalických olovnatých dichalkogenidů“. Anorganická chemie. 5 (11): 2067–69. doi:10.1021 / ic50045a056.
- Singh, P. (2017). „U více než 73% barev bylo zjištěno, že mají nadměrné olovo: Studie“. Časy Indie. Citováno 3. května 2018.
- Sinha, S. P .; Skořápkový; Sharma, V .; et al. (1993). "Neurotoxické účinky expozice olovu mezi pracovníky tisku". Věstník znečištění životního prostředí a toxikologie. 51 (4): 490–93. doi:10.1007 / BF00192162. PMID 8400649. S2CID 26631583.
- Slater, J. C. (1964). "Atomové poloměry v krystalech". The Journal of Chemical Physics. 41 (10): 3199–3204. Bibcode:1964JChPh..41.3199S. doi:10.1063/1.1725697. ISSN 0021-9606.
- Smirnov, A. Yu .; Borisevich, V. D .; Sulaberidze, A. (2012). „Vyhodnocení specifických nákladů na získání izotopu olova-208 plynovými odstředivkami s použitím různých surovin“. Teoretické základy chemického inženýrství. 46 (4): 373–78. doi:10.1134 / s0040579512040161. S2CID 98821122.
- Sokol, R. C. (2005). „Expozice olovu a její účinky na reprodukční systém“. V Golub, M. S. (ed.). Kovy, plodnost a reprodukční toxicita. CRC Press. 117–53. doi:10.1201 / 9781420023282.ch6. ISBN 978-0-415-70040-5.
- Stabenow, F .; Saak, W .; Weidenbruch, M. (2003). „Tris (triphenylplumbyl) instalatér: Anion se třemi nataženými vazbami olovo-olovo“. Chemická komunikace (18): 2342–2343. doi:10.1039 / B305217F. PMID 14518905.
- Kámen, R. (1997). "Prvek stability". Věda. 278 (5338): 571–572. Bibcode:1997Sci ... 278..571S. doi:10.1126 / science.278.5338.571. S2CID 117946028.
- Street, A .; Alexander, W. (1998). Kovy ve službách člověka (11. vydání). Knihy tučňáků. ISBN 978-0-14-025776-2.
- Szczepanowska, H. M. (2013). Zachování kulturního dědictví: klíčové zásady a přístupy. Routledge. ISBN 978-0-415-67474-4.
- Takahashi, K .; Boyd, R. N .; Mathews, G. J .; et al. (1987). „Beta rozpad vázaného stavu vysoce ionizovaných atomů“ (PDF). Fyzický přehled C.. 36 (4): 1522–1528. Bibcode:1987PhRvC..36.1522T. doi:10.1103 / fyzrevc.36.1522. OCLC 1639677. PMID 9954244. Archivovány od originál (PDF) dne 21. října 2014. Citováno 27. srpna 2013.
- Tarragó, A. (2012). „Případové studie v environmentální medicíně (CSEM) toxicita olova“ (PDF). Agentura pro toxické látky a registr nemocí.
- Tétreault, J .; Sirois, J .; Stamatopoulou, E. (1998). "Studie koroze olova v prostředí kyseliny octové". Studie o ochraně přírody. 43 (1): 17–32. doi:10.2307/1506633. JSTOR 1506633.
- „Shrnutí výzkumu Think Lead“ (PDF). Sdružení Lead Sheet. Citováno 20. února 2017.
- Thomson, T. (1830). Dějiny chemie. Henry Colburn a Richard Bentley (vydavatelé).
- Thornton, I .; Rautiu, R .; Brush, S. M. (2001). Olovo: Fakta (PDF). Mezinárodní vedoucí asociace. ISBN 978-0-9542496-0-1. Citováno 5. února 2017.
- Thürmer, K .; Williams, E .; Reutt-Robey, J. (2002). „Autokatalytická oxidace povrchů olovnatého krystalu“. Věda. 297 (5589): 2033–35. Bibcode:2002Sci ... 297.2033T. doi:10.1126 / science.297.5589.2033. PMID 12242437. S2CID 6166273.
- Tolliday, B. (2014). „Významný růst využití olova podtrhuje jeho význam pro globální ekonomiku“. Mezinárodní vedoucí asociace. Citováno 28. února 2017.
Celosvětová poptávka po olovu se od počátku 90. let více než zdvojnásobila a téměř 90% využití se nyní používá v olověných bateriích
- „Muzeum v Torontu zkoumá historii antikoncepce“. ABC News. 2003. Citováno 13. února 2016.
- „Portál toxických látek - olovo“. Agentura pro toxické látky a registr nemocí. Archivovány od originál dne 6. června 2011.
- „Toxikologický profil olova“ (PDF). Agentura pro toxické látky a registr nemocí / Oddělení toxikologie a environmentální medicíny. 2007. Archivovány od originál (PDF) dne 1. července 2017.
- „Emise stopových prvků z uhlí“. IEA Clean Coal Center. 2012. Citováno 1. března 2017.
- Tuček, K .; Carlsson, J .; Širší, H. (2006). „Srovnání sodíkových a olovem chlazených rychlých reaktorů s ohledem na fyzikální aspekty reaktoru, závažné bezpečnostní a ekonomické problémy“ (PDF). Jaderné inženýrství a design. 236 (14–16): 1589–98. doi:10.1016 / j.nucengdes.2006.04.019.
- Tungate, M. (2011). Značková krása: Jak marketing změnil náš vzhled. Vydavatelé stránek Kogan. ISBN 978-0-7494-6182-9.
- UK Marine SACs Project (1999). "Vést". Kvalita vody (zpráva). Citováno 10. června 2018.
- Program OSN pro životní prostředí (2010). Závěrečný přehled vědeckých informací o olovu (PDF). Chemické odvětví, divize technologie, průmyslu a ekonomiky. Citováno 31. ledna 2017.
- United States Environmental Protection Agency (2010). „Metalurgický průmysl: Sekundární zpracování olova“. AP 42 Kompilace emisních faktorů znečišťujících ovzduší (5. vydání). Citováno 20. května 2018.
- United States Environmental Protection Agency (2000). „Regulační stav odpadu vytvářeného dodavateli a obyvateli z nátěrových barev na bázi olova prováděných v domácnostech (srpen 2000)“. Citováno 28. února 2017.
- United States Environmental Protection Agency (2005). „Nejlepší postupy řízení pro vedení na střelnicích pro venkovní střelbu“ (PDF). Citováno 12. června 2018.
- United States Food and Drug Administration (2015). Pokyny pro elementární nečistoty Q3D pro průmysl (PDF) (Zpráva). Ministerstvo zdravotnictví a sociálních služeb USA. p. 41. Citováno 15. února 2017.
- Geologický průzkum Spojených států (1973). Odborný referát o geologickém průzkumu. Vládní vydavatelský úřad Spojených států. p. 314.
- United States Geological Survey (2005). Vést (PDF) (Zpráva). Citováno 20. února 2016.
- Geologická služba USA (2017). "Vést" (PDF). Souhrny minerálních komodit. Citováno 8. května 2017.
- University of California Projekt jaderného forenzního vyhledávání. "Řetězy rozpadu". Nukleární forenzní: Problém vědeckého hledání. Citováno 23. listopadu 2015.
- Vasmer, M. (1986–1987) [1950–1958]. Trubachyov, O. N.; Larin, B. O. (eds.). Этимологический словарь русского языка [Russisches etymologisches Worterbuch] (v ruštině) (2. vydání). Pokrok. Citováno 4. března 2017.
- Vogel, N. A .; Achilles, R. (2013). Konzervace a opravy historických vitráží a olovnatého skla (PDF) (Zpráva). Ministerstvo vnitra Spojených států. Citováno 30. října 2016.
- Waldron, H. A. (1985). "Olovo a otrava olovem ve starověku". Zdravotní historie. 29 (1): 107–08. doi:10.1017 / S0025727300043878. PMC 1139494.
- Wani, A. L .; Ara, A .; Usman, J. A. (2015). „Toxicita olova: recenze“. Interdisciplinární toxikologie. 8 (2): 55–64. doi:10.1515 / intox-2015-0009. PMC 4961898. PMID 27486361.
- Weast, R. C .; Astle, M. J .; Beyer, W. H. (1983). CRC Handbook of Chemistry and Physics: A Ready-reference Book of Chemical and Physical Data. CRC Press. ISBN 978-0-8493-0464-4.
- „Zvětrávání parapetů a říms“. Sdružení Lead Sheet. Citováno 20. února 2017.
- Webb, G. A. (2000). Jaderná magnetická rezonance. Royal Society of Chemistry. ISBN 978-0-85404-327-9.
- Webb, G. W .; Marsiglio, F .; Hirsch, J. E. (2015). "Supravodivost v prvcích, slitinách a jednoduchých sloučeninách". Physica C: Supravodivost a její aplikace. 514: 17–27. arXiv:1502.04724. Bibcode:2015PhyC..514 ... 17W. doi:10.1016 / j.physc.2015.02.037. S2CID 119290828.
- Whitten, K. W .; Gailey, K. D .; David, R. E. (1996). Obecná chemie s kvalitativní analýzou (3. vyd.). Saunders College. ISBN 978-0-03-012864-6.
- Wiberg, E .; Wiberg, N .; Holleman, A. F. (2001). Anorganická chemie. Akademický tisk. ISBN 978-0-12-352651-9.
- Wilkes, C. E.; Summers, J. W .; Daniels, C. A .; et al. (2005). Příručka z PVC. Hanser. ISBN 978-1-56990-379-7.
- Willey, D. G. (1999). „Fyzika za čtyřmi úžasnými demonstracemi - CSI“. Skeptický tazatel. 23 (6). Citováno 6. září 2016.
- Winder, C. (1993a). „Historie olova - 1. část“. VEDTE akční zprávy. 2 (1). ISSN 1324-6011. Archivovány od originál dne 31. srpna 2007. Citováno 5. února 2016.
- Winder, C. (1993b). „Historie olova - 3. část“. VEDTE akční zprávy. 2 (3). ISSN 1324-6011. Archivovány od originál dne 31. srpna 2007. Citováno 12. února 2016.
- Windholz, M. (1976). Merck Index of Chemicals and Drug (9. vydání). Merck & Co. ISBN 978-0-911910-26-1. Monografie 8393.
- Světová zdravotnická organizace (1995). Kritéria pro ochranu životního prostředí 165: Anorganic Lead (Zpráva). Citováno 10. června 2018.
- Světová zdravotnická organizace (2000). "Vést" (PDF). Pokyny pro kvalitu ovzduší pro Evropu. Regionální kancelář pro Evropu. str.149–53. ISBN 978-92-890-1358-1. OCLC 475274390.
- Světová zdravotnická organizace (2018). „Otrava olovem a zdraví“. Citováno 17. února 2019.
- Světová jaderná asociace (2015). „Jaderné záření a účinky na zdraví“. Citováno 12. listopadu 2015.
- Wrackmeyer, B .; Horchler, K. (1990). 207Parametry Pb-NMR. Výroční zprávy o NMR spektroskopii. 22. Akademický tisk. 249–303. doi:10.1016 / S0066-4103 (08) 60257-4. ISBN 978-0-08-058405-8.
- Yong, L .; Hoffmann, S. D .; Fässler, T. F. (2006). „Nízkodimenzionální uspořádání [Pb9]4· shluky v [K (18-crown-6)]2K.2Pb9· (Cs)1.5". Anorganica Chimica Acta. 359 (15): 4774–78. doi:10.1016 / j.ica.2006.04.017.
- Young, S. (2012). „Bojujeme s kontaminací olovem, jedna rybí kost po druhé“. Kompas. Pobřežní stráž Spojených států. Citováno 11. února 2017.
- Yu, L .; Yu, H. (2004). Čínské mince: Peníze v historii a společnosti. Long River Press. ISBN 978-1-59265-017-0.
- Zhang, X .; Yang, L .; Li, Y .; et al. (2012). „Dopady těžby a tavení olova / zinku na životní prostředí a lidské zdraví v Číně“. Monitorování a hodnocení životního prostředí. 184 (4): 2261–73. doi:10.1007 / s10661-011-2115-6. PMID 21573711. S2CID 20372810.
- Zhao, F. (2008). Podnikání v oblasti informačních technologií a inovace. IGI Global. p. 440. ISBN 978-1-59904-902-1.
- Zuckerman, J. J .; Hagen, A. P. (1989). Anorganické reakce a metody, tvorba vazeb k halogenům. John Wiley & Sons. ISBN 978-0-471-18656-4.
- Zweifel, H. (2009). Příručka o přísadách do plastů. Hanser. ISBN 978-3-446-40801-2.
- Zýka, J. (1966). „Analytická studie základních vlastností tetraacetátu olova jako oxidačního činidla“. Čistá a aplikovaná chemie. 13 (4): 569–81. doi:10.1351 / pac196613040569. S2CID 96821219. Citováno 2. března 2017.
Další čtení
- Astrid, S .; Helmut, S .; Sigel, R. K. O., eds. (2017). Olovo: jeho účinky na životní prostředí a zdraví. Kovové ionty v biologických vědách. 17. De Gruyter. ISBN 978-3-11-044107-9. Obsah
- Casas, J. S .; Sordo, J., eds. (2006). Chemie olova, analytické aspekty. Dopady na životní prostředí a účinky na zdraví. Elsevier. ISBN 978-0-444-52945-9.



