Oxid fosforečný - Phosphorus trioxide
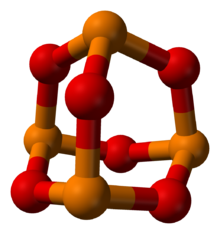 Fosfor v oranžové barvě, kyslík v červené barvě | |
 | |
| Jména | |
|---|---|
| Ostatní jména | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.032.414 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| P4Ó6 | |
| Molární hmotnost | 219,88 g mol−1 |
| Vzhled | bezbarvé monoklinické krystaly nebo kapalina |
| Hustota | 2,135 g / cm3 |
| Bod tání | 23,8 ° C (74,8 ° F; 296,9 K) |
| Bod varu | 173,1 ° C (343,6 ° F; 446,2 K) |
| reaguje | |
| Kyselost (strK.A) | 9.4 |
| Struktura | |
| Viz text | |
| 0 | |
| Nebezpečí | |
Klasifikace EU (DSD) (zastaralý) | Toxický (T +) |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
jiný anionty | Trisulfid fosforečný |
jiný kationty | Oxid dusný Oxid arsenitý Oxid antimonitý |
Související sloučeniny | Oxid fosforečný Kyselina fosforečná |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Oxid fosforečný je chemická sloučenina s molekulárním vzorcem P4Ó6. Ačkoli molekulární vzorec naznačuje název hexoxid tetraposforečný, název oxid fosforečný předcházel znalost molekulární struktury sloučeniny a jeho použití pokračuje dodnes. Tato bezbarvá pevná látka strukturně souvisí s adamantan. Je to formálně anhydrid z kyselina fosforitá, H3PO3, ale nelze je získat dehydratací kyseliny. Je to bílá, voskovitá, krystalická a vysoce toxická pevná látka s česnekovým zápachem.[1]
Příprava
Získává se spalováním fosforu v omezeném přívodu vzduchu při nízké teplotě.
- P4 + 3 O.2 → P4Ó6
Mezi vedlejší produkty patří suboxid červeného fosforu.[1]
Chemické vlastnosti
Oxid fosforečný reaguje s vodou za vzniku kyselina fosforitá, což odráží skutečnost, že se jedná o anhydrid této kyseliny.[2]
- P4Ó6 + 6 hodin2O → 4 H3PO3
Reaguje s chlorovodík tvořit H3PO3 a chlorid fosforitý.
- P4Ó6 + 6 HCl → 2 H3PO3 + 2 ks3
S chlorem nebo bromem tvoří odpovídající fosforylhalogenid, a reaguje s jódem v uzavřené zkumavce za vzniku difosforečný tetrajodid.[1]
P4Ó6 reaguje s ozón při 195 K za vzniku nestabilní sloučeniny P4Ó18.[3]
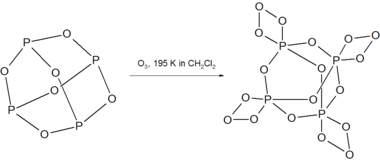
P4Ó18 rozkládá se nad 238 K v roztoku uvolňováním O2 plyn. Rozklad suchého P4Ó18 je výbušný.
V disproporční reakce, P4Ó6 se převádí na smíšený druh P (III) P (V) P4Ó8 při zahřátí v uzavřené zkumavce na 710 K, přičemž vedlejším produktem je červený fosfor.[3]
Jako ligand
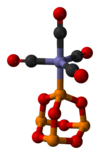
P4Ó6 je ligand pro přechodné kovy, srovnatelný s fosfit. Ilustrativním komplexem je P4Ó6· Fe (CO)4.[4] S BH3 se vyrábí dimerní adukt:[3]
 Struktura P8Ó12(BH3)2.
Struktura P8Ó12(BH3)2.
Reference
- ^ A b C A. F. Holleman; Wiberg, Egon; Wiberg, Nils (2001). Anorganická chemie. Boston: Academic Press. ISBN 0-12-352651-5.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ A b C .Catherine E. Housecroft; Alan G. Sharpe (2008). "Kapitola 15: Skupina 15 prvků". Anorganic Chemistry, 3. vydání. Pearson. p. 473. ISBN 978-0-13-175553-6.
- ^ M. Jansen & J. Clade (listopad 1996). „Tetracarbonyl (tetraphosphorhexaoxide) železo“. Acta Crystallogr. C. 52 (11): 2650–2652. doi:10.1107 / S0108270196004398.


