Kyselina peroxynitrous - Peroxynitrous acid
tento článek potřebuje další citace pro ověření. (Leden 2007) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
 | |
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Kyselina peroxynitrous[Citace je zapotřebí ] | |
| Systematický název IUPAC | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| 49207 | |
| Pletivo | Peroxynitrous + kyselina |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
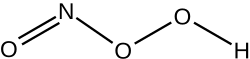
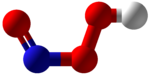
| NHO 3 | |
| Molární hmotnost | 63,0128 g mol−1 |
| Konjugovaná základna | Peroxynitrit |
| Související sloučeniny | |
Související sloučeniny | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Kyselina peroxynitrous (HNO3) je reaktivní druhy dusíku (RNS). To je konjugovaná kyselina z peroxynitrit (ONOO−). Má to pK.A přibližně 6,8. Je vytvořen in vivo z reakce řízené difúzí oxid uhelnatý (NA•) a superoxid (Ó•−
2). Je to izomer z kyselina dusičná a izomerizuje s a rychlostní konstanta z k = 1,2 s−1způsob, při kterém může vznikat až 5% hydroxylových a oxidových radikálů. Oxiduje a dusičnany aromatické sloučeniny v nízkém výtěžku. Mechanismus může zahrnovat komplex mezi aromatickou sloučeninou a ONOOH a přechod z cis- do trans-konfigurace ONOOH.[3] Kyselina peroxynitrous je také důležitá v atmosférická chemie.
Reference
- ^ N.Connelly a T. Damhus, IUPAC. Nomenklatura anorganické chemie, RSC Publishing, Cambridge, 2005
- ^ "Peroxynitrous Acid - Compound Summary". PubChem Compound. USA: Národní centrum pro biotechnologické informace. 16. září 2004. Identifikace a související záznamy. Citováno 11. dubna 2012.
- ^ Koppenol, W. H .; Bounds, P.L .; Nauser, T .; Kissner, R .; Rüegger, H. (2012). „Kyselina peroxynitrous: kontroverze a shoda kolem záhadného oxidantu“. Daltonské transakce. 41: 13779–13787.
