Oxid niobnatý - Niobium monoxide
 | |
| Jména | |
|---|---|
| Ostatní jména oxid niobičitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.031.631 |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| NbO | |
| Molární hmotnost | 108,905 g / mol[1] |
| Vzhled | šedá plná[1] |
| Zápach | bez zápachu |
| Hustota | 7,30 gcm3[1] |
| Bod tání | 1,937 ° C (3,519 ° F; 2,210 K)[1] |
| Rozpustnost | málo rozpustný v HCl nerozpustný v kyselina dusičná |
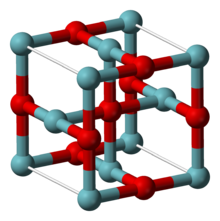
| Struktura[2] | |
| Krychlový, cP6 | |
| Odpoledne3m, č. 221 | |
A = 0,4211 nm | |
Jednotky vzorce (Z) | 3 |
| Termochemie[3] | |
Tepelná kapacita (C) | 41,3 J / (mol · K) |
Std molární entropie (S | 48,1 J / (mol · K) |
Std entalpie of formace (ΔFH⦵298) | = -405,85 kJ / mol |
Gibbsova volná energie (ΔFG˚) | -378,6 kJ / mol |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Oxid niobnatý je anorganická sloučenina s vzorec PoznÓ. Je to šedá pevná látka s kovovou vodivostí.[1]
Struktura a elektronické vlastnosti
NbO přijímá neobvyklou kubickou strukturu, podobnou struktuře kamenné soli, ale s některými chybějícími atomy ve srovnání s ní, takže atomy niobu i kyslíku mají čtvercovou rovinnou koordinační geometrii. Centra niobu jsou uspořádána v oktaedru a existuje strukturální podobnost s oktaedrickými shluky niobu v nižších halogenidech niobu. V NbO je délka vazby Nb-Nb 298 pm, což je ve srovnání s 285 pm v kovu.[2] Jedna studie vazby dospěla k závěru, že mezi kovovými centry existují silné a téměř kovalentní vazby.[4]
Jedná se o supravodič s přechodovou teplotou 1,38 K.[5] Používá se v kondenzátorech, kde je vrstva Pozn2Ó5 se tvoří kolem NbO zrn jako dielektrikum.[6][7][8]
Příprava
NbO lze připravit redukcí Pozn2Ó5 podle H.2. Typičtěji jej připravuje úměrnost:[9]
- Pozn2Ó5 + 3 Nb → 5 NbO
Reference
- ^ A b C d E Haynes, str. 4,76
- ^ A b Pialoux, A .; Joyeux, M.L .; Cizeron, G. (1982). „Étude du comportement du niobium sous vide par diffraction des rayons X à haute température“. Journal of the Less Common Metals. 87: 1–19. doi:10.1016/0022-5088(82)90036-4.
- ^ Haynes, str. 5.29
- ^ Schulz, Werner W .; Wentzcovitch, Renata M. (1993). "Elektronická struktura pásma a propojení v Nb3Ó3". Fyzický přehled B. 48 (23): 16986. Bibcode:1993PhRvB..4816986S. doi:10.1103 / PhysRevB.48.16986. PMID 10008298.
- ^ Hulm, J. K .; Jones, C. K .; Hein, R. A .; Gibson, J. W. (1972). "Supravodivost v systémech TiO a NbO". Žurnál fyziky nízkých teplot. 7 (3–4): 291–307. Bibcode:1972JLTP .... 7..291H. doi:10.1007 / BF00660068.
- ^ Nico, C .; Soares, M. R. N .; Rodrigues, J .; Matos, M .; Monteiro, R .; Graça, M. P. F .; Valente, M. A .; Costa, F. M .; Monteiro, T. (2011). "Sintrované prášky NbO pro aplikace elektronických zařízení". The Journal of Physical Chemistry C. 115 (11): 4879–4886. doi:10.1021 / jp110672u.
- ^ „NbO / Nb2Ó5 jádro – skořápky tepelnou oxidací ". doi:10.1016 / j.jeurceramsoc.2013.06.020. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Naito, Kazumi a Kabe, Isao (2005) „Metoda výroby pevného elektrolytického kondenzátoru“ US patent 6 882 522
- ^ Reed, T. B .; Pollard, E. R .; Lonney, L. E.; Loehman, R.E .; Honig, J. M. (2007). "Oxid niobičitý". Anorganické syntézy. 108–110. doi:10.1002 / 9780470132616.ch22. ISBN 9780470132616.
Citované zdroje
- Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97. vydání). Boca Raton, FL: CRC Press. ISBN 9781498754293.
